1 . 常温下,PdCO3和Pd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是
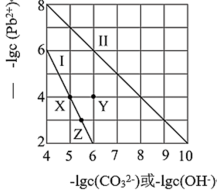
| A.向Z点对应溶液中加入适量的NaOH溶液,有可能得到X点对应溶液 |
| B.Y点对应的PdCO3分散系中,v(溶解)>v(沉淀),固体仍在溶解 |
C.PbCO3(s)+2OH-(aq) Pb(OH)2(s)+ Pb(OH)2(s)+ K=0.01 K=0.01 |
| D.由两者的Ksp可知,Pd(OH)2的溶解度更小 |
您最近一年使用:0次
名校
2 . 用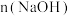 为
为 的
的 浓溶液吸收一定量的氯气,充分反应后溶液中只含有
浓溶液吸收一定量的氯气,充分反应后溶液中只含有 、
、 、
、 三种溶质。下列判断不正确的是
三种溶质。下列判断不正确的是
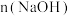 为
为 的
的 浓溶液吸收一定量的氯气,充分反应后溶液中只含有
浓溶液吸收一定量的氯气,充分反应后溶液中只含有 、
、 、
、 三种溶质。下列判断不正确的是
三种溶质。下列判断不正确的是A.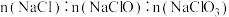 可能为9:4:1 可能为9:4:1 |
B.若反应中转移的电子的物质的量为 ,则 ,则 |
C.被吸收的氯气的物质的量为 |
D. 可能为14:9 可能为14:9 |
您最近一年使用:0次
2022-11-15更新
|
1284次组卷
|
6卷引用:四川省内江市第六中学2022-2023学年高一下学期入学考试化学试题
解题方法
3 . CO2是一种宝贵的资源,在生产、生活中有广泛的用途。同时,二氧化碳也是一种常见的温室气体,大气中CO2含量的增加是导致全球变暖的主要原因之一。为此,我国已向世界庄严承诺,力争2030年前实现碳达峰,2060年前实现碳中和。
(1)正常雨水显酸性,原因是________ 。举例说明CO2的重要用途________ (任举2例)。
(2)含碳燃料完全燃烧生成CO2。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH = 5.60, c(H2CO3)= 1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3
 + H+的电离常数K1=
+ H+的电离常数K1=_______ 。 (保留1位小数,已知:10-5.60 =2.5×10-6)。
(3)以CO2和NH3为原料合成尿素CO(NH2)2是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I : 2NH3(g) + CO2(g) NH2COONH4(s) △H1=-159.47 kJ·mol-1
NH2COONH4(s) △H1=-159.47 kJ·mol-1
反应II: NH2COONH4(s) CO(NH2)2(s) + H2O(g) △H2= +72.49 kJ·mol-l
CO(NH2)2(s) + H2O(g) △H2= +72.49 kJ·mol-l
请回答下列问题:
①写出CO2和NH3为原料生成尿素和气态水的热化学方程式_______ ,反应I自发进行的条件是_______ 。
②以CO2和NH3为原料合成尿素的反应中,影响CO2转化率的因素很多,图1为某特定条件下,不同水碳比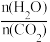 和温度影响CO2转化率变化的趋势曲线。下列说法错误的是
和温度影响CO2转化率变化的趋势曲线。下列说法错误的是_______ (填正确答案标号)。
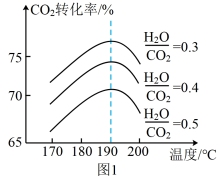
A.其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是降低水碳比
B.移走部分尿素平衡向正方向移动
C.当温度低于190 °C,随温度升高CO2转化率逐渐增大,其原因可能是温度升高平衡向正方向移动
D.当温度高于190 °C后,随温度升高CO2转化率逐渐减小,其原因可能是温度升高发生了副反应
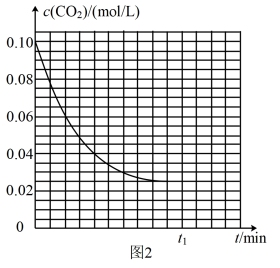
③某研究小组为探究反应I中影响c(CO2)的因素,在恒温下将0.4 mol NH3和0.2 molCO2放入容积为2L的密闭容器中,t1时达到平衡,其c(CO2)随时间t变化趋势曲线如下图2所示。则0~t1时段,用NH3表示的平均反应速率为_______ mol·L-1·min-l (用含t1的式子表示),其反应的平衡常数为______ 。(mol·L-1)-3。
(1)正常雨水显酸性,原因是
(2)含碳燃料完全燃烧生成CO2。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH = 5.60, c(H2CO3)= 1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3

 + H+的电离常数K1=
+ H+的电离常数K1=(3)以CO2和NH3为原料合成尿素CO(NH2)2是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I : 2NH3(g) + CO2(g)
 NH2COONH4(s) △H1=-159.47 kJ·mol-1
NH2COONH4(s) △H1=-159.47 kJ·mol-1反应II: NH2COONH4(s)
 CO(NH2)2(s) + H2O(g) △H2= +72.49 kJ·mol-l
CO(NH2)2(s) + H2O(g) △H2= +72.49 kJ·mol-l请回答下列问题:
①写出CO2和NH3为原料生成尿素和气态水的热化学方程式
②以CO2和NH3为原料合成尿素的反应中,影响CO2转化率的因素很多,图1为某特定条件下,不同水碳比
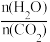 和温度影响CO2转化率变化的趋势曲线。下列说法错误的是
和温度影响CO2转化率变化的趋势曲线。下列说法错误的是
A.其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是降低水碳比
B.移走部分尿素平衡向正方向移动
C.当温度低于190 °C,随温度升高CO2转化率逐渐增大,其原因可能是温度升高平衡向正方向移动
D.当温度高于190 °C后,随温度升高CO2转化率逐渐减小,其原因可能是温度升高发生了副反应
③某研究小组为探究反应I中影响c(CO2)的因素,在恒温下将0.4 mol NH3和0.2 molCO2放入容积为2L的密闭容器中,t1时达到平衡,其c(CO2)随时间t变化趋势曲线如下图2所示。则0~t1时段,用NH3表示的平均反应速率为

您最近一年使用:0次
名校
解题方法
4 . (1)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子只有H2O,根据题意回答下列问题。
①写出酸H2A的电离方程式:_____
②若溶液M由10 mL 2 mol∙L-1 NaHA 溶液与10 mL2 mol∙L-1 NaOH溶液混合而得,则溶液M的pH_______ (填“>”“<”或“=”)7,溶液M中各粒子的浓度关系正确的是____ (填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+2c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
D.c(A2-)+c(HA-)=1mol∙L-1
(2)实验室可用NaOH溶液吸收NO2,,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1 mol∙L-1的CH3COONa溶液,则两溶液中c( )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为____ (已知HNO2的电离常数Ka=7.1×10-4, CH3COOH的电离常数Ka=1.7×10-5)。可使溶液A和溶液B的 pH相等的方法是_____ (填序号)。
a.向溶液A中加适量水 b.向溶液A中加适量 NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.吸收液(NaOH溶液)吸收SO2的过程中,pH随n( ):n(
):n( )的变化关系如下表:
)的变化关系如下表:
①由上表判断 NaHSO3溶液显_______ 性。
②当吸收液呈中性时,溶液中离子浓度的大小关系为_______
①写出酸H2A的电离方程式:
②若溶液M由10 mL 2 mol∙L-1 NaHA 溶液与10 mL2 mol∙L-1 NaOH溶液混合而得,则溶液M的pH
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+2c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
D.c(A2-)+c(HA-)=1mol∙L-1
(2)实验室可用NaOH溶液吸收NO2,,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1 mol∙L-1的CH3COONa溶液,则两溶液中c(
 )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为a.向溶液A中加适量水 b.向溶液A中加适量 NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.吸收液(NaOH溶液)吸收SO2的过程中,pH随n(
 ):n(
):n( )的变化关系如下表:
)的变化关系如下表:n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度的大小关系为
您最近一年使用:0次
名校
5 . 钪是地壳中含量极少的稀土元素,但在照明、合金和陶瓷材料、催化化学等领域具有重要应用价值。钛铁矿主要成分为TiO2、FeO、Fe2O3,还含有Mg、Si、Sc等元素,从钛铁矿中提取Sc2O3的流程如下:

回答下列问题:
(1)“酸浸”时,为提高浸取效率,可以采取的措施有___________ (答两个)。滤渣1的主要成分是___________ 。
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是___________ 。
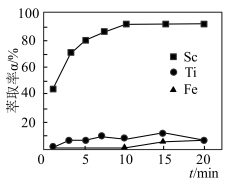
(3)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时适宜的振荡时间为___________ min。“洗钛”所得[TiO(H2O2)]2+为橘黄色的稳定离子,其中氧的化合价有-2、-1两种,则Ti的化合价为___________ 。
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol/L,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的pH范围是___________ 。
已知:当离子浓度减小至10-5 mol/L时可认为沉淀完全。lg2=0.3;室温下TiO2+完全沉淀的pH为1.05,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33。
(5)加草酸“沉钪”的离子方程式为___________ 。
(6)“沉钪”后获得Sc2O3的方法是___________ ,该反应产生的气体必须回收利用,其意义是___________ 。

回答下列问题:
(1)“酸浸”时,为提高浸取效率,可以采取的措施有
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
(3)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时适宜的振荡时间为

(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol/L,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的pH范围是
已知:当离子浓度减小至10-5 mol/L时可认为沉淀完全。lg2=0.3;室温下TiO2+完全沉淀的pH为1.05,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33。
(5)加草酸“沉钪”的离子方程式为
(6)“沉钪”后获得Sc2O3的方法是
您最近一年使用:0次
2021-01-07更新
|
1947次组卷
|
7卷引用:四川省绵阳南山中学2021-2022学年高三上学期入学考试理综化学试题
四川省绵阳南山中学2021-2022学年高三上学期入学考试理综化学试题四川省绵阳市梓潼中学校2023-2024学年高三上学期入学考试理科综合化学试题四川省自贡市田家炳中学2021届高三12月月考化学试题四川省泸州市泸县第四中学2022届高三三诊模拟考试理科综合化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)工业流程题
名校
解题方法
6 . 常温下,向1L 1.0mol/L的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是
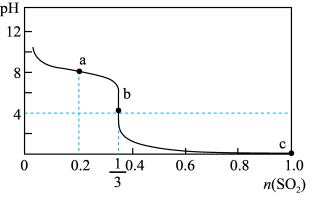

| A.常温下,HClO电离平衡常数的数量级为10﹣8 |
| B.a点溶液中存在 4c(Cl-)=c(HClO)+c(ClO-) |
C.b点溶液中存在c(Na+)>c(SO )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
| D.c点溶液中c(H+)=2mol/L |
您最近一年使用:0次
2020-11-12更新
|
1728次组卷
|
5卷引用:四川省阆中中学2021届高三上学期开学考试化学试题
名校
7 . 已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是


| A.电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移 |
| B.Ni极的电极反应式是HO2-+2e-+H2O=3OH- |
| C.电池工作结束后,电解质溶液的pH降低 |
| D.Al电极质量减轻13.5g,电路中通过9.03×1023个电子 |
您最近一年使用:0次
2019-05-24更新
|
3331次组卷
|
6卷引用:四川省泸县第五中学2020届高三上学期开学考试理综化学试题
名校
8 . 在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HCl溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
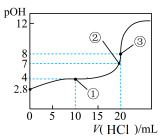
| A.图中②点所示溶液的导电能力弱于①点 |
| B.③点处水电离出的c(H+)=1×10-8mol·L-1 |
| C.图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| D.25℃时氨水的Kb约为5×10-5.6mol·L-1 |
您最近一年使用:0次
2019-05-24更新
|
3118次组卷
|
13卷引用:四川省泸县第五中学2020届高三上学期开学考试理综化学试题
四川省泸县第五中学2020届高三上学期开学考试理综化学试题四川省绵阳中学2023-2024学年高二下学期开学化学试题黑龙江省双鸭山市第一中学2023-2024学年高二下学期开学化学试题四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题【市级联考】山东省烟台市、菏泽市2019届高三下学期5月高考适应性练习(一)理科综合化学试题备考突破2020高三化学专题强化集训——盐类水解中三大守恒的应用安徽省定远县重点中学2020届高三下学期3月线上模拟考试理科综合化学试题湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题山西省实验中学2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题江西省宜春市上高中学2023-2024学年高二上学期第二次月考化学试卷 2024年江西省宜春市第一中学高三下学期第三次模拟考试化学试卷
名校
9 . 氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________ .
②过程(Ⅰ)和过程(Ⅱ)的反应热________ (填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________ .
b.N2的平衡转化率为________ .
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________ (填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____ (用含a、c的代数式表示),K3=_____ (用K1和K2表示).反应Ⅲ中的ΔS______ (填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
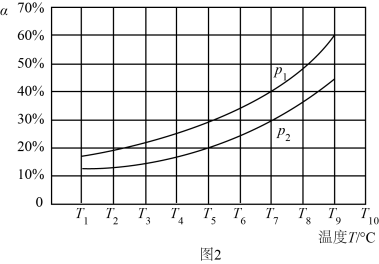
①分析得p1________ p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________ (填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
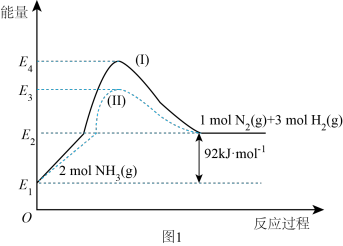
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(Ⅰ)和过程(Ⅱ)的反应热
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为
b.N2的平衡转化率为
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3则反应Ⅱ中的b=
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:

①分析得p1
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
您最近一年使用:0次
2019-04-28更新
|
1186次组卷
|
7卷引用:四川省泸州市泸县第一中学2021-2022学年高二下学期入学考试化学试题
10 . 过渡金属催化的新型碳﹣碳偶联反应是近年来有机合成的研究热点之一,如:
反应①
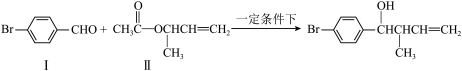
化合物Ⅱ可由化合物Ⅲ合成:

(1)化合物Ⅰ的分子式______
(2)化合物Ⅱ与Br2加成的产物的结构简式为_____________
(3)化合物Ⅲ的结构简式为_______________
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为___________ (注明反应条件),因此,在碱性条件下,由Ⅳ与CH3CO﹣Cl反应生成Ⅱ,其反应类型为__________ 。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为____________________ (写出其中一种)。
反应①

化合物Ⅱ可由化合物Ⅲ合成:

(1)化合物Ⅰ的分子式
(2)化合物Ⅱ与Br2加成的产物的结构简式为
(3)化合物Ⅲ的结构简式为
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为
您最近一年使用:0次
2019-01-30更新
|
1641次组卷
|
11卷引用:2015届四川省新津中学高三入学考试化学试卷
(已下线)2015届四川省新津中学高三入学考试化学试卷(已下线)2011-2012学年安徽省铜陵一中高二6月月考化学试卷(已下线)2014年高中化学二轮创新训练上 专题15有机化学基础选考练习卷2012年普通高等学校招生全国统一考试化学(广东卷)2015-2016学年山东省东平一中高二下期6月月考化学试卷云南省马关县第二中学2019-2020学年高二上学期期末考试化学试题云南省开远市第二中学校2019-2020学年高二上学期期末考试化学试题贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高二上学期期末考试化学试题贵州省榕江县第三高级中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市师宗县第二中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市大新县大新中学2019-2020学年高二上学期期末考试化学试题



