氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
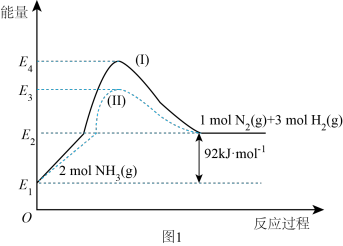
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________ .
②过程(Ⅰ)和过程(Ⅱ)的反应热________ (填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________ .
b.N2的平衡转化率为________ .
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________ (填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____ (用含a、c的代数式表示),K3=_____ (用K1和K2表示).反应Ⅲ中的ΔS______ (填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
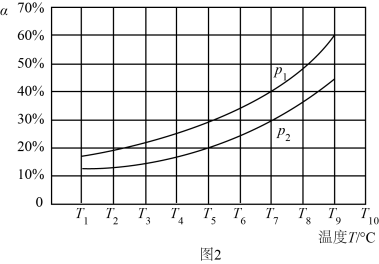
①分析得p1________ p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________ (填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(Ⅰ)和过程(Ⅱ)的反应热
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为
b.N2的平衡转化率为
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3则反应Ⅱ中的b=
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:

①分析得p1
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
更新时间:2019-04-28 15:57:45
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
名校
【推荐1】铜及其化合物是高中化学的重要组成部分,在工农业生产中具有重要的应用。
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要___________ (填化学式)。
(2)已知CuCl在氨水中络合后极易被空气中的 氧化。
氧化。
①补齐下列离子方程式:__________ 。
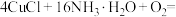 ___________
___________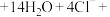 ___________
___________
②现将Cu置于 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为___________ 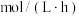 。
。
(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:

ⅱ: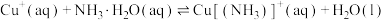

ⅲ: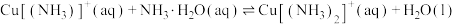
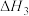
①反应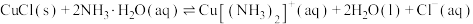
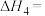
___________ (用 、
、 、
、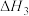 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是___________ (填元素符号)。
②对于上述相关平衡体系,下列说法不正确的是:___________ (填编号)
A.加水稀释,平衡后溶液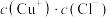 不变
不变
B.向体系中通入 ,有利于提高
,有利于提高 平衡转化率
平衡转化率
C.升高温度,有利于生成
D.溶液中存在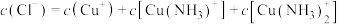
③向一定浓度的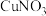 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数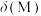 与
与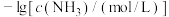 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数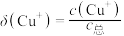 ,
, 。
。___________ 分布系数(填离子符号)。
(b)反应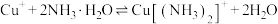 的
的
___________ 。(已知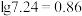 )
)
(c)c点的坐标为___________ 。(已知 )
)
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要
(2)已知CuCl在氨水中络合后极易被空气中的
 氧化。
氧化。①补齐下列离子方程式:
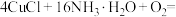 ___________
___________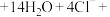 ___________
___________②现将Cu置于
 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为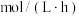 。
。(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:


ⅱ:
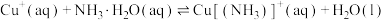

ⅲ:
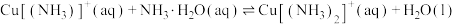
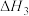
①反应
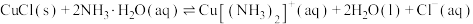
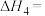
 、
、 、
、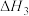 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是②对于上述相关平衡体系,下列说法不正确的是:
A.加水稀释,平衡后溶液
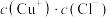 不变
不变B.向体系中通入
 ,有利于提高
,有利于提高 平衡转化率
平衡转化率C.升高温度,有利于生成

D.溶液中存在
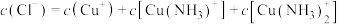
③向一定浓度的
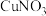 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数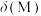 与
与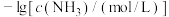 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数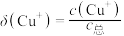 ,
, 。
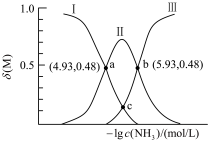
。
(b)反应
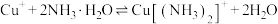 的
的
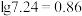 )
)(c)c点的坐标为
 )
)
您最近一年使用:0次
【推荐2】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:
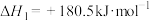

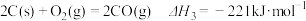
若某反应的平衡常数表达式为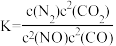 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2) 在一定条件下可发生分解:
在一定条件下可发生分解: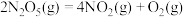 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是_____ (填字母)。
a. 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.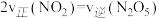 d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
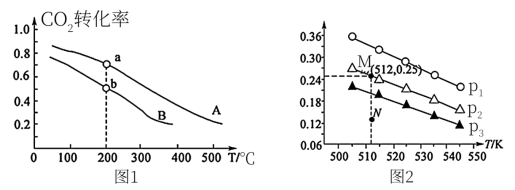
①a、b两点化学反应速率分别用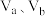 ,表示,则
,表示,则
_____  (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K=____________________ 。
(4)在1.0 L恒容密闭容器中投入1 mol 和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________ 。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在 及512 K时,图中N点
及512 K时,图中N点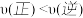
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即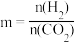 。
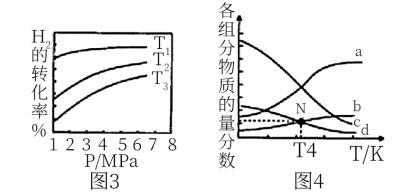
。
① 图3中投料比相同,温度 ,则该反应的焓变
,则该反应的焓变
_______ 0(填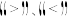 )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________ (填化学式)。
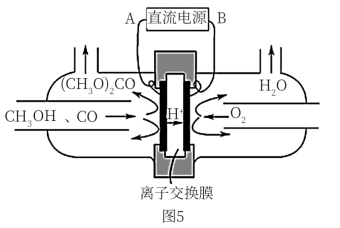
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为______ (填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:

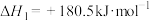

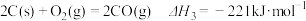
若某反应的平衡常数表达式为
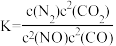 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)
 在一定条件下可发生分解:
在一定条件下可发生分解: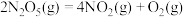 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是a.
 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化c.
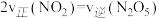 d. 气体的密度保持不变
d. 气体的密度保持不变(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) (3)将
 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用
 ,表示,则
,表示,则
 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)②列出a点对应的平衡常数表达式K=
(4)在1.0 L恒容密闭容器中投入1 mol
 和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为

D.在
 及512 K时,图中N点
及512 K时,图中N点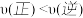

(5)
 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即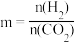 。
。① 图3中投料比相同,温度
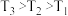 ,则该反应的焓变
,则该反应的焓变
 )。
)。② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为

您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】 是高效光催化剂,可用四氯化钛(
是高效光催化剂,可用四氯化钛( )来制备
)来制备 。
。
已知:Ⅰ.
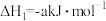
Ⅱ.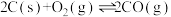
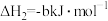
请回答下列问题:
(1) 与
与 反应生成
反应生成 、
、 和氧气的热化学方程式为
和氧气的热化学方程式为_______ 。
(2)若反应Ⅰ的逆反应活化能表示为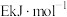 ,则E_______(填选项字母)。
,则E_______(填选项字母)。
(3)t℃时,向1L恒容密闭容器中充入0.1mol 和0.2mol
和0.2mol ,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中
,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中 的物质的量为0.02mol。
的物质的量为0.02mol。
①0~4min内 的反应速率
的反应速率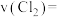
_______ 。
② 的平衡转化率
的平衡转化率
_______ 。
③下列措施即可加快反应速率,又能增大 平衡转化率的是
平衡转化率的是_______ (填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分 D.增大
D.增大 浓度
浓度
④t℃时,向10L恒容密闭容器中充入4mol 和一定量
和一定量 的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比(
的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比( )的关系如图所示:
)的关系如图所示:
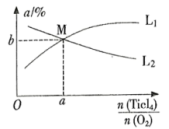
能表示 平衡转化率的曲线为
平衡转化率的曲线为_______ (填“ ”或“
”或“ ”);M点的坐标为
”);M点的坐标为_______ 。
(4)也可以利用四氯化钛( )水解制备
)水解制备 ,该反应的方程式为:
,该反应的方程式为:_______ 。
 是高效光催化剂,可用四氯化钛(
是高效光催化剂,可用四氯化钛( )来制备
)来制备 。
。已知:Ⅰ.

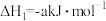
Ⅱ.
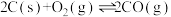
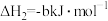
请回答下列问题:
(1)
 与
与 反应生成
反应生成 、
、 和氧气的热化学方程式为
和氧气的热化学方程式为(2)若反应Ⅰ的逆反应活化能表示为
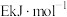 ,则E_______(填选项字母)。
,则E_______(填选项字母)。| A.大于a | B.小于a | C.等于a | D.无法确定 |
 和0.2mol
和0.2mol ,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中
,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中 的物质的量为0.02mol。
的物质的量为0.02mol。①0~4min内
 的反应速率
的反应速率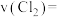
②
 的平衡转化率
的平衡转化率
③下列措施即可加快反应速率,又能增大
 平衡转化率的是
平衡转化率的是A.缩小容器容积 B.加入催化剂 C.分离出部分
 D.增大
D.增大 浓度
浓度④t℃时,向10L恒容密闭容器中充入4mol
 和一定量
和一定量 的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比(
的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比( )的关系如图所示:
)的关系如图所示:
能表示
 平衡转化率的曲线为
平衡转化率的曲线为 ”或“
”或“ ”);M点的坐标为
”);M点的坐标为(4)也可以利用四氯化钛(
 )水解制备
)水解制备 ,该反应的方程式为:
,该反应的方程式为:
您最近一年使用:0次
【推荐1】回答下列问题
(1)硫化氢( )、二氧化硫(
)、二氧化硫( )是有害气体,可用多种方法进行脱除。(已知25℃时,
)是有害气体,可用多种方法进行脱除。(已知25℃时, 的
的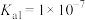 ,
,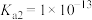 ,
, )
)
① 和
和 的VSEPR模型分别为
的VSEPR模型分别为______ 、______ 。
②室温下,若用足量的烧碱溶液吸收硫化氢气体,写出该反应的离子方程式______ ,计算25℃时,该反应的平衡常数为______ 。
③室温下,若在 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量 气体,此时溶液中的PH是
气体,此时溶液中的PH是______ 。
(2)通过电化学循环法可将 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: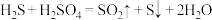 、
、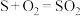

①电极a上发生反应的电极反应式为______ 。
②理论上1mol 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为______ 。
(3)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为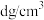 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,下列说法中正确的是______。
,下列说法中正确的是______。

(1)硫化氢(
 )、二氧化硫(
)、二氧化硫( )是有害气体,可用多种方法进行脱除。(已知25℃时,
)是有害气体,可用多种方法进行脱除。(已知25℃时, 的
的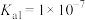 ,
,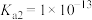 ,
, )
)①
 和
和 的VSEPR模型分别为
的VSEPR模型分别为②室温下,若用足量的烧碱溶液吸收硫化氢气体,写出该反应的离子方程式
③室温下,若在
 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量 气体,此时溶液中的PH是
气体,此时溶液中的PH是(2)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: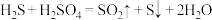 、
、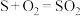

①电极a上发生反应的电极反应式为
②理论上1mol
 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(3)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为
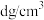 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,下列说法中正确的是______。
,下列说法中正确的是______。
A.该铁的氧化物化学式为 | B.距离 最近的 最近的 有6个 有6个 |
C.晶体中的 只能构成正四面体空隙 只能构成正四面体空隙 | D.晶胞的边长为 |
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
【推荐2】二甲醚主要用于替代汽车燃油、制氢及用于燃料电池原料。 回答下列问题
⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
0~800s 的二甲醚平均反应速率为__________________ 。
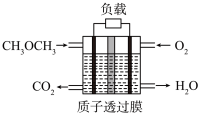
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为______ ,负极的电极反应式为 ____ 。
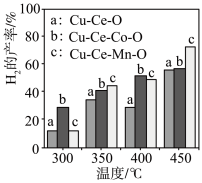
⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2产率与催化剂及温度下关系如下图 所示,适宜的催化剂是______ (选填 a、b、c)及适宜的温度是____ 。
⑷工业中用 CO 和 H2为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) ⇌ CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g)⇌ CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g)⇌ CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。
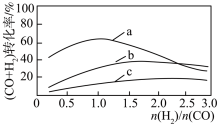
①最佳 n(H2)/n(CO)比为_________________ (填图中数字)。
②同一温度下,CO(g)+H2O(g)⇌ CO2(g)+H2(g)平衡常数为 K3,则 K3=__________ 用含 K1、K2代数式表示)。
⑸已知反应 CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2转化率为 75%,在下图中 画出 CO2和 CH3OH(g)的浓度随时间变化曲线________ 。

⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反应速率为
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为

⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2产率与催化剂及温度下关系如下图 所示,适宜的催化剂是

⑷工业中用 CO 和 H2为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) ⇌ CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g)⇌ CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g)⇌ CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。

①最佳 n(H2)/n(CO)比为
②同一温度下,CO(g)+H2O(g)⇌ CO2(g)+H2(g)平衡常数为 K3,则 K3=
⑸已知反应 CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2转化率为 75%,在下图中 画出 CO2和 CH3OH(g)的浓度随时间变化曲线

您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐3】已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
反应②: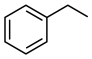 (g)
(g)
 (g)+H2(g),ΔH=+117.6kJ/mol。
(g)+H2(g),ΔH=+117.6kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式______________ 。该反应的化学平衡常数K=_________ (用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注_____ 。

(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)=0.125mol/L,则2NO2(g) N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=_____________ (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为___________ 。
(4)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
回答下列问题:
该反应为____________ 反应(填“吸热”、“放热”)。
能使该反应的反应速率增大,且平衡向正反应方向移动的_____________ 。
A. 及时分离出CO气体 B. 适当升高温度
C. 增大CO2的浓度 D. 选择高效催化剂
反应①:CO2(g)+H2(g)
 CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
CO(g)+H2O(g),ΔH= +41.2 kJ/mol;反应②:
 (g)
(g)
 (g)+H2(g),ΔH=+117.6kJ/mol。
(g)+H2(g),ΔH=+117.6kJ/mol。①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注

(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)=0.125mol/L,则2NO2(g)
 N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=(4)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
该反应为
能使该反应的反应速率增大,且平衡向正反应方向移动的
A. 及时分离出CO气体 B. 适当升高温度
C. 增大CO2的浓度 D. 选择高效催化剂
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐1】氮硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)=2NO2(g)△H的反应机理和各基元反应(基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
2NO(g) N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g) 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
N2O2(g)+O2(g)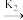 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)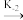 N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
①2NO(g)+O2(g) 2NO2(g)△H=
2NO2(g)△H=______ kJ•mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______ ;
②某温度下反应2NO(g)+O2(g) 2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是
2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是__________________ mol•L-1•s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______ 倍。
(2)2SO2(g)+O2(g) 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2 2V2O5(慢)
2V2O5(慢)
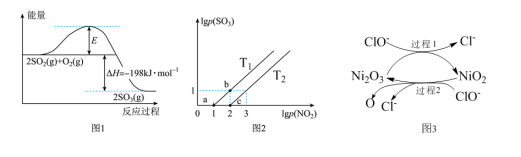
下列说法正确的是___________
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198kJ/mol
D.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g) NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①根据题意可知:T1______ T2(填“>”“<”或者“=”),理由是___________________ 。
②由平衡状态a到b,改变的条件是__________________ 。
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图3所示。
①过程2的离子方程式_______________________________ 。
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaClO更好,原因是________________ 。
(1)2NO(g)+O2(g)=2NO2(g)△H的反应机理和各基元反应(基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
2NO(g)
 N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)N2O2(g)
 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)N2O2(g)+O2(g)
 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)2NO2(g)
 N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)①2NO(g)+O2(g)
 2NO2(g)△H=
2NO2(g)△H=②某温度下反应2NO(g)+O2(g)
 2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是
2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是(2)2SO2(g)+O2(g)
 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2 2V2O5(慢)
2V2O5(慢)
下列说法正确的是
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198kJ/mol
D.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)
 NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。①根据题意可知:T1
②由平衡状态a到b,改变的条件是
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图3所示。
①过程2的离子方程式
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaClO更好,原因是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐2】化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g)。该反应在石英真空管中进行,如下图所示:
WI2(g)。该反应在石英真空管中进行,如下图所示:
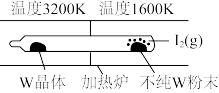
①该反应的平衡常数表达式K=_______ ,若K=1/2,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________ 。
②该反应的△H____ 0(填“>”或“<”),上述反应体系中可循环使用的物质____ 。
③能够说明上述反应已经达到平衡状态的有_________ (填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)利用“隔膜电解法”处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
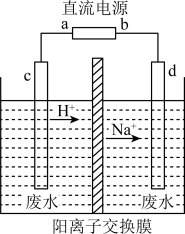
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________ (填化学式)。
②电解池阳极区的电极反应式为_________________ 。
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3000 mg·L-1的废水,可得到乙醇________ kg(计算结果保留小数点后一位)。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g)
 WI2(g)。该反应在石英真空管中进行,如下图所示:
WI2(g)。该反应在石英真空管中进行,如下图所示: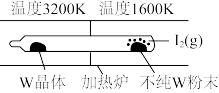
①该反应的平衡常数表达式K=
②该反应的△H
③能够说明上述反应已经达到平衡状态的有
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)利用“隔膜电解法”处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O
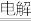 CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入
②电解池阳极区的电极反应式为
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3000 mg·L-1的废水,可得到乙醇
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
解题方法
【推荐3】高铁酸盐( )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知: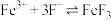
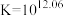

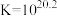
I.制备高铁酸盐
(1)制备 的原理是:
的原理是:

________
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的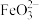 。此过程的反应为
。此过程的反应为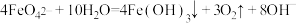 、
、___________ 。
为研究使 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中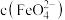 成正比。
成正比。

(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是___________ 。
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:___________ 。
(5)“—■—”曲线为___________ (填入“试管c”或“试管d”)的实验结果,理由是___________ 。
(6)综合以上讨论,任意写出一种能稳定 的方法
的方法___________ 。
 )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:
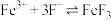
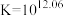

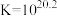
I.制备高铁酸盐
(1)制备
 的原理是:
的原理是:
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的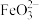 。此过程的反应为
。此过程的反应为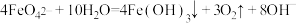 、
、为研究使
 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:| 序号 | X | 现象 | |
 | a | 2滴0.01 mol/L KI | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01 mol/L NaF 溶液 | ||
| d | 2滴0.01 mol/L  溶液 溶液 |
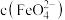 成正比。
成正比。
(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:
(5)“—■—”曲线为
(6)综合以上讨论,任意写出一种能稳定
 的方法
的方法
您最近一年使用:0次




