1 . CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2= + 41.0 kJ/mol
回答下列问题:
(1)已知CH4、CO和H2的燃烧热ΔH分别为-890.3 kJ/mol、-283.0 kJ/mol和-285.8 kJ/mol,该催化重整主反应的ΔH1=_______ kJ/mol。有利于提高CO2平衡转化率的条件是_______ (填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
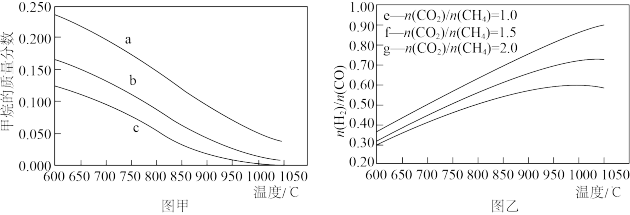
①甲烷的质量分数随温度变化的关系如图甲所示,曲线a对应的 =
=_______ 。
②反应体系中, 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比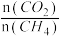 的增加,
的增加, 的值
的值_______ (填“增大”、“不变”或“减小”),其原因是_______ 。
(3)在800℃、101 kPa时,按投料比 =1.0加入刚性密闭容器中,达平衡时甲烷的转化率为90%,二氧化碳的转化率为95%,则副反应的平衡常数K=
=1.0加入刚性密闭容器中,达平衡时甲烷的转化率为90%,二氧化碳的转化率为95%,则副反应的平衡常数K=_______ (计算结果保留2位有效数字)。
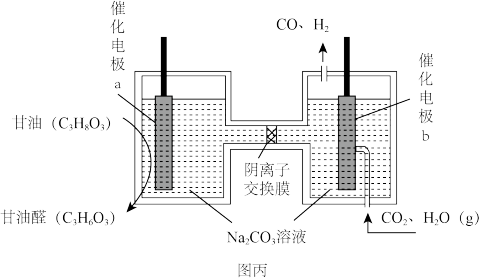
(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气CO和H2,同时获得甘油醛。则催化电极a为_______ 极,催化电极b产生CO的电极反应式为_______ 。
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2= + 41.0 kJ/mol
回答下列问题:
(1)已知CH4、CO和H2的燃烧热ΔH分别为-890.3 kJ/mol、-283.0 kJ/mol和-285.8 kJ/mol,该催化重整主反应的ΔH1=
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)在刚性密闭容器中,进料比
 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
①甲烷的质量分数随温度变化的关系如图甲所示,曲线a对应的
 =
=②反应体系中,
 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加, 的值
的值(3)在800℃、101 kPa时,按投料比
 =1.0加入刚性密闭容器中,达平衡时甲烷的转化率为90%,二氧化碳的转化率为95%,则副反应的平衡常数K=
=1.0加入刚性密闭容器中,达平衡时甲烷的转化率为90%,二氧化碳的转化率为95%,则副反应的平衡常数K=(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气CO和H2,同时获得甘油醛。则催化电极a为

您最近一年使用:0次
2 . 芬太尼是一种强效麻醉镇痛药,某研究小组按下列路线合成芬太尼。
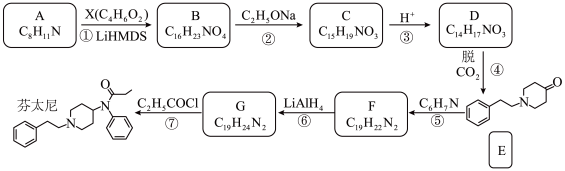
已知:
I.含碳碳双键的有机物与氨(NH3)或胺类物质(RNHR’)反应生成新的胺类化合物。如:R1CH=CH2+RNH2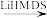 R1CH2CH2NHR
R1CH2CH2NHR
II. R1COOR2+R3CH2COOR4
 +R2OH
+R2OH
III. R1X+R2NH2→R1NHR2+HX
请回答:
(1)化合物X的结构简式是___________ 。
(2)下列说法正确的是___________。
(3)写出B→C的化学方程式___________ 。
(4)化合物Y(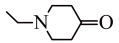 )也常用于合成芬太尼。请写出化合物Y下列条件的同分异构体的结构简式
)也常用于合成芬太尼。请写出化合物Y下列条件的同分异构体的结构简式___________ 。1H-NMR谱和IR谱检测表明:
①分子中有4种化学环境不同的氢原子;
②分子中只含一个环且为六元环,环中至少有一个非碳原子,环上的原子均无双键;
③分子中无羟基。
(5)设计以环氧乙烷、CH2=CH2和NH3、HCHO为原料制备Y(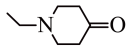 )的合成路线
)的合成路线_____ (用流程图表示,无机试剂任选)。已知:
 HO-CH2CH2CHO
HO-CH2CH2CHO

已知:
I.含碳碳双键的有机物与氨(NH3)或胺类物质(RNHR’)反应生成新的胺类化合物。如:R1CH=CH2+RNH2
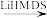 R1CH2CH2NHR
R1CH2CH2NHRII. R1COOR2+R3CH2COOR4

 +R2OH
+R2OHIII. R1X+R2NH2→R1NHR2+HX
请回答:
(1)化合物X的结构简式是
(2)下列说法正确的是___________。
| A.化合物A能与HCl发生反应 |
| B.反应②③⑦都是取代反应 |
| C.化合物F能发生加成、取代、氧化反应 |
| D.芬太尼的分子式是C21H28N2O |
(4)化合物Y(
 )也常用于合成芬太尼。请写出化合物Y下列条件的同分异构体的结构简式
)也常用于合成芬太尼。请写出化合物Y下列条件的同分异构体的结构简式①分子中有4种化学环境不同的氢原子;
②分子中只含一个环且为六元环,环中至少有一个非碳原子,环上的原子均无双键;
③分子中无羟基。
(5)设计以环氧乙烷、CH2=CH2和NH3、HCHO为原料制备Y(
 )的合成路线
)的合成路线
 HO-CH2CH2CHO
HO-CH2CH2CHO
您最近一年使用:0次
名校
解题方法
3 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3627次组卷
|
14卷引用:辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题
辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题山西省长治市2021-2022学年高一下学期期末联合考化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
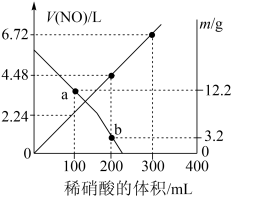
4 . 有关 反应的叙述正确的为
反应的叙述正确的为
 反应的叙述正确的为
反应的叙述正确的为| A.还原剂与氧化剂物质的量之比为5:3 |
| B.生成lmolO2,反应共转移4mol电子 |
C.若有5mol水做还原剂时,被BrF3还原的BrF3为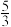 mol mol |
| D.若有5mol水参与反应时,被水还原的BrF3为2mol |
您最近一年使用:0次
2019-11-24更新
|
2665次组卷
|
7卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一下学期期初质量监测化学试题
13-14高二上·辽宁鞍山·期中
名校
5 . 在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是

| A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)> c(H+) >c(OH-) |
| B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C.在C点:c(CH3COO-)>c(Na+)> c(OH-) > c(H+) |
| D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
您最近一年使用:0次
2018-01-13更新
|
2115次组卷
|
6卷引用:辽宁省本溪市2019-2020学年高二下学期寒假验收考试化学试题
6 . 常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
| A.若混合后溶液pH=7,则c(NH4+)=c(Cl-) |
| B.若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1 |
您最近一年使用:0次
2017-02-28更新
|
1524次组卷
|
4卷引用:2016-2017学年辽宁省六校协作体高二下学期期初化学试卷
7 . 甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________ V逆(填“>”、“=”或“<”)
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是_______________ 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________ 。


(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为_______________ 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________ 。
反应①:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol反应②:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应③:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol(1)反应②的△H2=
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是


(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为
您最近一年使用:0次
8 . 水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】
①该混合气体只含有一氧化碳、氢气
②该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
③该混合气体只含有二氧化碳、氢气和水蒸气
④该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】
a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。
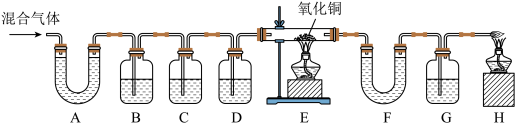
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有_________ 。B中变化的化学方程式为_____________ 。
(2)装置C中的药品为足量的烧碱溶液,其作用为____________ 。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是_________ ;E中的变化说明氧化铜具有_________ 性。(填“氧化”或“还原”)
【实验结论】
(4)上述四种猜想中,猜想___________ (填序号)是正确的。
【实验反思】
(5)经过讨论,同学们将上图中装置C~H进行了简化,只用下图所示装置并自选必要试剂就能完成探究。其中,干燥管中碱石灰的作用为____________ ,烧杯上能观察到的现象是___________ 。最后一步的实验操作及现象是___________ 。

【提出猜想】
①该混合气体只含有一氧化碳、氢气
②该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
③该混合气体只含有二氧化碳、氢气和水蒸气
④该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】
a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。

(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有
(2)装置C中的药品为足量的烧碱溶液,其作用为
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是
【实验结论】
(4)上述四种猜想中,猜想
【实验反思】
(5)经过讨论,同学们将上图中装置C~H进行了简化,只用下图所示装置并自选必要试剂就能完成探究。其中,干燥管中碱石灰的作用为

您最近一年使用:0次
9 . 七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2 两种盐的溶解度(单位为g/100g水)
硼镁泥制取七水硫酸镁的工艺流程如下:
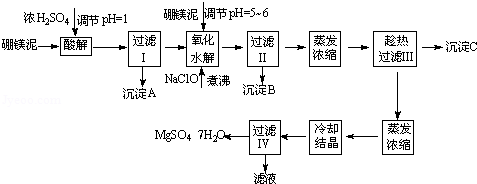
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 。
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 | |||||
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | |||||
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60 | ||||||||||
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | ||||||||||
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | ||||||||||
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 。
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 。
您最近一年使用:0次
2016-12-09更新
|
306次组卷
|
5卷引用:2016届辽宁省五校协作体高三上学期期初考试化学试卷
2016届辽宁省五校协作体高三上学期期初考试化学试卷2015-2016学年辽宁庄河高中高二下期末化学试卷(已下线)2011届黑龙江省牡丹江一中高三上学期期中考试化学试卷(已下线)2014届东北三省四市教研协作体高三联合考试理综化学试卷2016届黑龙江省绥化市第一中学高三上学期期中测试化学试卷
10 . 某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为____________ 。
(2)“碱浸”过程中发生的离子方程式是__________ 。
(3)“酸浸”时所加入的酸是___________ (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是______________ 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:____________ 。
(5)“调pH为2~3”的目的是______________ 。
(6)操作c的方法是:________________ ;
(7)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是__________ 。

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为
(2)“碱浸”过程中发生的离子方程式是
(3)“酸浸”时所加入的酸是
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:
(5)“调pH为2~3”的目的是
(6)操作c的方法是:
(7)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是
您最近一年使用:0次



