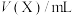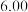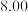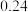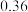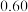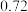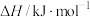研究二氧化碳的转化与减排具有重要的社会意义。用 还原
还原 的反应过程如下:
的反应过程如下:
①
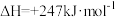
②

回答下列问题:
(1)

_______ 。
(2)同时提高 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是_______ 。
(3)在密闭容器中分别充入0.1mol 与0.3mol
与0.3mol 。
。
①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为____ ;该条件下,反应②的平衡常数为_____ 。
②在150℃时,改变密闭容器的体积,测得 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是____ ; 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是_______ 。 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能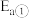
_______ 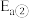 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②随温度升高, 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是_______ 。
 还原
还原 的反应过程如下:
的反应过程如下:①

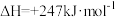
②


回答下列问题:
(1)


(2)同时提高
 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是(3)在密闭容器中分别充入0.1mol
 与0.3mol
与0.3mol 。
。①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出
 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为②在150℃时,改变密闭容器的体积,测得
 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是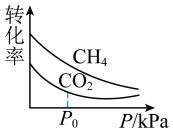
 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: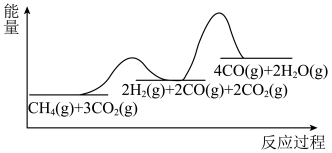
 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能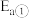
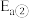 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②随温度升高,
 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是
2024·四川成都·二模 查看更多[2]
更新时间:2024-04-01 09:18:17
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐1】化学反应原理在科研和生产中有广泛应用.
Ⅰ.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:________NH4+ + 5O2== 2NO2- + ________H+ +__________+__________
Ⅱ.工业合成氨原理是:N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。

(1)曲线a对应的温度是 。
(2)关于工业合成氨的反应,下列叙述正确的是 。
Ⅲ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为______________________。
Ⅰ.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:________NH4+ + 5O2== 2NO2- + ________H+ +__________+__________
Ⅱ.工业合成氨原理是:N2(g)+3H2(g)
 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
(1)曲线a对应的温度是 。
(2)关于工业合成氨的反应,下列叙述正确的是 。
| A.及时分离出NH3可以提高H2的平衡转化率 |
| B.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N) |
| C.M点比N点的反应速率快 |
| D.如果N点时c(NH3)=0.2mol·L-1,N点的化学平衡常数K≈0.93L2/mol2 |
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为______________________。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐2】探究CH₃OH合成反应化学平衡的影响因素,有利于提高CH₃OH的产率。在一定条件下,以CO₂和H₂为原料合成CH₃OH涉及的主要反应如下:
①CO₂(g)+3H₂(g) CH₃OH(g)+H₂O(g) ΔH₁
CH₃OH(g)+H₂O(g) ΔH₁
②CO₂(g)+H₂(g) CO(g)+H₂O(g) ΔH₂
CO(g)+H₂O(g) ΔH₂
③CO(g)+2H₂(g) CH₃OH(g) ΔH₃
CH₃OH(g) ΔH₃
回答下列问题:
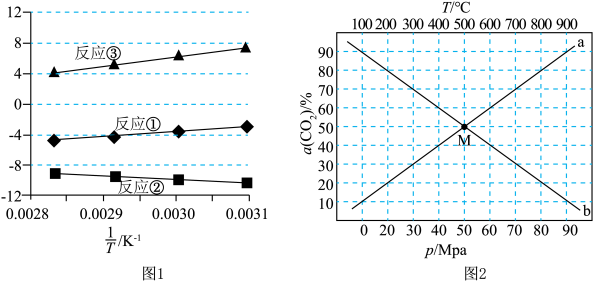
(1)ΔH₃=_______ (用ΔH₁、ΔH₂表示),已知反应①、②、③以物质的量分数表示的平衡常数KX与温度T变化关系如图1所示。据此判断 的数值范围是
的数值范围是_______ (填标号)。
A. -1 B.-1~0 C.0~1 D.
-1 B.-1~0 C.0~1 D. 1
1
(2)在催化剂N表面进行反应①,当起始量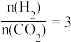 时,在不同条件下达到平衡,体系中CO₂的转化率为
时,在不同条件下达到平衡,体系中CO₂的转化率为 (CO₂),在T=400℃下
(CO₂),在T=400℃下 (CO₂)随压强变化关系和在p=60MPa下
(CO₂)随压强变化关系和在p=60MPa下 (CO₂)随温度变化关系如图2所示。其中代表在T=400℃下
(CO₂)随温度变化关系如图2所示。其中代表在T=400℃下 (CO₂)随压强变化关系的是
(CO₂)随压强变化关系的是________ 线(填“a”或“b”);a、b两线的交点M对应的平衡常数________ (填“相同”或“不同”)。当 (CO₂)为80%时,反应条件可能是
(CO₂)为80%时,反应条件可能是________ 。
(3)以In₂O₃作催化剂,可使CO₂在温和的条件下转化为CH₃OH,经历如下过程:
Ⅰ.催化剂活化:In₂O₃(无活性)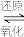 In2O3-x (有活性)
In2O3-x (有活性)
Ⅱ.CO₂和H₂在活化后的催化剂表面发生反应①,同时伴随反应②。
已知:CH₃OH选择性= 。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为
。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为 __________ ;同时将产物中的水蒸气导出,可以减少反应____________ (用化学方程式表示)的发生,达到减少催化剂失活,提高甲醇选择性的目的。
(4)温度为T℃时,在一个刚性容器中模拟工业上合成CH₃OH,往容器中通入1mol CO₂、3mol H₂,发生反应①和②,反应过程中容器内的压强随着时间变化如下表所示。
则反应开始至20 min的平均反应速率;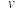 (CH₃OH)=
(CH₃OH)=__________ MPa/ min;已知平衡时CH₃OH的选择性为80%,则反应①的压强平衡常数Kp=___________ MPa-2(结果化为最简分数;压强平衡常数:用平衡分压代替平衡浓度,分压=总压×气体物质的量分数)。
①CO₂(g)+3H₂(g)
 CH₃OH(g)+H₂O(g) ΔH₁
CH₃OH(g)+H₂O(g) ΔH₁②CO₂(g)+H₂(g)
 CO(g)+H₂O(g) ΔH₂
CO(g)+H₂O(g) ΔH₂③CO(g)+2H₂(g)
 CH₃OH(g) ΔH₃
CH₃OH(g) ΔH₃回答下列问题:
(1)ΔH₃=
 的数值范围是
的数值范围是A.
 -1 B.-1~0 C.0~1 D.
-1 B.-1~0 C.0~1 D. 1
1
(2)在催化剂N表面进行反应①,当起始量
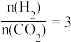 时,在不同条件下达到平衡,体系中CO₂的转化率为
时,在不同条件下达到平衡,体系中CO₂的转化率为 (CO₂),在T=400℃下
(CO₂),在T=400℃下 (CO₂)随压强变化关系和在p=60MPa下
(CO₂)随压强变化关系和在p=60MPa下 (CO₂)随温度变化关系如图2所示。其中代表在T=400℃下
(CO₂)随温度变化关系如图2所示。其中代表在T=400℃下 (CO₂)随压强变化关系的是
(CO₂)随压强变化关系的是 (CO₂)为80%时,反应条件可能是
(CO₂)为80%时,反应条件可能是(3)以In₂O₃作催化剂,可使CO₂在温和的条件下转化为CH₃OH,经历如下过程:
Ⅰ.催化剂活化:In₂O₃(无活性)
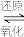 In2O3-x (有活性)
In2O3-x (有活性)Ⅱ.CO₂和H₂在活化后的催化剂表面发生反应①,同时伴随反应②。
已知:CH₃OH选择性=
 。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为
。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为 (4)温度为T℃时,在一个刚性容器中模拟工业上合成CH₃OH,往容器中通入1mol CO₂、3mol H₂,发生反应①和②,反应过程中容器内的压强随着时间变化如下表所示。
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 压强/MPa | 120 | 105 | 95 | 90 | 88 | 88 |
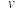 (CH₃OH)=
(CH₃OH)=
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐3】异丙醇(C3H8O)可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯(C3H6)的工业化技术已引起人们的关注,其主要反应如下:
I.C3H8O(g) C3H6(g)+H2O(g) △H1=+52kJ•mol-1
C3H6(g)+H2O(g) △H1=+52kJ•mol-1
II.2C3H6(g) C6H12(g) △H2=-97kJ•mol-1
C6H12(g) △H2=-97kJ•mol-1
回答下列问题:
(1)已知C3H8O(g)+9O2(g) 6CO2(g)+8H2O(g) △H3=-3750kJ•mol-1,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为
6CO2(g)+8H2O(g) △H3=-3750kJ•mol-1,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为_______ 。
(2)在1350℃下,刚性密闭容器中加入一定量的C3H8O,反应体系内水蒸气的浓度随反应时间关系如表:
①4~8μs内,v(C3H8O)=________ ppm•μs-1。
②t______ 16(填“>”“<”或“=”)。
③反应过程中,关于反应I、II的叙述一定正确的是______ (填字母)。
A.反应I、II到20μs时才开始达到平衡
B.混合气体密度不变说明反应I、II已达平衡
C.H2O(g)的分压不变说明反应I、II已达平衡
D.n(C3H6)=2n(C6H12)说明反应II达到平衡
E.C3H8O浓度不再变化说明反应I、II已达平衡
F.平衡时C3H6的浓度小于4100ppm
(3)在一定条件下,若反应I、II的转化率分别为65%和40%,则丙烯的产率为________ 。
(4)如图为反应I、II达到平衡时lgKp与温度的关系曲线。

(已知:对于可逆反应aA(g)+bB(g) cC(g)+dD(g),任意时刻Qp=
cC(g)+dD(g),任意时刻Qp= ,式中p(X)表示气体X的分压:p(X)=总压(p总)•X的物质的量分数。)
,式中p(X)表示气体X的分压:p(X)=总压(p总)•X的物质的量分数。)
①在350℃恒容平衡体系中加入少量C3H6气体时,反应II的状态最有可能对应图中的______ (填“甲”“乙”或“丙”)点,判断依据是________ 。
②350℃时,在密闭容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的分压为xMPa,则水蒸气的分压为________ MPa(用含x的代数式表示)。
I.C3H8O(g)
 C3H6(g)+H2O(g) △H1=+52kJ•mol-1
C3H6(g)+H2O(g) △H1=+52kJ•mol-1II.2C3H6(g)
 C6H12(g) △H2=-97kJ•mol-1
C6H12(g) △H2=-97kJ•mol-1回答下列问题:
(1)已知C3H8O(g)+9O2(g)
 6CO2(g)+8H2O(g) △H3=-3750kJ•mol-1,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为
6CO2(g)+8H2O(g) △H3=-3750kJ•mol-1,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为(2)在1350℃下,刚性密闭容器中加入一定量的C3H8O,反应体系内水蒸气的浓度随反应时间关系如表:
| 反应时间/μs | 0 | 4 | 8 | 12 | t | 20 | 40 | 80 | … |
| H2O浓度/ppm | 0 | 2440 | 3200 | 3600 | 4000 | 4100 | 4100 | 4100 | … |
②t
③反应过程中,关于反应I、II的叙述一定正确的是
A.反应I、II到20μs时才开始达到平衡
B.混合气体密度不变说明反应I、II已达平衡
C.H2O(g)的分压不变说明反应I、II已达平衡
D.n(C3H6)=2n(C6H12)说明反应II达到平衡
E.C3H8O浓度不再变化说明反应I、II已达平衡
F.平衡时C3H6的浓度小于4100ppm
(3)在一定条件下,若反应I、II的转化率分别为65%和40%,则丙烯的产率为
(4)如图为反应I、II达到平衡时lgKp与温度的关系曲线。

(已知:对于可逆反应aA(g)+bB(g)
 cC(g)+dD(g),任意时刻Qp=
cC(g)+dD(g),任意时刻Qp= ,式中p(X)表示气体X的分压:p(X)=总压(p总)•X的物质的量分数。)
,式中p(X)表示气体X的分压:p(X)=总压(p总)•X的物质的量分数。)①在350℃恒容平衡体系中加入少量C3H6气体时,反应II的状态最有可能对应图中的
②350℃时,在密闭容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的分压为xMPa,则水蒸气的分压为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐1】铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1) 铁粉与
铁粉与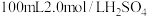 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。 反应平均速率
反应平均速率
_______ 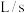 ;
;
② 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:_______ 。
(2)常温下, 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)
(3)反应 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。__________________________________________ ;
②反应过程中由于 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:____________________________________ 。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为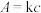 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: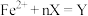 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为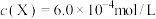 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
根据此数据,可以推断反应计量数 ,并计算
,并计算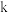 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。
已知:1.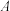 为吸光度,无单位;
为吸光度,无单位;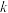 为常数,单位为
为常数,单位为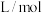 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。
①使用该方法时,需要控制 在2~9之间,其原因为:
在2~9之间,其原因为:____________________ 。
② 中
中 的配位数为
的配位数为_______ 。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下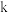 值为
值为______________ 。
(1)
 铁粉与
铁粉与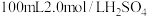 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。
 反应平均速率
反应平均速率
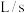 ;
;②
 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:(2)常温下,
 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)A.增大 溶液的浓度,平衡常数增大 溶液的浓度,平衡常数增大 |
B.向上述平衡体系中加入适量 固体,平衡不移动 固体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,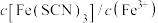 减小 减小 |
(3)反应
 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。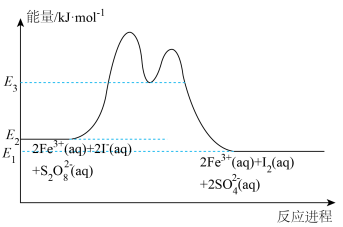
②反应过程中由于
 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为
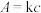 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: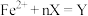 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为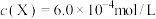 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 ,并计算
,并计算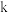 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。已知:1.
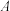 为吸光度,无单位;
为吸光度,无单位;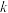 为常数,单位为
为常数,单位为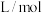 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。2.邻二氮菲的结构如图所示: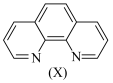
①使用该方法时,需要控制
 在2~9之间,其原因为:
在2~9之间,其原因为:②
 中
中 的配位数为
的配位数为A.2 B.3 C.6 D.8
③该实验条件下
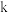 值为
值为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
【推荐2】甲烷蒸汽重整(SMR)是目前工业制氢的主要手段,主要包括甲烷催化重整以及水煤气变化两步反应。
反应I: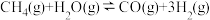
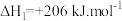
反应Ⅱ: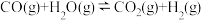
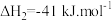
(1)SMR工艺的总反应: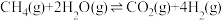
 =
=___________ 。
(2)下列反应条件选择及解释正确的是___________(填字母)。
(3)100kPa下,将n(CH4):n(H2O)=1:3的混合气体投入恒压反应器p=100kPa中,平衡时,各组分的物质的量分数与温度的关系如图所示。
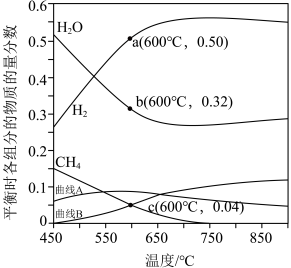
①图中CO平衡曲线分别是=___________ (选填“A”或“B”)。
②反应在600℃、t小时后达到平衡,t小时内计算v(CH4)=___________ kPa.h-1(用含t的代数式表示)。
③反应在600℃,CH4的平衡转化率___________ (保留小数点后两位),反应I的Kp=___________ 。
④系统中H2的含量,在700℃左右出现峰值,试从平衡角度解释出现峰值的原因:
a.低于700℃,___________ ;b.高于700℃,___________ 。
反应I:
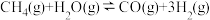
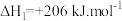
反应Ⅱ:
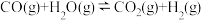
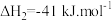
(1)SMR工艺的总反应:
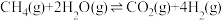
 =
=(2)下列反应条件选择及解释正确的是___________(填字母)。
| A.升高温度,反应I平衡正向移动、反应Ⅱ平衡逆向移动 |
| B.为提高甲烷催化重整的转化率,反应I应该在较高温度下进行 |
| C.恒温、恒容条件下,通入Ar,体系压强增大,反应速率加快 |
| D.恒温、恒容条件下,通入水蒸气,活化分子百分数增大,反应速率加快 |
(3)100kPa下,将n(CH4):n(H2O)=1:3的混合气体投入恒压反应器p=100kPa中,平衡时,各组分的物质的量分数与温度的关系如图所示。

①图中CO平衡曲线分别是=
②反应在600℃、t小时后达到平衡,t小时内计算v(CH4)=
③反应在600℃,CH4的平衡转化率
④系统中H2的含量,在700℃左右出现峰值,试从平衡角度解释出现峰值的原因:
a.低于700℃,
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐3】过氧化钙常用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂。在食品、牙粉、化妆品等制造中广泛使用。查阅资料:过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
(Ⅰ)CaO2的制备原理:CaCl2+H2O2 +2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl 实验步骤、反应装置如图所示,请回答下列问题:
实验步骤:

实验装置

(1)仪器X的名称____________ 。
(2)加入氨水的作用是__________ 。
(3)该合成反应生成沉淀的过程中,关键是控制温度,其合理的措施是_________。
(4)① 过滤后洗涤沉淀的试剂最好用__________ 。
A.热水 B.冷水 C.乙醇 D.乙醚
② 如何判断沉淀已经洗涤干净__________________ 。
(Ⅱ)产品稳定性分析:取I中所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000 mol·L-1酸性高锰酸钾溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如下表
已知:a.H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解。
b.产品稳定性=(放置一个月后CaO2的质量分数/放置前CaO2的质量分数)×100%
(5)用KMnO4滴定,达到滴定终点时的现象是___________ 。
(6)该产品的“产品稳定性”=_______________ 。
(Ⅰ)CaO2的制备原理:CaCl2+H2O2 +2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl 实验步骤、反应装置如图所示,请回答下列问题:
实验步骤:

实验装置

(1)仪器X的名称
(2)加入氨水的作用是
(3)该合成反应生成沉淀的过程中,关键是控制温度,其合理的措施是_________。
| A.冰水浴 | B.不断搅拌 |
| C.逐滴滴加CaCl2溶液 | D.直接加CaCl2固体,而不用其溶液滴加 |
A.热水 B.冷水 C.乙醇 D.乙醚
② 如何判断沉淀已经洗涤干净
(Ⅱ)产品稳定性分析:取I中所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000 mol·L-1酸性高锰酸钾溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如下表
| 数据 时间 | 样品取用质量/g | 平均消耗体积KMnO4/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.90 |
b.产品稳定性=(放置一个月后CaO2的质量分数/放置前CaO2的质量分数)×100%
(5)用KMnO4滴定,达到滴定终点时的现象是
(6)该产品的“产品稳定性”=
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐1】含氮化合物在生产生活中有重要的应用。请回答:
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
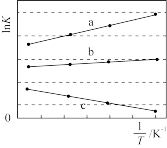
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是____ 。
②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图____ 。
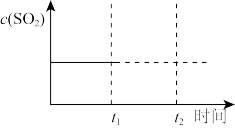
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
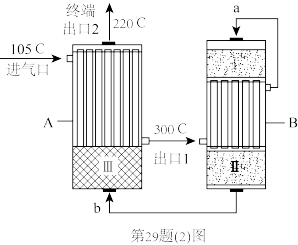
①温度比较:气流a____ 气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:____ 。
③下列说法正确的是____ 。
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l) NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)=____ mol·L-1。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为K+NH3=K++e(NH3) (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式____ 。
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是

②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图
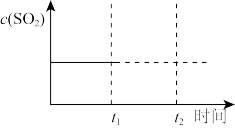
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
①温度比较:气流a
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l)
 NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)= (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐2】我国含硫天然气资源丰富,甲烷与硫化氢重整制氢和天然气脱硫具有重要的现实意义。回答下列问题:
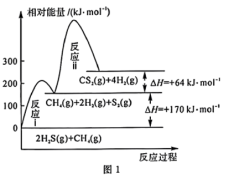
(1)甲烷和硫化氢重整制氢反应为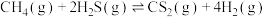 ,反应过程中反应i、反应ii的相对能量变化如图1所示。甲烷和硫化氢重整制氢反应在高温下可自发进行,理由是
,反应过程中反应i、反应ii的相对能量变化如图1所示。甲烷和硫化氢重整制氢反应在高温下可自发进行,理由是___________ 。已知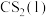 的燃烧热
的燃烧热 kJ⋅mol-1,则
kJ⋅mol-1,则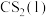 燃烧的热化学方程式为
燃烧的热化学方程式为___________ 。
(2)在压强为16a kPa的恒压条件下,起始时按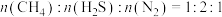 (
( 不参与反应)向某密闭容器中充入反应混合物,发生(1)中的甲烷和硫化氢重整制氢反应,温度变化对平衡时反应混合物中
不参与反应)向某密闭容器中充入反应混合物,发生(1)中的甲烷和硫化氢重整制氢反应,温度变化对平衡时反应混合物中 、
、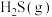 、
、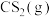 、
、 的物质的量分数的影响如图2所示。
的物质的量分数的影响如图2所示。

①研究发现,在800~940℃温度区间内,随着温度升高, 在平衡反应混合物中的含量迅速下降,而
在平衡反应混合物中的含量迅速下降,而 的含量几乎为0,其原因是
的含量几乎为0,其原因是___________ 。若在900℃和16a kPa的条件下,保持通入的混合气体中 的物质的量分数
的物质的量分数 不变,提高
不变,提高 投料比,
投料比, 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。
②研究发现,当温度高于950℃时,平衡混合物中 非常接近4.则M点对应温度下,
非常接近4.则M点对应温度下, 的平衡转化率约为
的平衡转化率约为___________ %(保留1位小数)。该温度下反应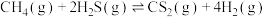 的压强平衡常数
的压强平衡常数
___________ 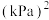 。
。
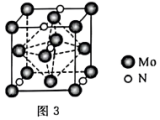
(3)据报道,我国科学家以氮化钼为催化剂进行甲烷与硫化氢重整制氢反应,取得了良好的选择性。氮化钼属于填隙式氮化物,N原子填充在金属钼(Mo)晶胞的部分八面体空隙中(如图3),晶胞中各棱边夹角均为90°。若氮化钼晶体的密度为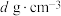 ,则晶胞参数为
,则晶胞参数为___________ pm。若将 填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入
填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入___________ 个 。
。
(1)甲烷和硫化氢重整制氢反应为
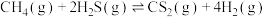 ,反应过程中反应i、反应ii的相对能量变化如图1所示。甲烷和硫化氢重整制氢反应在高温下可自发进行,理由是
,反应过程中反应i、反应ii的相对能量变化如图1所示。甲烷和硫化氢重整制氢反应在高温下可自发进行,理由是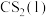 的燃烧热
的燃烧热 kJ⋅mol-1,则
kJ⋅mol-1,则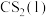 燃烧的热化学方程式为
燃烧的热化学方程式为
(2)在压强为16a kPa的恒压条件下,起始时按
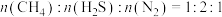 (
( 不参与反应)向某密闭容器中充入反应混合物,发生(1)中的甲烷和硫化氢重整制氢反应,温度变化对平衡时反应混合物中
不参与反应)向某密闭容器中充入反应混合物,发生(1)中的甲烷和硫化氢重整制氢反应,温度变化对平衡时反应混合物中 、
、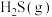 、
、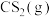 、
、 的物质的量分数的影响如图2所示。
的物质的量分数的影响如图2所示。
①研究发现,在800~940℃温度区间内,随着温度升高,
 在平衡反应混合物中的含量迅速下降,而
在平衡反应混合物中的含量迅速下降,而 的含量几乎为0,其原因是
的含量几乎为0,其原因是 的物质的量分数
的物质的量分数 不变,提高
不变,提高 投料比,
投料比, 的平衡转化率
的平衡转化率②研究发现,当温度高于950℃时,平衡混合物中
 非常接近4.则M点对应温度下,
非常接近4.则M点对应温度下, 的平衡转化率约为
的平衡转化率约为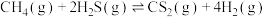 的压强平衡常数
的压强平衡常数
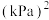 。
。(3)据报道,我国科学家以氮化钼为催化剂进行甲烷与硫化氢重整制氢反应,取得了良好的选择性。氮化钼属于填隙式氮化物,N原子填充在金属钼(Mo)晶胞的部分八面体空隙中(如图3),晶胞中各棱边夹角均为90°。若氮化钼晶体的密度为
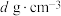 ,则晶胞参数为
,则晶胞参数为 填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入
填入氮化钼晶胞的八面体空隙中,每个晶胞最多还能填入 。
。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】工业上合成氨工艺流程一般分三步:第一步为原料气的制备,将天然气等原料制成含氢和氮的粗原料气;第二步为净化,主要包括变换过程、脱硫脱碳过程以及气体精制过程;第三步为氨合成,将纯净的氢氮混合气压缩,增大压强,在催化剂的作用下合成氨。
(1)“一次转化”过程中 气体与水蒸气反应转化为CO和
气体与水蒸气反应转化为CO和 混合气体,已知几种物质的燃烧热如表所示:
混合气体,已知几种物质的燃烧热如表所示:
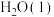 的汽化热为
的汽化热为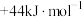 ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为______ 。
(2)“二步净化”过程中,原料 、
、 需要经过铜氨液处理净化,除去其中的CO,其反应为:
需要经过铜氨液处理净化,除去其中的CO,其反应为:
 ,铜氨液吸收CO适宜的生产条件是
,铜氨液吸收CO适宜的生产条件是______ (填字母)。
a.低温高压 b.高温高压 c.高温低压 d.低温低压
(3)第三步为氨合成,生产流程示意图如下。已知:
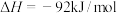
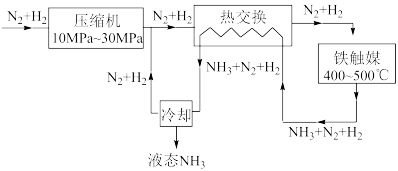
①上述流程中有利于提高原料利用率的措施有______ (请写出两点);
②有利于提高单位时间内氨的产率的措施有______ (请写出两点)。
(4)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,向1L密闭容器中充入1mol 和3mol
和3mol ,不同温度(
,不同温度( )、不同压强下,达平衡时混合物中
)、不同压强下,达平衡时混合物中 的物质的量分数的变化情况。
的物质的量分数的变化情况。
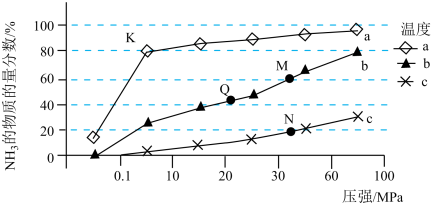
①曲线a对应的温度是______ ;
②M、N、Q点平衡常数的大小关系是______ ;K点的平衡常数为______ ;
③K点达平衡后再向容器中充入1mol 和2mol
和2mol ,平衡将
,平衡将______ (填“正向移动”、“逆向移动”或“不移动”)。
(1)“一次转化”过程中
 气体与水蒸气反应转化为CO和
气体与水蒸气反应转化为CO和 混合气体,已知几种物质的燃烧热如表所示:
混合气体,已知几种物质的燃烧热如表所示:物质 |
|
|
|
|
燃烧热 | -285.5 | -890.3 | -283 | -393.5 |
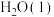 的汽化热为
的汽化热为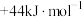 ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为(2)“二步净化”过程中,原料
 、
、 需要经过铜氨液处理净化,除去其中的CO,其反应为:
需要经过铜氨液处理净化,除去其中的CO,其反应为:
 ,铜氨液吸收CO适宜的生产条件是
,铜氨液吸收CO适宜的生产条件是a.低温高压 b.高温高压 c.高温低压 d.低温低压
(3)第三步为氨合成,生产流程示意图如下。已知:

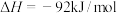

①上述流程中有利于提高原料利用率的措施有
②有利于提高单位时间内氨的产率的措施有
(4)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,向1L密闭容器中充入1mol
 和3mol
和3mol ,不同温度(
,不同温度(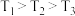 )、不同压强下,达平衡时混合物中
)、不同压强下,达平衡时混合物中 的物质的量分数的变化情况。
的物质的量分数的变化情况。
①曲线a对应的温度是
②M、N、Q点平衡常数的大小关系是
③K点达平衡后再向容器中充入1mol
 和2mol
和2mol ,平衡将
,平衡将
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐1】2021年11月2日,第四届世界顶尖科学家碳大会——通往“双碳目标”的科技之路论坛在上海召开。我国科学家刘科提到了绿色甲醇技术,将 转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
Ⅰ.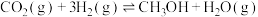

Ⅱ.

Ⅲ.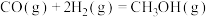

回答下列问题:
(1)已知上述反应Ⅰ、Ⅱ、Ⅲ的平衡常数K与温度T的关系为: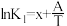 ,
,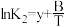 ,
,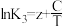 (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能
(x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能 (正)
(正) _______ 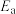 (逆),
(逆),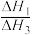 的数值范围是
的数值范围是_______ 。
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,可用 与
与 合成
合成 [
[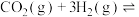
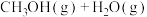 ],反应的催化剂,在发展非金属催化剂实现
],反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示:
电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示: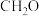 ,其中相对较少的副产物为
,其中相对较少的副产物为_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.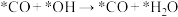 B.
B.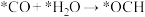
C. D.
D.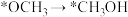
(3)向三个体积均为2 L的恒容密闭容器中分别充入1 mol 和3 mol
和3 mol  ,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中
,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中 的转化率随温度变化的数据如下表所示。(
的转化率随温度变化的数据如下表所示。( 时,
时, 的转化率为66.67%。即转化了
的转化率为66.67%。即转化了 )
)
①在温度为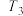 时,催化效果最好的催化剂是
时,催化效果最好的催化剂是_______ (填“催化剂a”、“催化剂b”或“催化剂c”)。
②温度为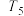 时,该反应的浓度平衡常数
时,该反应的浓度平衡常数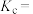
_______ 。
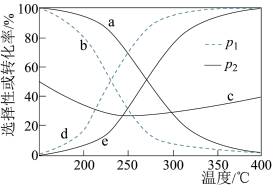
(4)当压强分别为 、
、 时,将
时,将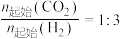 的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中
的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中 的平衡转化率和
的平衡转化率和 、
、 的选择性如下图所示。{
的选择性如下图所示。{ [或
[或 ]的选择性
]的选择性 }
}_______ (填“ ”或“CO”)的选择性,原因是
”或“CO”)的选择性,原因是_______ 。
②
_______ (填“>”或“<”) 。
。
 转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。Ⅰ.
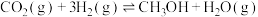

Ⅱ.


Ⅲ.
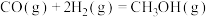

回答下列问题:
(1)已知上述反应Ⅰ、Ⅱ、Ⅲ的平衡常数K与温度T的关系为:
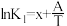 ,
,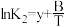 ,
,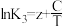 (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能
(x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能 (正)
(正) 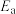 (逆),
(逆),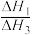 的数值范围是
的数值范围是(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,可用
 与
与 合成
合成 [
[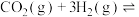
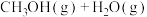 ],反应的催化剂,在发展非金属催化剂实现
],反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示:
电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示: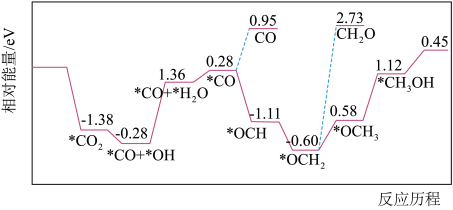
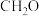 ,其中相对较少的副产物为
,其中相对较少的副产物为②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.
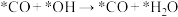 B.
B.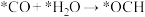
C.
 D.
D.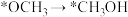
(3)向三个体积均为2 L的恒容密闭容器中分别充入1 mol
 和3 mol
和3 mol  ,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中
,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中 的转化率随温度变化的数据如下表所示。(
的转化率随温度变化的数据如下表所示。( 时,
时, 的转化率为66.67%。即转化了
的转化率为66.67%。即转化了 )
)温度 转化率 使用的催化剂 |  | 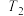 | 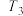 | 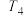 | 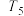 |
| 催化剂a | 65% | 77% | 80% | 80% | 66.67% |
| 催化剂b | 56% | 67% | 76% | 80% | 66.67% |
| 催化剂c | 48% | 62% | 72% | 80% | 66.67% |
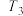 时,催化效果最好的催化剂是
时,催化效果最好的催化剂是②温度为
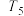 时,该反应的浓度平衡常数
时,该反应的浓度平衡常数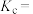
(4)当压强分别为
 、
、 时,将
时,将 的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中
的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中 的平衡转化率和
的平衡转化率和 、
、 的选择性如下图所示。{
的选择性如下图所示。{ [或
[或 ]的选择性
]的选择性 }
}
 ”或“CO”)的选择性,原因是
”或“CO”)的选择性,原因是②

 。
。
您最近一年使用:0次
【推荐2】CO2的过量排放会造成温室效应,CO2的固定可以有效缓解这一问题。已知键能数据如下表(单位: kJ/mol):
(1)在催化剂Ni-CeO2的作用下,CO2(g)和H2(g)反应生成CH4(g) 和H2O(g),其反应历程如图所示(吸附在催化剂表面的物种用*标注)。保持CO2与H2的体积比为1:4,反应气的总流量控制在40mL/min,通过320°C催化剂表面,反应未达到平衡状态。
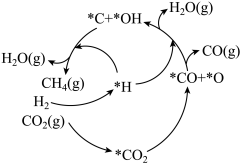
①主反应生成甲烷,热化学方程式为___________ 。
②欲提高CH4产率,可采取的措施是___________ (写一种即可)。
③根据反应历程写出存在的副反应的化学方程式:___________ 。
(2)一定条件下,向密闭容器中充入物质的量之比为1:3的CO2和H2发生反应:
a. CO2(g) +3H2(g) CH3OH( g) +H2O(g)
CH3OH( g) +H2O(g)
b. CO2(g) +H2(g) CO(g) +H2O(g)
CO(g) +H2O(g)
在不同催化剂(Cat 1, Cat2)下经相同反应时间,CO2的转化率和甲醇的选择性[甲醇的选择性= 100%] 随温度的变化如图所示:
100%] 随温度的变化如图所示:
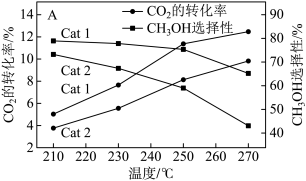
①210~ 270°C间,在甲醇的选择性上,催化效果较好的是___________ (填“Cat 1”或“Cat2” )。
②210~270°C 间,Cat 2条件下CO2的转化率随温度的升高而增大,可能原因为____________ 。
③在恒压条件下(总压强为p kPa),达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,反应b的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在Au纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为___________ (填“a”“b”或“c”),电催化还原CO2的电极反应式为___________ 。

| 共价键 | C=O | C-H | H-H | H-O |
| 键能 | 799 | 413 | 436 | 463 |

①主反应生成甲烷,热化学方程式为
②欲提高CH4产率,可采取的措施是
③根据反应历程写出存在的副反应的化学方程式:
(2)一定条件下,向密闭容器中充入物质的量之比为1:3的CO2和H2发生反应:
a. CO2(g) +3H2(g)
 CH3OH( g) +H2O(g)
CH3OH( g) +H2O(g)b. CO2(g) +H2(g)
 CO(g) +H2O(g)
CO(g) +H2O(g)在不同催化剂(Cat 1, Cat2)下经相同反应时间,CO2的转化率和甲醇的选择性[甲醇的选择性=
 100%] 随温度的变化如图所示:
100%] 随温度的变化如图所示:
①210~ 270°C间,在甲醇的选择性上,催化效果较好的是
②210~270°C 间,Cat 2条件下CO2的转化率随温度的升高而增大,可能原因为
③在恒压条件下(总压强为p kPa),达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,反应b的平衡常数Kp=
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在Au纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为

您最近一年使用:0次
【推荐3】氮、碳都是重要的非金属元素,合理应用和处理碳和氮的化合物,在生产生活中有重要意义。
I.研究含氮污染物的治理是环保的一项重要工作。
T℃时,发生如下反应,3NO(g)+O3(g) 3NO2(g),将0.6mol NO和0.2mol O3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
3NO2(g),将0.6mol NO和0.2mol O3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
①T℃时,反应3NO(g)+O3(g) 3NO2(g)的平衡常数K=
3NO2(g)的平衡常数K=_____ 。
②不能说明反应达到平衡状态的是______________ 。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3
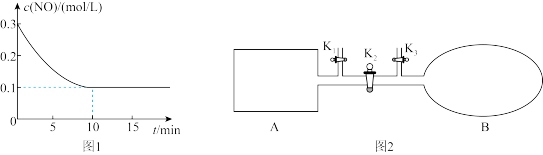
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1mol NO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为a L(忽略导管中的气体体积)。
①若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=_______ 。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为__________ L。
③若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数____ (填“变大”“变小”或“不变”)。
Ⅲ.氮有不同价态的氧化物,如NO、N2O3、NO2等,它们在一定条件下可以相互转化。
(1)某温度下,在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3 NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图所示,有关说法正确的是
NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图所示,有关说法正确的是__________ 。
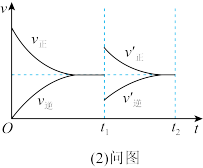
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图象与上图相同
(2)在1000K下,在某恒容容器中发生下列反应:2NO2(g) 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
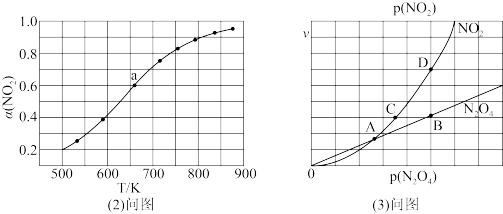
(3)对于反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________ ;在上图标出点中,指出能表示反应达到平衡状态的两个点__________ ,理由是__________________________ 。
I.研究含氮污染物的治理是环保的一项重要工作。
T℃时,发生如下反应,3NO(g)+O3(g)
 3NO2(g),将0.6mol NO和0.2mol O3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
3NO2(g),将0.6mol NO和0.2mol O3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。①T℃时,反应3NO(g)+O3(g)
 3NO2(g)的平衡常数K=
3NO2(g)的平衡常数K=②不能说明反应达到平衡状态的是
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3

II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1mol NO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为a L(忽略导管中的气体体积)。
①若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为
③若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数
Ⅲ.氮有不同价态的氧化物,如NO、N2O3、NO2等,它们在一定条件下可以相互转化。
(1)某温度下,在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3
 NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图所示,有关说法正确的是
NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图所示,有关说法正确的是
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图象与上图相同
(2)在1000K下,在某恒容容器中发生下列反应:2NO2(g)
 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=
(3)对于反应N2O4(g)
 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=
您最近一年使用:0次