12-13高三·四川攀枝花·阶段练习
1 . 三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。
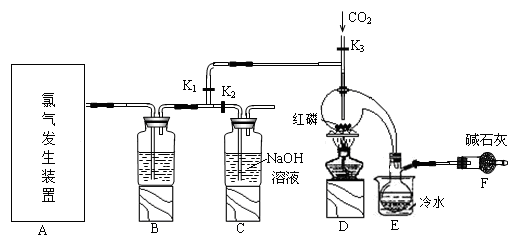
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见表。
请答下面问题:
(1)B中所装试剂是_______ ,F中碱石灰的作用是_______ 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是_______ ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过_______ (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是_______ 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
(6)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______ ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成如图所示,该示意图中明显的错误是_______ 。

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 溶液X中含有Na+ | |
| ② | 溶液X中含有Cl- |

您最近一年使用:0次
2 . 氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:

回答下列问题:
(1)根据实验目的,接口连接的顺序为1—_______ —_______ —2—3 —6—7_____ —_____ —_____ 。
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为_________ 。
(3)A装置中发生反应的离子方程式为________________________ 。
(4)B装置中发生反应的化学方程式为___________________ ,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为_____________ 。
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象:_______________________ 。

| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
回答下列问题:
(1)根据实验目的,接口连接的顺序为1—
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为
(3)A装置中发生反应的离子方程式为
(4)B装置中发生反应的化学方程式为
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象:
您最近一年使用:0次
名校
解题方法
3 . 氧钒(Ⅳ)碱式碳酸铵晶体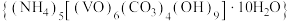 是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
 溶液
溶液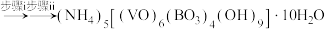
步骤i:用 排除装置中的氧气,将
排除装置中的氧气,将 溶液缓慢加入足量
溶液缓慢加入足量 溶液中,有气泡产生,析出紫红色晶体。
溶液中,有气泡产生,析出紫红色晶体。
步骤ii:待反应结束后,在 保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和
保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
(1)仪器E的名称为________ ;上述装置连接的顺序为________ 。
(2)装置B中发生反应的化学方程式是________ 。
(3)①预测 保护气排除氧气的目的是
保护气排除氧气的目的是________ ;判断装置中的 基本上排尽的方法是
基本上排尽的方法是________ (填实验现象)。
②晶体用无水乙醇代替水洗涤的目的是________ 。
(4)称bg粗品,用 溶液氧化,再除去多余的
溶液氧化,再除去多余的 (方法略),滴入2滴
(方法略),滴入2滴 溶液,最后用
溶液,最后用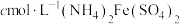 标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为
标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为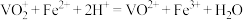 )。
)。
I.配制 标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为
标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为________ (填序号)。 溶液的体积为
溶液的体积为________ ;产品中钒的质量分数为________ %(用含b、c、M的代数式表示)。
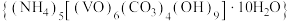 是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。 溶液
溶液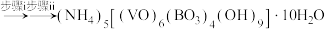
步骤i:用
 排除装置中的氧气,将
排除装置中的氧气,将 溶液缓慢加入足量
溶液缓慢加入足量 溶液中,有气泡产生,析出紫红色晶体。
溶液中,有气泡产生,析出紫红色晶体。步骤ii:待反应结束后,在
 保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和
保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。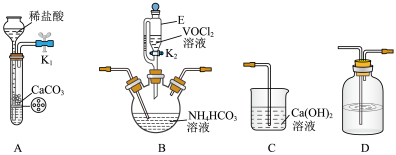
(1)仪器E的名称为
(2)装置B中发生反应的化学方程式是
(3)①预测
 保护气排除氧气的目的是
保护气排除氧气的目的是 基本上排尽的方法是
基本上排尽的方法是②晶体用无水乙醇代替水洗涤的目的是
(4)称bg粗品,用
 溶液氧化,再除去多余的
溶液氧化,再除去多余的 (方法略),滴入2滴
(方法略),滴入2滴 溶液,最后用
溶液,最后用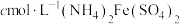 标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为
标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为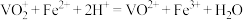 )。
)。I.配制
 标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为
标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为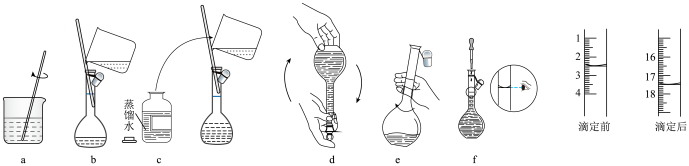
 溶液的体积为
溶液的体积为
您最近一年使用:0次
2024-06-04更新
|
176次组卷
|
2卷引用:2024届四川省成都石室中学高三下学期5月高考适应性考试(一)理科综合试卷-高中化学
4 . 下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
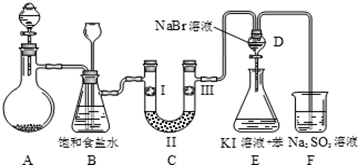
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为__________________ ;
(2)装置B中饱和食盐水的作用是__________ ,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________ ;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是______ (填编号);
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_________ ,事实上该现象并不能说明溴的非金属性强于碘,原因是__________________ (用离子反应方程式解释);
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因________________ ;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方式____________________ 。

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是
| 编号 | A | B | C | D |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因
(6)装置F的目的是吸收余氯,试写出相应的离子反应方式
您最近一年使用:0次
5 . 某化学兴趣小组拟用下图装置测定某粗锌样品中锌的质量分数。他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应。请填写以下实验报告。
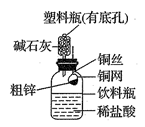
(1)实验目的:_________________________ 。
(2)实验步骤:
①称取10.0g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为_______________________ 。
③反应完全后,称得装置总质量为119.8g,则粗锌中锌的质量分数为________________ 。
(3)问题探究:(已知碱石灰是NaOH和CaO的混合物,常用于干燥、吸收气体)
①该实验若不用碱石灰,则所测得的粗锌中锌的质量分数将________ (填“偏大”、“偏小”或“无影响”);
②若将粗锌换成某含有杂质的石灰石样品(杂质也不与稀盐酸反应),判断该实验方案能不能用于石灰石样品中CaCO3质量分数的测定,并说明理由____________________ 。

(1)实验目的:
(2)实验步骤:
①称取10.0g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为
③反应完全后,称得装置总质量为119.8g,则粗锌中锌的质量分数为
(3)问题探究:(已知碱石灰是NaOH和CaO的混合物,常用于干燥、吸收气体)
①该实验若不用碱石灰,则所测得的粗锌中锌的质量分数将
②若将粗锌换成某含有杂质的石灰石样品(杂质也不与稀盐酸反应),判断该实验方案能不能用于石灰石样品中CaCO3质量分数的测定,并说明理由
您最近一年使用:0次
6 . 某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反 应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原。例如:PdCl2 + CO + H2O === Pd↓+ CO2 +2HCl ,反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
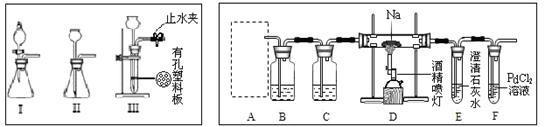
请回答下列问题:
(1)为了制取CO2气体的装置能“随开随用,随关随停”,上图A处应选用的装置是________ (填写 “I”、 “II”或“III”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是__________ 溶液,装置C中应盛放的试剂是___________ 。
(2)观察实验装置图可知Na与CO2反应的条件是_____________ ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是________________ 。待装置_______ (填写字母)中出现_________ 现象时,再点燃酒精喷灯,这步操作的目的是______________ 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
① 若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是____________________________ 。
② 若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是________________ 。
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由________________ 。
已知:常温下,CO能使一些化合物中的金属离子还原。例如:PdCl2 + CO + H2O === Pd↓+ CO2 +2HCl ,反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。

请回答下列问题:
(1)为了制取CO2气体的装置能“随开随用,随关随停”,上图A处应选用的装置是
(2)观察实验装置图可知Na与CO2反应的条件是
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
① 若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
② 若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由
您最近一年使用:0次
名校
解题方法
7 . 二氧化钒(VO2)是一种新型热敏材料,实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O},过程如图:

已知:+4价钒在弱酸性条件下具有还原性,VO2+能被O2氧化。回答下列问题:
(1)步骤ⅰ中生成VOCl2同时生成N2的化学方程式为_____ 。
(2)常温下,只用浓盐酸与V2O5反应也能制备VOCl2溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是_____ (用化学方程式说明)。
(3)步骤ii可用如图仪器组装完成。
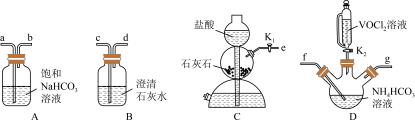
①装置D中盛放NH4HCO3溶液的仪器名称是_____ ;
②反应前通数分钟CO2的目的是_____ 。上述装置从左到右的连接顺序为_____ (用各接口字母表示)。
③反应结束后,将三颈烧瓶置于CO2保护下的干燥器中,静置后可得到紫红色晶体,然后抽滤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。检验晶体已经洗涤干净的操作是_____ 。
(4)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。
称量wg样品于锥形瓶中,用30mL稀硫酸溶解后,加入稍过量的0.01mol/LKMnO4溶液,充分反应后,再加入稍过量的2%NaNO2溶液,再加入适量尿素除去过量的NaNO2,最后用1mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,重复实验两次。消耗滴定液的体积如表:
已知:滴定反应为VO +Fe2++2H+=VO2++Fe3++H2O
+Fe2++2H+=VO2++Fe3++H2O
①滴定时,向锥形瓶中加入几滴_____ (填化学式)溶液作指示剂。
②粗产品中钒的质量分数为_____ %。
③下列情况会导致所测钒元素的质量分数可能偏小的是_____ (填序号)。
A.称量样品时,样品与砝码的位置放颠倒了
B.(NH4)2Fe(SO4)2标准溶液中部分Fe2+被氧化
C.滴定过程中,往锥形瓶内加入少量蒸馏水
D.滴定达终点时发现滴定管尖嘴内有气泡

已知:+4价钒在弱酸性条件下具有还原性,VO2+能被O2氧化。回答下列问题:
(1)步骤ⅰ中生成VOCl2同时生成N2的化学方程式为
(2)常温下,只用浓盐酸与V2O5反应也能制备VOCl2溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是
(3)步骤ii可用如图仪器组装完成。

①装置D中盛放NH4HCO3溶液的仪器名称是
②反应前通数分钟CO2的目的是
③反应结束后,将三颈烧瓶置于CO2保护下的干燥器中,静置后可得到紫红色晶体,然后抽滤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。检验晶体已经洗涤干净的操作是
(4)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。
称量wg样品于锥形瓶中,用30mL稀硫酸溶解后,加入稍过量的0.01mol/LKMnO4溶液,充分反应后,再加入稍过量的2%NaNO2溶液,再加入适量尿素除去过量的NaNO2,最后用1mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,重复实验两次。消耗滴定液的体积如表:
| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.99 |
| 2 | 1.10 | 21.10 |
| 3 | 1.56 | 21.57 |
 +Fe2++2H+=VO2++Fe3++H2O
+Fe2++2H+=VO2++Fe3++H2O①滴定时,向锥形瓶中加入几滴
②粗产品中钒的质量分数为
③下列情况会导致所测钒元素的质量分数可能偏小的是
A.称量样品时,样品与砝码的位置放颠倒了
B.(NH4)2Fe(SO4)2标准溶液中部分Fe2+被氧化
C.滴定过程中,往锥形瓶内加入少量蒸馏水
D.滴定达终点时发现滴定管尖嘴内有气泡
您最近一年使用:0次
8 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.验证同周期主族元素金属性和非金属性的变化规律
(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_______ 与盐酸反应最剧烈,_______ 与盐酸反应产生的气体最多。Al与HCl反应的离子方程式为_______
(2)向Na2S溶液中通入氯气出现_______ 现象,可证明Cl的非金属性比 S强,反应的离子方程式为_______ 。
Ⅱ.利用如图装置验证同主族元素非金属性的变化规律
(3)仪器B的名称为_______ ,干燥管D的作用为防止_______ 。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的_______ 现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______ 溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液的_______ 现象即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______ 溶液的洗气瓶除去。
Ⅰ.验证同周期主族元素金属性和非金属性的变化规律
(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向Na2S溶液中通入氯气出现
Ⅱ.利用如图装置验证同主族元素非金属性的变化规律

(3)仪器B的名称为
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液的
您最近一年使用:0次
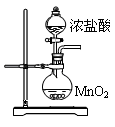
9 . 实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
Ⅰ. 制备
制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是_______ 。
(2)控制温度在40~50℃的原因是_______ 。
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为_______ 。
Ⅱ.无水 制备
制备
已知 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。
(4)按图装置进行实验。锥形瓶中生成无水 的总化学方程式为
的总化学方程式为_______ ;仪器A的作用是_______ 。
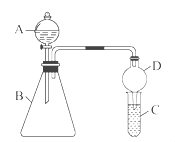
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用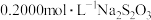 溶液滴定(
溶液滴定(
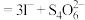 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。
①所制产品的纯度为_______ (以无水 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);
②所制产品中可能含有 杂质,检验
杂质,检验 的试剂为
的试剂为_______ (填化学式)溶液;产生 的原因可能是
的原因可能是_______ 。
Ⅰ.
 制备
制备①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是
(2)控制温度在40~50℃的原因是
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为
Ⅱ.无水
 制备
制备已知
 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。(4)按图装置进行实验。锥形瓶中生成无水
 的总化学方程式为
的总化学方程式为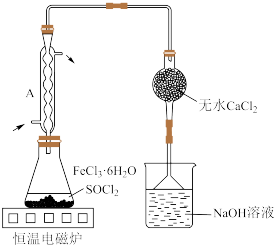
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用
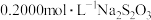 溶液滴定(
溶液滴定(
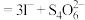 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。①所制产品的纯度为
 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);②所制产品中可能含有
 杂质,检验
杂质,检验 的试剂为
的试剂为 的原因可能是
的原因可能是
您最近一年使用:0次
10 . 影响化学反应速率的因素很多,同学们用以下实验的进行探究。
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同)。
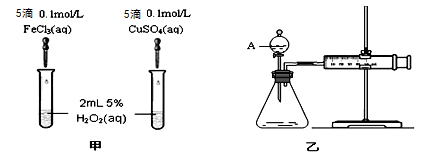
①定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好 (填“能”或“否”),其理由是____________________(若能说明催化效果,此空不填) 。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性 。实验中需要测量的数据是: 。
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
① 写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式: 。
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。(填序号)
(3)实验三 已知 KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
① 该反应的离子方程式为_____________________。
② 完成此实验,试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是______________,
实验现象为 。
③ 由上述实验记录数据可得出的结论是_________________。
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同)。

①定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好 (填“能”或“否”),其理由是____________________(若能说明催化效果,此空不填) 。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性 。实验中需要测量的数据是: 。
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
① 写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式: 。
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。(填序号)
| A.硫酸钾 | B.硫酸锰 | C.水 | D.氯化锰 |
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
② 完成此实验,试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是______________,
实验现象为 。
③ 由上述实验记录数据可得出的结论是_________________。
您最近一年使用:0次



