1 . 某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
请帮助该同学整理并完成实验报告。
(1)实验目的:______________________ 。
(2)实验用品:______________________ 。
(3)实验内容:
(4)实验结论:_____________________ 。
(5)请用物质结构理论简单说明具有上述结论的原因___________________
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2 mol·L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2 mol·L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 | F.生成淡黄色沉淀 |
(1)实验目的:
(2)实验用品:
(3)实验内容:
| 实验方案 (填序号) | 实验现象 (填序号) | 有关化学方程式 |
(5)请用物质结构理论简单说明具有上述结论的原因
您最近一年使用:0次
2 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
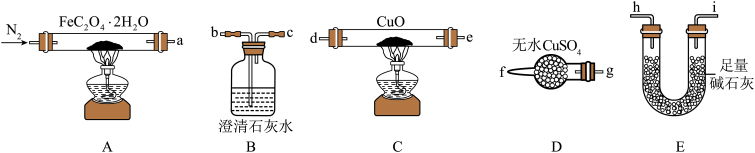
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__ 。
③实验证明了气体产物中含有CO,依据的实验现象为__ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__ ;步骤3中加入锌粉的目的为___ 。
(5)若步骤 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将__ (填“偏高”、“偏低”或“不变”)
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:

①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)若步骤
 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
2020-06-12更新
|
1223次组卷
|
3卷引用:吉林省延边州2020届高三4月教学质量检测理科综合化学试题
3 . I实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为:______ 。所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:
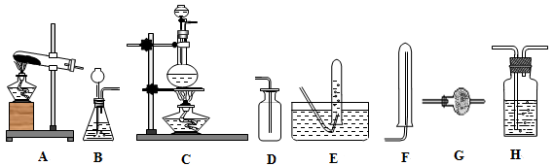
(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
II如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(预先在水里滴入少量酚酞溶液)。打开橡皮管上的夹子,轻轻挤压滴管,使少量水进入烧瓶,可观察到的现象为:_______________ 。
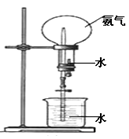
(1)装置:

(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
| 制取 气体 | 杂质气体 | 制取气体的 发生装置 | 除去杂质气体的净化装置 | 收集 装置 | 净化装置内 所用试剂 | 检验制得气 体所用试剂 |
| NH3 | H2O(g) |

您最近一年使用:0次
11-12高一上·新疆乌鲁木齐·期末
名校
4 . 为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
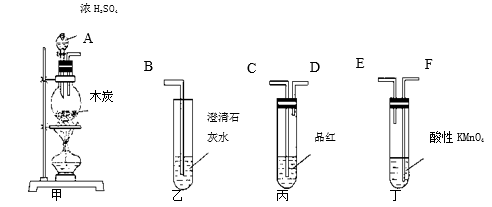
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):_____ 接________ ,_____ 接_____ ,____ 接____ ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中_______ ,丙中_______ ;
(3)丁中酸性KMnO4溶液的作用是_________ ;
(4)写出甲中反应的化学方程式________ 。

(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中
(3)丁中酸性KMnO4溶液的作用是
(4)写出甲中反应的化学方程式
您最近一年使用:0次
2016-12-09更新
|
1433次组卷
|
20卷引用:吉林省辉南县第一中学2018-2019学年高一下学期第一次月考化学试题
吉林省辉南县第一中学2018-2019学年高一下学期第一次月考化学试题吉林省乾安县第七中学2020-2021学年高一下学期第五次质量检测化学试题吉林省舒兰市第十八中学校2021-2022学年高一下学期期末考试化学试题(已下线)2010—2011学年新疆乌鲁木齐市第八中学高一上学期期末考试化学试卷(已下线)2010—2011学年黑龙江七校高一期末联考化学试卷(已下线)2011-2012学年福建省五校高一上学期期末联考化学试卷(已下线)2013-2014广东省梅州市重点中学高一下学期期中化学试卷(已下线)2013-2014甘肃省肃南县第一中学高一下学期期末考试化学试卷(已下线)2013-2014广东省越秀区高一下学期学业水平测试调研化学试卷2014-2015海南省海南中学高一上学期期末化学试卷2014-2015学年内蒙古霍林郭勒市第三中学高一下期中考试化学试卷2018年高一化学(人教版)必修1综合题型练习卷:非金属及其化合物(已下线)2018年12月11日 《每日一题》人教必修1-浓硫酸的特性新疆石河子第二中学2018-2019学年高一上学期期末考试化学试题广东第二师范学院番禺附属中学2019-2020学年高二上学期中考试化学(学考)试题(已下线)2019年12月10日 《每日一题》化学人教版(必修1)——浓硫酸的特性辽宁省锦州市黑山县黑山中学2019-2020学年高一6月质量检测化学试题辽宁省营口市第二高级中学2019-2020学年高一下学期期末考试化学(理)试题(已下线)5.1.2 硫酸、含硫化合物的相互转化——同步学习必备知识海南省琼海市嘉积中学2023-2024学年高一年级下学期第一次月考化学试题B卷
5 . 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。他以 NaCl、NH3、CO2等为原料先制得 NaHCO3,进行生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是__________________ (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出):
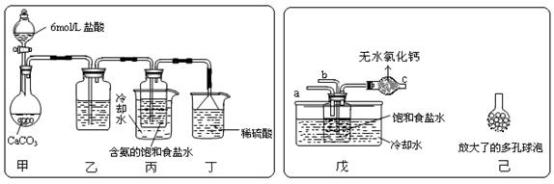
试回答下列 有关问题:
(Ⅰ)乙装置中的试剂是__________________ ;
(Ⅱ)丁装置中稀硫酸的作用是__________________ ;
②另一位同学用图中戊装置(其他装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入__________ 气体,再从b管中通入__________ 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接已装置,理由是__________________ 。
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出):

试回答下列 有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
②另一位同学用图中戊装置(其他装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入
(Ⅱ)有同学建议在戊装置的b管下端连接已装置,理由是
您最近一年使用:0次
名校
6 . 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸(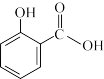 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
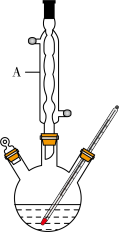
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
请根据以上信息回答下列问题:
(1)仪器A的名称是_______ ,加入沸石的作用是_______ 。若加热后发现未加沸石,应采取的正确方法是_______ 。
(2)制备水杨酸甲酯时,最合适的加热方法是_______ 。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是_______ 。
(4)反应结束后,分离出甲醇采用的方法是_______ 。
(5)实验中加入无水硫酸镁的作用是_______ 。本实验的产率为_______ (保留两位有效数字)。
 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:

Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是
(2)制备水杨酸甲酯时,最合适的加热方法是
(3)实验中加入甲苯对合成水杨酸甲酯的作用是
(4)反应结束后,分离出甲醇采用的方法是
(5)实验中加入无水硫酸镁的作用是
您最近一年使用:0次
2016-12-09更新
|
1641次组卷
|
8卷引用:吉林省长春市北京师范大学长春附属学校2020-2021学年高二下学期第一次月考化学试题
7 . Ⅰ、亚硝酸钠在漂白、电镀等方面应用广泛。现在木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。

已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称__________________ ;
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________ ;
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式_________________ ;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________________ ;
(4)D装置中发生反应的离子方程式为__________________ 。
Ⅱ、焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
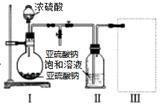
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为___________________ ;
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_______________ ;
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为____________ (填序号);

实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
在上述实验过程中,若有部分HI被空气氧化,则测定结果__________ (填“偏高”“偏低”或“不变”)。

已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式
(4)D装置中发生反应的离子方程式为
Ⅱ、焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:

实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为

实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
在上述实验过程中,若有部分HI被空气氧化,则测定结果
您最近一年使用:0次



