名校
解题方法
1 . 纳米氧化锌可作为一些催化剂的载体,二氧化锰也常作催化剂、氧化剂与去极化剂,用途非常广泛。工业上由软锰矿(主要成分为MnO2)与锌精矿(主要成分为ZnS)酸性共溶法制备MnO2,及纳米ZnO,工艺流程如图:

已知:P5O7(酸性磷酸酯)可作萃取剂分离锌、锰离子,它是一种不溶于水的淡黄色透明油状液体,属于酸性萃取剂。
请回答下列问题:
(1)为了提高酸浸效果,可采取的措施有____ 。(答出一条即可)
(2)写出步骤①酸浸时ZnS与MnO2发生的主要反应的离子方程式:____ 。(无单质硫生成),若软锰矿的比例较低,可能产生的后果是____ 。
(3)实验室完成步骤③所用到的主要玻璃仪器是____ (填写名称)。
(4)完成步骤④中发生反应的离子方程式:____ 。
(5)经⑤所得水相再经过____ 过滤等操作得到ZnSO4•7H2O。
已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:
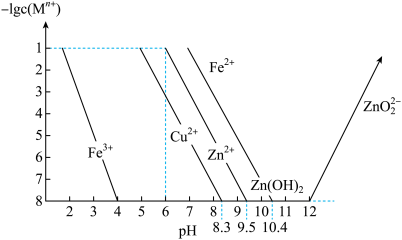
②相关常数:Ksp(ZnS)=2.1×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15,Ka(CH3COOH)=1.8×10-5。
制得ZnSO4•7H2O后最终残留的酸性废液中含有ZnSO4,除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
测:处理后的溶液中c(Zn2+)=____ mol•L-1。
(6)ZnSO4•7H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是____ 。

已知:P5O7(酸性磷酸酯)可作萃取剂分离锌、锰离子,它是一种不溶于水的淡黄色透明油状液体,属于酸性萃取剂。
请回答下列问题:
(1)为了提高酸浸效果,可采取的措施有
(2)写出步骤①酸浸时ZnS与MnO2发生的主要反应的离子方程式:
(3)实验室完成步骤③所用到的主要玻璃仪器是
(4)完成步骤④中发生反应的离子方程式:
(5)经⑤所得水相再经过
已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:

②相关常数:Ksp(ZnS)=2.1×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15,Ka(CH3COOH)=1.8×10-5。
制得ZnSO4•7H2O后最终残留的酸性废液中含有ZnSO4,除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度(mol•L-1) | 0.10 | 0.10 | 0.18 |
(6)ZnSO4•7H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是
| A.滴定前,锥形瓶和滴定管均须用标准溶液润洗 |
| B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 |
| C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转 |
| D.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小 |
您最近一年使用:0次
2 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为_______ 。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中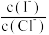 为:
为:_______ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:_______ 。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为_______ (以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=_______ min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
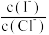 为:
为:(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

您最近一年使用:0次
2019-01-30更新
|
7102次组卷
|
9卷引用:2016届吉林省长春十一高三下考前冲刺二理综化学试卷
3 . SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一、
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g) 2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:

①平衡状态由A到B时,平衡常数K(A)______ K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为______ 。该反应的平衡常数为______ 。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为______ ;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是______ 。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)
 2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
①平衡状态由A到B时,平衡常数K(A)
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是
您最近一年使用:0次



