名校
解题方法
1 . 铜及其化合物在科学研究和工业生产中具有许多用途,请回答下列问题:
(1)写出基态Cu原子的价电子排布式_______ 。
(2)已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因_______ 。
(3)配合物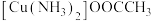 中碳原子的杂化类型是
中碳原子的杂化类型是_______ ,配体的空间构型为_______ 。配合物所含元素的电负性由大到小的顺序是_______ (用元素符号表示)。
(4)M原子的价电子排布式为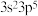 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
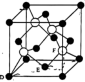
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为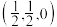 ,则F原子的坐标参数为
,则F原子的坐标参数为_______ 。
②已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)写出基态Cu原子的价电子排布式
(2)已知高温下
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(3)配合物
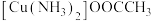 中碳原子的杂化类型是
中碳原子的杂化类型是(4)M原子的价电子排布式为
 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为
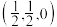 ,则F原子的坐标参数为
,则F原子的坐标参数为②已知该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
2022-10-12更新
|
459次组卷
|
4卷引用:辽宁省实验中学2023届高三上学期第一次阶段测试化学试题
2 . 元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为____
Ⅱ.还原沉淀法
含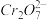 的废水
的废水 含
含 的废水
的废水
 沉淀
沉淀
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是______ (填选项序号)
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为___
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:______
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为_______ ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后________ (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路通过的电子的物质的量为______ mol
I.直接沉淀法
(1)已知含铬废水中存在着平衡:
 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为Ⅱ.还原沉淀法
含
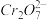 的废水
的废水 含
含 的废水
的废水
 沉淀
沉淀(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是
| A.FeSO4溶液 | B.浓H2SO4溶液 |
| C.酸性KMnO4溶液 | D.Na2SO3溶液 |
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路通过的电子的物质的量为
您最近一年使用:0次
3 . 对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚。实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚。实验步骤如下:
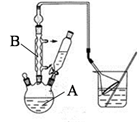
步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。
步骤2:向A中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,反应有气体放出。
步骤3:反应结束后,向A中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器A和B的名称分别为_______________ ;_________________ 。
(2)步骤2中发生主要反应的化学方程式为_________________ 。该反应为放热反应,且实验的产率通常较低,可能的原因是______________ 。
(3)图中倒扣漏斗的作用是_______________ 。苯酚有腐蚀性,能使蛋白质变性,若其溶液沾到皮肤上可用______________ 洗涤。
(4)步骤4中用石油醚重结晶提纯粗产物,试简述重结晶的操作步骤:___________
(5)实验结束后,对产品进行光谱鉴定,谱图结果如下图。该谱图是________ (填字母)。
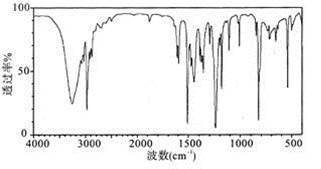
A.核磁共振氢谱图 B.红外光谱图 C.质谱图
(6)下列仪器在使用前必须检查是否漏液的是____________ (填选项字母)。
A.量筒
B.容量瓶
C.滴定管
D.分液漏斗
E.长颈漏斗
(7)本实验中,对叔丁基苯酚的产率为______________ (请保留三位有效数字)。
 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚。实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚。实验步骤如下:
步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。
步骤2:向A中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,反应有气体放出。
步骤3:反应结束后,向A中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器A和B的名称分别为
(2)步骤2中发生主要反应的化学方程式为
(3)图中倒扣漏斗的作用是
(4)步骤4中用石油醚重结晶提纯粗产物,试简述重结晶的操作步骤:
(5)实验结束后,对产品进行光谱鉴定,谱图结果如下图。该谱图是

A.核磁共振氢谱图 B.红外光谱图 C.质谱图
(6)下列仪器在使用前必须检查是否漏液的是
A.量筒
B.容量瓶
C.滴定管
D.分液漏斗
E.长颈漏斗
(7)本实验中,对叔丁基苯酚的产率为
您最近一年使用:0次
4 . 高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:

根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式__________________
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是______________________
(3)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是____________________________
(4)“分离”操作的名称是______________ (填字母代号).
A.蒸馏 B.分液 C.过滤
(5)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是_______________ ,离子浓度最小的离子是____________________ .

根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是
(3)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是
(4)“分离”操作的名称是
A.蒸馏 B.分液 C.过滤
(5)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是
您最近一年使用:0次
2016-12-09更新
|
122次组卷
|
3卷引用:2016届辽宁省实验中学分校高三上期中测试理综化学试卷
解题方法
5 . NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_________ (填“=”、“>”或“<”)NH4HSO4中c(NH4+)。
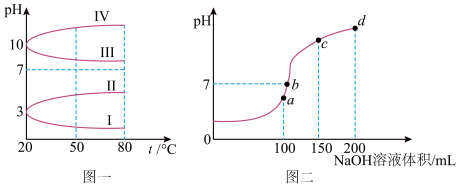
(2)如图1是0.1 mol•L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol•L﹣1NH4Al(SO4)2的pH随温度变化的曲线是_______ (填写字母);
②室温时,0.1 mol•L﹣1NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=________ mol•L﹣1(填数值)
(3)室温时,向100 mL 0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是_____ ;在c点,溶液中各离子浓度由大到小的排列顺序是_________________ 。

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)
(2)如图1是0.1 mol•L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol•L﹣1NH4Al(SO4)2的pH随温度变化的曲线是
②室温时,0.1 mol•L﹣1NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=
(3)室温时,向100 mL 0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2016-12-09更新
|
662次组卷
|
3卷引用:2016-2017学年辽宁省沈阳铁路中学高二上第一次月考化学试卷
6 . 化学史上很多重要物质的发现背后都有科学家们的兴趣、坚持、创新与传承。例如氨的发现史,阅读下文并填空。
1727年,英国牧师、化学家哈尔斯用氯化铵与熟石灰的混合物在以水封闭的曲颈瓶中加热,只见水被吸入瓶中而不见气体放出;
(1)哈尔斯制氨气发生的反应方程式为______________ ,水吸入曲颈瓶的原理与___________ 实验相同。氨的电子式为_____________ ;
1774年英国化学家普利斯特里重作这个实验,采用汞代替水来密闭曲颈瓶,即排汞取气法,制得了碱空气(氨)。
(2)氨可以在纯氧中燃烧,已知该反应为一个置换反应,反应方程式为__________ ,预期该反应在生产上_______ (填有或无)实际用途。
(3)在氨气中通以电火花时,气体体积在相同条件下增加很多,该反应的化学方程式是______ ,据此证实了氨是氮和氢的化合物。其后戴维等化学家继续研究,进一步证实了氨的组成。
1727年,英国牧师、化学家哈尔斯用氯化铵与熟石灰的混合物在以水封闭的曲颈瓶中加热,只见水被吸入瓶中而不见气体放出;
(1)哈尔斯制氨气发生的反应方程式为
1774年英国化学家普利斯特里重作这个实验,采用汞代替水来密闭曲颈瓶,即排汞取气法,制得了碱空气(氨)。
(2)氨可以在纯氧中燃烧,已知该反应为一个置换反应,反应方程式为
(3)在氨气中通以电火花时,气体体积在相同条件下增加很多,该反应的化学方程式是
您最近一年使用:0次
7 . 分NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如图一是0.1 mol•L-1NH4Al(SO4)2溶液的pH随温度变化的图象。
①其中符合0.1 mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是___________(填写字母);
②室温时,0.1 mol•L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=_________mol•L-1(填数值)
(3)室温时,向100 mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图二所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____________;在c点,溶液中各离子浓度由大到小的排列顺序是____________。

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如图一是0.1 mol•L-1NH4Al(SO4)2溶液的pH随温度变化的图象。
①其中符合0.1 mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是___________(填写字母);
②室温时,0.1 mol•L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=_________mol•L-1(填数值)
(3)室温时,向100 mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图二所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____________;在c点,溶液中各离子浓度由大到小的排列顺序是____________。
您最近一年使用:0次



