1 . 某化学兴趣小组为探究Cl2的性质并制备氯水,用如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的有色布条,b为湿润的有色布条。
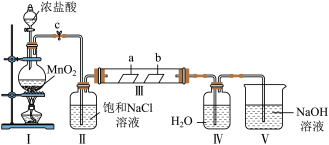
回答下列问题:
(1)加入药品前,必须先_______ 。
(2)装置Ⅰ中发生反应的化学方程式为_______ 。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在_______ 和_______ (填装置序号)之间添加洗气装置,该装置的作用是_______ 。
(4)装置Ⅴ中NaOH溶液的作用是_______ ,相关反应的化学方程式为_______ 。

回答下列问题:
(1)加入药品前,必须先
(2)装置Ⅰ中发生反应的化学方程式为
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在
(4)装置Ⅴ中NaOH溶液的作用是
您最近一年使用:0次
2 . I.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与完成相关实验问题讨论。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
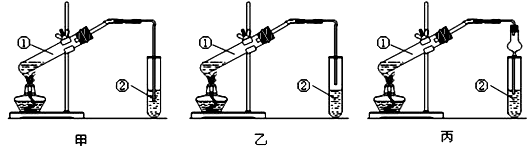
根据分析回答:(1)三位同学设计的装置中最不合理的是____ (选填“甲”或“乙”或“丙”),原因是_________________ 。
【实验步骤】
a.按所选择的装置组装仪器,在试管①中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加入适量的饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象时停止实验。
(2)试管①中加入浓硫酸的作用是______________________________
(3)该实验中长导管的作用是___________________ 。
(4)试管②中饱和Na2CO3溶液的作用是_______________ ;可否用NaOH溶液代替Na2CO3溶液?_____ (填“是”或“否”),理由是用化学方程式回答_______________ 。
(5)写出试管①中乙醇工业制取的化学方程式________________________________ ;
II.实验室制备硝基苯的主要步骤如下:
a、配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b、向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c、在55~60℃下发生反应,直至反应结束;
d、除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e、将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是________________ 。
②配制一定比例的浓H2SO4与浓HNO3的混合酸时,操作的注意事项是:_____ 。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是________________ 。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:

根据分析回答:(1)三位同学设计的装置中最不合理的是
【实验步骤】
a.按所选择的装置组装仪器,在试管①中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加入适量的饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象时停止实验。
(2)试管①中加入浓硫酸的作用是
(3)该实验中长导管的作用是
(4)试管②中饱和Na2CO3溶液的作用是
(5)写出试管①中乙醇工业制取的化学方程式
II.实验室制备硝基苯的主要步骤如下:
a、配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b、向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c、在55~60℃下发生反应,直至反应结束;
d、除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e、将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是
②配制一定比例的浓H2SO4与浓HNO3的混合酸时,操作的注意事项是:
③步骤d中洗涤、分离粗硝基苯应使用的仪器是
您最近一年使用:0次
3 . 氯化铁,黑棕色结晶,熔点306℃、沸点315℃,易升华;FeCl3易溶于水且具有强烈的吸水性。某化学兴趣小组利用如下装置(夹持仪器略去)制备氯化铁晶体 ( FeCl3.6H2O)。
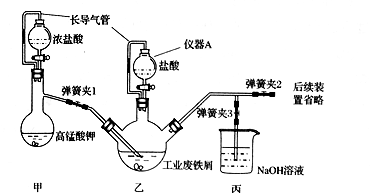
(1)仪器A的名称是____ ,在该实验中长导气管的作用是____ ,同时防止盐酸挥发污染环境。
(2)装置甲中发生反应的离子方程式为____ ,装置丙的作用为__________________ 。
(3)为顺利达成实验目的,实验过程中先关闭弹簧夹l和3,打开弹簧夹2,再打开乙装置中的活塞,待铁粉完全溶解后,关闭乙中的活塞,___ 再打开甲中的活塞。
(4)在实验过程中判断乙瓶中铁元素完全转化成氯化铁的方法是:取试样于试管中,然后向试管中力口入__ (填试剂)后观察现象。
(5)反应结束后,将乙中溶液边加入____ ,边进行加热浓缩、____ 、过滤、洗涤、干燥即得到产品。

(1)仪器A的名称是
(2)装置甲中发生反应的离子方程式为
(3)为顺利达成实验目的,实验过程中先关闭弹簧夹l和3,打开弹簧夹2,再打开乙装置中的活塞,待铁粉完全溶解后,关闭乙中的活塞,
(4)在实验过程中判断乙瓶中铁元素完全转化成氯化铁的方法是:取试样于试管中,然后向试管中力口入
(5)反应结束后,将乙中溶液边加入
您最近一年使用:0次
名校
4 . 某校化学兴趣小组为研究Cl2的性质,设计如下图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
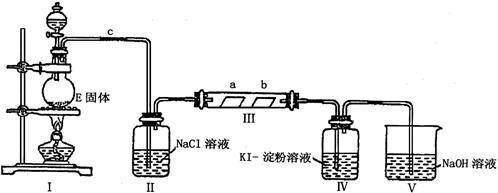
(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是_______ 。
(2)装置Ⅱ的作用是_______ 。
(3)实验过程中,装置IV中的实验现象为_______ ;发生反应的化学方程式为_______ 。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置_______ 与_______ 之间添加下图中的_______ 装置(填序号),该装置的作用是_______ 。
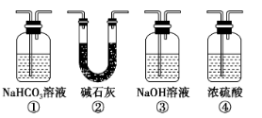
(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式_______ 。

(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是
(2)装置Ⅱ的作用是
(3)实验过程中,装置IV中的实验现象为
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式
您最近一年使用:0次
2016-12-09更新
|
383次组卷
|
5卷引用:2014-2015吉林省延边二中高一上学期期末考试化学试卷
5 . 在实验室进行下列实验,所进行的操作不能达到实验目的的是
| 选项 | 实验目的 | 操作 |
| A | 制备银氨溶液 | 在洁净的试管中加入1 mL 2%的稀氨水,然后边振荡试管边滴加3 mL 10%的硝酸银溶液 |
| B | 鉴别苯和氯仿 | 分别取少量液体于试管中,加入2 mL溴水,观察分层后的现象 |
| C | 鉴别无水硫酸铜和硫酸钡 | 分别取少许粉末于试管中,滴加少量蒸馏水,观察溶液颜色 |
| D | 除去氯化铁溶液中的氯化铜 | 加入过量铁粉,充分反应后过滤,向滤液中滴加适量氯水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 根据要求完成下列各小题实验目的。a、b为弹簧夹,(加热及固定装置已略去)
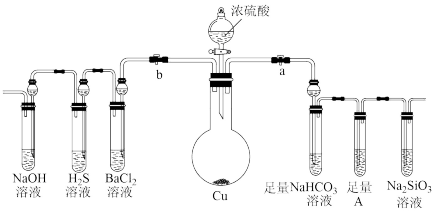
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、_______ 、加药品后,打开a关闭b,打开分液漏斗旋转活塞,然后滴入浓硫酸,发现硫酸滴入几滴,就不再滴下,原因是_______ ,当顺利滴入时加热。
②铜与浓硫酸反应的化学方程式是_______ 。装置A中试剂可以是_______ 。(用a,b,c填空)
a.品红溶液 b.氢氧化钠溶液 c.酸性高锰酸钾溶液
③能说明碳的非金属性比硅强的实验现象是_______ 。
(2)验证 的氧化性、还原性和酸性氧化物的通性。
的氧化性、还原性和酸性氧化物的通性。
①在(1)操作后打开b,关闭a。
②一段时间后, 溶液中的现象是
溶液中的现象是_______ ,化学方程式是_______ 。
(3) 溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、
②铜与浓硫酸反应的化学方程式是
a.品红溶液 b.氢氧化钠溶液 c.酸性高锰酸钾溶液
③能说明碳的非金属性比硅强的实验现象是
(2)验证
 的氧化性、还原性和酸性氧化物的通性。
的氧化性、还原性和酸性氧化物的通性。①在(1)操作后打开b,关闭a。
②一段时间后,
 溶液中的现象是
溶液中的现象是(3)
 溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2023-01-21更新
|
371次组卷
|
2卷引用:吉林省长春市第十一高中2022-2023高一上学期期末考试化学试题
7 . 根据下列实验操作和现象能推出相应结论或目的的是
| 选项 | 实验操作和现象 | 实验目的或结论 |
| A | 向 溶液中滴加 溶液中滴加 溶液,产生白色沉淀 溶液,产生白色沉淀 |  和 和 发生了相互促进的水解反应 发生了相互促进的水解反应 |
| B | 向 溶液中加入 溶液中加入  溶液,出现白色沉淀,再加入几滴 溶液,出现白色沉淀,再加入几滴 的 的 溶液,有黑色沉淀生成 溶液,有黑色沉淀生成 | 证明 的溶解度大于 的溶解度大于 的溶解度 的溶解度 |
| C | 向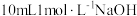 溶液中滴加饱和 溶液中滴加饱和 溶液,有红褐色物质产生 溶液,有红褐色物质产生 | 制备 胶体 胶体 |
| D | 向 溶液中通入 溶液中通入 气体,产生黑色沉淀 气体,产生黑色沉淀 | 氢硫酸为强酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-07更新
|
540次组卷
|
6卷引用:吉林省白山市2023届高三下学期五模联考理综化学试题
名校
解题方法
8 . 甲、乙、丙三位同学分别用如图实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气。
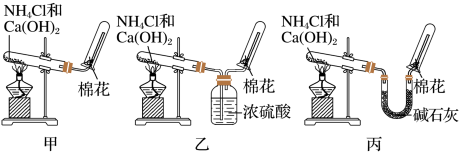
(1)他们制取氨气的化学方程式为_____ 。
(2)他们收集氨气的方法是_____ 。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是____ (填“甲”、“乙”或“丙”)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)____ 。
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为哪位同学能够达到实验目的____ (填“甲”、“乙”或“丙”)。他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为____ (填“能”或“不能”)。
(6)氨气被催化氧化的化学方程式是____ 。

(1)他们制取氨气的化学方程式为
(2)他们收集氨气的方法是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为哪位同学能够达到实验目的
(6)氨气被催化氧化的化学方程式是
您最近一年使用:0次
2022-09-25更新
|
83次组卷
|
3卷引用:吉林省梅河口市第五中学2023-2024学年高二上学期开学考试化学试题
9 . 甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮,一氧化氮生成并制取氮化镁(假设实验中每步转化均是完全的)。
查阅文献得知:①二氧化氮沸点为21.1℃、熔点为-11℃,一氧化氮沸点为-151℃、熔点为-164℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。
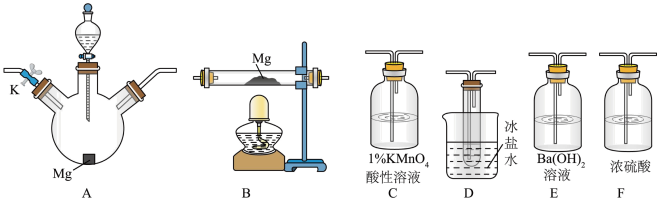
(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是___________ 。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→___________ →E,确定还原产物中有二氧化氮的现象是___________ ,实验中要多次使用装置F,第二次使用F的目的是___________ 。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:___________ 。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是___________ 。
(5)取少量氮化镁于试管中,加入足量稀硝酸,没有气体逸出。取少量反应后的溶液于试管中,加入足量NaOH浓溶液,加热,用镊子夹一块湿润的红色石蕊试纸接近试管口,试纸变蓝色。则氮化镁溶于足量稀硝酸中发生反应的化学方程式为___________ 。
查阅文献得知:①二氧化氮沸点为21.1℃、熔点为-11℃,一氧化氮沸点为-151℃、熔点为-164℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。

(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是
(5)取少量氮化镁于试管中,加入足量稀硝酸,没有气体逸出。取少量反应后的溶液于试管中,加入足量NaOH浓溶液,加热,用镊子夹一块湿润的红色石蕊试纸接近试管口,试纸变蓝色。则氮化镁溶于足量稀硝酸中发生反应的化学方程式为
您最近一年使用:0次
2023-04-16更新
|
386次组卷
|
2卷引用:吉林省长春外国语学校2022-2023学年高一下学期5月期中考试化学试题
10 . 硫酸是重要的化工原料,某兴趣小组对浓硫酸的性质进行如下探究。
(1)棉布上滴浓H2SO4后破洞。体现了浓H2SO4的_______ (填“脱水”“吸水”或“强氧化”、下同)性;在冷的浓H2SO4中放入铁片无明显现象,体现了浓H2SO4的_______ 性。
为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊。(已知淀粉溶液遇I2变蓝)
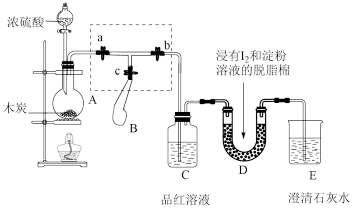
(2)装置A中发生反应的化学方程式为_______ 。
(3)实验时,装置C中的现象为_______ 。
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,正确的操作顺序是_______ (填序号)。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
(5)若要检验浓硫酸与木炭在加热条件下生成的水蒸气,可在装置_______ 之间加上一个盛有无水CuSO4的硬质玻璃管。
(6)当D中产生_______ 现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;写出D中发生反应的化学方程式_______ 。
(7)当D中反应转移电子0.3mol时,参加反应的气体体积(标准状况下)为_______ L。
(1)棉布上滴浓H2SO4后破洞。体现了浓H2SO4的
为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊。(已知淀粉溶液遇I2变蓝)

(2)装置A中发生反应的化学方程式为
(3)实验时,装置C中的现象为
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,正确的操作顺序是
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
(5)若要检验浓硫酸与木炭在加热条件下生成的水蒸气,可在装置
(6)当D中产生
(7)当D中反应转移电子0.3mol时,参加反应的气体体积(标准状况下)为
您最近一年使用:0次
2022-02-20更新
|
562次组卷
|
2卷引用:吉林省长春外国语学校2022-2023学年高一下学期6月月考化学试题



