1 . I.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与完成相关实验问题讨论。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
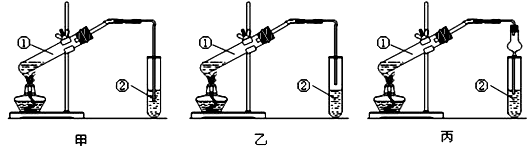
根据分析回答:(1)三位同学设计的装置中最不合理的是____ (选填“甲”或“乙”或“丙”),原因是_________________ 。
【实验步骤】
a.按所选择的装置组装仪器,在试管①中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加入适量的饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象时停止实验。
(2)试管①中加入浓硫酸的作用是______________________________
(3)该实验中长导管的作用是___________________ 。
(4)试管②中饱和Na2CO3溶液的作用是_______________ ;可否用NaOH溶液代替Na2CO3溶液?_____ (填“是”或“否”),理由是用化学方程式回答_______________ 。
(5)写出试管①中乙醇工业制取的化学方程式________________________________ ;
II.实验室制备硝基苯的主要步骤如下:
a、配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b、向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c、在55~60℃下发生反应,直至反应结束;
d、除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e、将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是________________ 。
②配制一定比例的浓H2SO4与浓HNO3的混合酸时,操作的注意事项是:_____ 。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是________________ 。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:

根据分析回答:(1)三位同学设计的装置中最不合理的是
【实验步骤】
a.按所选择的装置组装仪器,在试管①中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加入适量的饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象时停止实验。
(2)试管①中加入浓硫酸的作用是
(3)该实验中长导管的作用是
(4)试管②中饱和Na2CO3溶液的作用是
(5)写出试管①中乙醇工业制取的化学方程式
II.实验室制备硝基苯的主要步骤如下:
a、配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b、向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c、在55~60℃下发生反应,直至反应结束;
d、除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e、将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是
②配制一定比例的浓H2SO4与浓HNO3的混合酸时,操作的注意事项是:
③步骤d中洗涤、分离粗硝基苯应使用的仪器是
您最近一年使用:0次
2 . 下列有关实验装置进行的相应实验,能达到实验目的的是
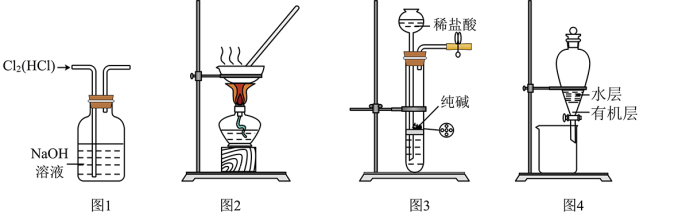

A.用图 所示装置除去 所示装置除去 中含有的少量 中含有的少量 |
B.用图 所示装置蒸干 所示装置蒸干 饱和溶液制备 饱和溶液制备 晶体 晶体 |
C.用图 所示装置制取少量纯净的 所示装置制取少量纯净的 气体 气体 |
D.用图 所示装置分离 所示装置分离 萃取碘水后已分层的有机层和水层 萃取碘水后已分层的有机层和水层 |
您最近一年使用:0次
2022-12-09更新
|
2105次组卷
|
50卷引用:2015-2016学年吉林松原油田高中高一下期初考试化学试卷
2015-2016学年吉林松原油田高中高一下期初考试化学试卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷(已下线)2013届安徽省阜阳一中高三上学期第二次模化学试卷(已下线)2014届高考化学二轮复习 专题12化学实验基础练习卷(已下线)2014高考化学名师选择题专练 实验基础练习卷(已下线)2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(已下线)2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(已下线)2014届浙江省温州中学高三上学期期末理综化学试卷2012年普通高等学校招生全国统一考试化学(江苏卷)(已下线)2013-2014贵州省遵义四中高三第五次月考理综化学试卷(已下线)2013-2014浙江省宁波效实中学高二下学期期末考试化学试卷(已下线)2015届江西省信丰中学高三上学期第一次月考化学试卷2015届江苏省盐城市时杨中学高三第二次调研考试化学试卷2014-2015广西桂林市第十八中学高二下学期期中考试化学试卷2014-2015学年江西省南昌市二中高二下学期期末化学试卷2016届湖北省荆州中学高三上学期第一次质检化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2016届浙江省杭州高级中学高三上学期月考(三)化学试卷2016届浙江临海台州中学高三上学期第三次统练化学试卷2016届福建省闽粤联合体高三上学期第三次联考化学试卷2016届浙江省临海市台州中学高三上学期第三次统考化学试卷2016届湖北省荆州市公安一中高三上学期12月月考化学试卷2015-2016学年湖南省怀化市高一上学期期末化学试卷2015-2016学年广西桂林十八中高一下开学测化学试卷2015-2016学年贵州省遵义航天中学高一下3月月考化学卷2016年山东省普通高中学业水平化学模拟试卷(4)2017届广西陆川中学高三上9月月考化学试卷2017届湖南省长沙市长郡中学高三上月考二化学试卷山西省忻州市第一中学2016-2017学年高一必修一:第1章从实验学化学同步练习化学试题河南省郑州市外国语学校2018届高三上学期第一次月考化学试题新疆石河子第二中学2018届高三上学期第一次月考化学试题广西桂林市2017-2018学年高二上学期期末考试化学试题山东省泰安市2017-2018学年高一上学期期末考试化学试题湖北省襄阳市第四中学2017-2018学年高一3月月考化学试题江苏省泰州中学2017-2018学年高二下学期学业水平测试模拟(三)(必修)化学试题河北省邯郸市永年区第二中学2019届高三上学期9月月考化学试题(已下线)2018年11月7日——《每日一题》高考一轮复习 化学实验基本操作山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题江苏省苏州市震泽中学2019-2020学年高一上学期第二次月考化学试题江苏省苏州市2019~2020学年第一学期期末高一学业质量阳光指标调研化学试题甘肃省张掖市高台县第一中学2018—2019学年高二下学期期中考试化学试题山东省潍坊市2019-2020学年高一下学期3月阶段监测化学试题(已下线)上海市奉贤区2013年高考二模化学试题山东省泰安第一中学2019-2020学年高一下学期期中考试化学试题陕西省延安市第一中学2019-2020学年高一下学期期中考试化学试题山东省泰安市宁阳一中2020-2021学年高一下学期第一次考试化学试题海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题(已下线)专题11 化学实验基础(测)-2023年高考化学二轮复习讲练测(新高考专用)海南省海口市第一中学2023-2024学年高二上学期第一次月考化学试题
名校
3 . 由于化石燃料的长期大量消耗,传统能源逐渐枯竭,而人类对能源的需求量越来越高,氢能源和化学电源的开发与利用成为全球发展的重要问题。水合肼 是重要的氢能源稳定剂,其制备的反应原理为
是重要的氢能源稳定剂,其制备的反应原理为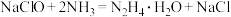 。下列装置和操作不能达到实验目的的是
。下列装置和操作不能达到实验目的的是
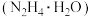 是重要的氢能源稳定剂,其制备的反应原理为
是重要的氢能源稳定剂,其制备的反应原理为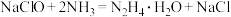 。下列装置和操作不能达到实验目的的是
。下列装置和操作不能达到实验目的的是| A | B | C | D |
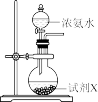 |  |  | 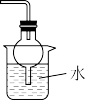 |
在圆底烧瓶中加入碱石灰制取 | 作为反应过程的安全瓶 | 制备水合肼时从b口通入 | 吸收反应中过量的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-13更新
|
95次组卷
|
2卷引用:吉林省松原市实验高级中学2020-2021学年高三下学期第三次摸底测试化学试题
4 . “侯德榜制碱法”首先需制备碳酸氢钠:NaCl(饱和)+NH3+CO2+H2O =NaHCO3 ↓ +NH4C1。下列装置能达到实验目的的是
A. | B. | C. | D.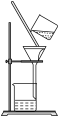 |
您最近一年使用:0次
2019-04-25更新
|
588次组卷
|
2卷引用:吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021-2022学年高一下学期第一次线上测试化学试题
9-10高二下·辽宁沈阳·期末
名校
5 . 用下列装置不能达到有关实验目的的是
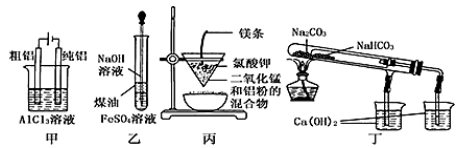

| A.用甲图装置电解精炼铝 |
| B.用乙图装置制备氢氧化亚铁 |
| C.用丙图装置可制得金属铁 |
| D.用丁图装置验证碳酸氢钠和碳酸钠的热稳定性 |
您最近一年使用:0次
2016-12-09更新
|
315次组卷
|
16卷引用:2017届吉林省松原油田高中高三上第一次阶段测化学卷
2017届吉林省松原油田高中高三上第一次阶段测化学卷(已下线)09-10年沈阳市重点高中高二下学期联考化学卷(已下线)09-10年如皋市高二下学期期末考试化学卷(已下线)2010年湖北襄樊四校高三上学期期中联考化学卷(已下线)2011届广东省增城中学高三第二次综合测试(理综)化学试题(已下线)2013届四川省泸州市高三第一次诊断性考试化学试卷(已下线)2014高考化学名师知识点精编 专题23实验方案的设计与评价练习卷(已下线)2014届黑龙江省大庆一中高三下学期第二阶段考试化学试卷2015届江苏省南通中学高三上学期期中考试化学试卷2016届辽宁师范大学附属中学高三上学期期中考试化学试卷2016届四川成都第七中学高三阶段测试三理综化学试卷2016届四川省成都七中高三上学期11月段考化学试卷(已下线)2019年4月17日 《每日一题》三轮复习-其他金属及其化合物甘肃省武威市凉州区武威第八中学2021届高三年级第一次诊断考试化学试题陕西省洛南中学2021届高三上学期第一次模拟化学试题湖南省衡阳市第八中学2021届高三上学期第三次月考试题(11月) 化学试题
6 . 碳酸镧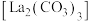 可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:
可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为: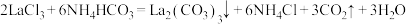 某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
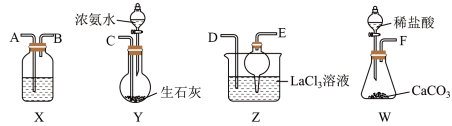
(1)盛放稀盐酸的仪器名称为___________ 。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:___________ 。
F→___________→___________→___________→___________→___________。
(3)X中盛放的试剂是___________ ,其作用为___________ 。
(4)Z中应先通入 ,后通入过量的
,后通入过量的 ,原因为
,原因为___________ 。
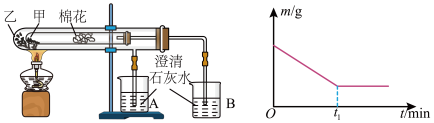
(5)该化学兴趣小组为探究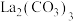 和
和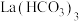 的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为
的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为___________ ;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为___________ 。
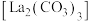 可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:
可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为: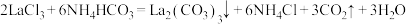 某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
(1)盛放稀盐酸的仪器名称为
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:
F→___________→___________→___________→___________→___________。
(3)X中盛放的试剂是
(4)Z中应先通入
 ,后通入过量的
,后通入过量的 ,原因为
,原因为(5)该化学兴趣小组为探究
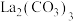 和
和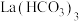 的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为
的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为
您最近一年使用:0次
名校
7 . 由于“新冠”病毒的输入,“84”消毒液已成为必需品。“84”消毒液一般是用氯气和氢氧化钠制备。某同学设计了如图所示的实验装置,按要求回答下列问题:
(1)E中反应的离子方程式为___________ 。
(2)装置C中的实验现象为___________ ,装置D中的实验现象为___________ 。
(3)A中挥发出的HCl对C、D中的实验结论是否有影响,请判断并说明理由___________ 。
(4)“84”消毒液在空气中久置后,NaClO会转化为HClO,HClO分解失效,证明消毒液已失效的实验操作步骤为___________ 。

(1)E中反应的离子方程式为
(2)装置C中的实验现象为
(3)A中挥发出的HCl对C、D中的实验结论是否有影响,请判断并说明理由
(4)“84”消毒液在空气中久置后,NaClO会转化为HClO,HClO分解失效,证明消毒液已失效的实验操作步骤为
您最近一年使用:0次
名校
解题方法
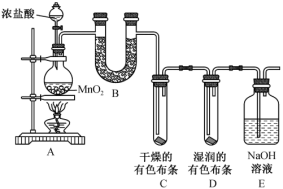
8 . 实验室模拟工业制备硫氰化钾的实验装置如下图所示(部分夹持装置已略去):

已知: 是密度比水大且不溶于水的液体,
是密度比水大且不溶于水的液体, 不溶于
不溶于 。在一定条件下发生反应:
。在一定条件下发生反应: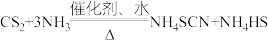 ,生成物中
,生成物中 的热稳定性较
的热稳定性较 差。请回答下列问题:
差。请回答下列问题:
(1)装置A中恒压滴液漏斗中的试剂是_______ 。
(2)三颈烧瓶内盛放有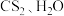 和固体催化剂,进气导管口插入下层
和固体催化剂,进气导管口插入下层 液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中
液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中 的生成速率,则X的化学式为
的生成速率,则X的化学式为_______ 。
(3)反应一段时间后,关闭 ,保持三颈烧瓶内液体温度
,保持三颈烧瓶内液体温度 ℃一段时间,其目的是
℃一段时间,其目的是_______ ;然后打开 ,继续保持液温
,继续保持液温 ℃,缓缓滴入适量的
℃,缓缓滴入适量的 溶液,制得较纯净的KSCN溶液,该反应的化学方程式为
溶液,制得较纯净的KSCN溶液,该反应的化学方程式为_______ 。
(4)装置E吸收尾气,防止污染环境,其中吸收 生成无色无味气体的离子方程式为
生成无色无味气体的离子方程式为_______ 。
(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、降温结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
测定晶体中KSCN的含量:称取 样品,配成
样品,配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴_______ 溶液(填化学式)作指示剂,用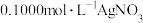 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。该晶体中
。该晶体中 的质量分数为
的质量分数为_______ 。[已知:滴定时发生的反应: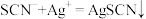 (白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数
(白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数_______ 。(选填“偏大”、“偏小”或“无影响”)

已知:
 是密度比水大且不溶于水的液体,
是密度比水大且不溶于水的液体, 不溶于
不溶于 。在一定条件下发生反应:
。在一定条件下发生反应: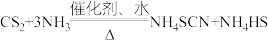 ,生成物中
,生成物中 的热稳定性较
的热稳定性较 差。请回答下列问题:
差。请回答下列问题:(1)装置A中恒压滴液漏斗中的试剂是
(2)三颈烧瓶内盛放有
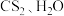 和固体催化剂,进气导管口插入下层
和固体催化剂,进气导管口插入下层 液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中
液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中 的生成速率,则X的化学式为
的生成速率,则X的化学式为(3)反应一段时间后,关闭
 ,保持三颈烧瓶内液体温度
,保持三颈烧瓶内液体温度 ℃一段时间,其目的是
℃一段时间,其目的是 ,继续保持液温
,继续保持液温 ℃,缓缓滴入适量的
℃,缓缓滴入适量的 溶液,制得较纯净的KSCN溶液,该反应的化学方程式为
溶液,制得较纯净的KSCN溶液,该反应的化学方程式为(4)装置E吸收尾气,防止污染环境,其中吸收
 生成无色无味气体的离子方程式为
生成无色无味气体的离子方程式为(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、降温结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
测定晶体中KSCN的含量:称取
 样品,配成
样品,配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴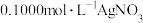 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。该晶体中
。该晶体中 的质量分数为
的质量分数为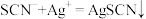 (白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数
(白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数
您最近一年使用:0次
2021-04-16更新
|
480次组卷
|
3卷引用:吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期第三次摸底测试化学试题
吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期第三次摸底测试化学试题湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)01(含考试版、答题卡、参考答案、全解全析)
9 . 某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应),请回答下列问题。
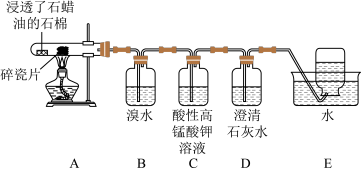
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷发生反应:C16H34 C8H18+甲,甲
C8H18+甲,甲 4乙。则甲的分子式为
4乙。则甲的分子式为__ ,乙的结构简式为__ 。
(2)B装置中的实验现象可能是___ ,写出反应的化学方程式___ 。其反应类型是__ 。
(3)C装置中可观察到的现象是__ ,反应类型是__ 。
(4)查阅资料知。乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置__ (填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应。可以测定装置B中溶液在反应前后的酸碱性,简述其理由__ 。
(5)通过上述实验探究。检验甲烷和乙烯的方是__ (选填字母,下同):除去甲烷中乙烯的方法是___ 。
A.气体通入水中
B.气体通过盛溴的四氯化碳溶液洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)乙醇分子中不同的化学键如图,查阅资料知,实验室用乙醇和浓硫酸共热至170℃也可以制备乙烯。则反应中乙醇的断键位置为___ 。

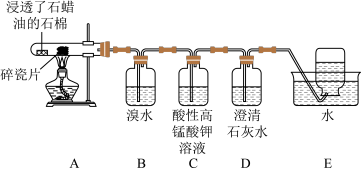
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷发生反应:C16H34
 C8H18+甲,甲
C8H18+甲,甲 4乙。则甲的分子式为
4乙。则甲的分子式为(2)B装置中的实验现象可能是
(3)C装置中可观察到的现象是
(4)查阅资料知。乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置
(5)通过上述实验探究。检验甲烷和乙烯的方是
A.气体通入水中
B.气体通过盛溴的四氯化碳溶液洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)乙醇分子中不同的化学键如图,查阅资料知,实验室用乙醇和浓硫酸共热至170℃也可以制备乙烯。则反应中乙醇的断键位置为

您最近一年使用:0次
2021-02-23更新
|
354次组卷
|
4卷引用:吉林省松原市实验高级中学2020-2021学年高二下学期第一次月考化学 (B)试题
吉林省松原市实验高级中学2020-2021学年高二下学期第一次月考化学 (B)试题广东省广州市三校联考2020-2021学年高二上学期期末考试化学试题(已下线)2.2 烯烃 炔烃(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)2.2.1 烯烃-2020-2021学年高二化学课时同步练(人教版2019选择性必修3)
名校
10 . 亚硝酸钠是重要的防腐剂,重氮化试剂。在重氮化反应中可以被亚硝酰硫酸(NOSO4H)代替。实验室用如图装置(夹持装置略)制备少量亚硝酰硫酸,并测定产品的纯度。
已知:
①亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解成硫酸、硝酸和一氧化氮,溶于浓硫酸而不分解。
②实验室用SO2与浓硫酸和浓硝酸的混合液制备亚硝酰硫酸。
(1)利用装置A制备SO2,写出反应的化学方程式___________ 。
(2)按气流从左到右的顺序,上述仪器的连接顺序为___________ (填仪器接口字母,部分仪器可重复使用)。
(3)装置D使用的是冷水浴,选择此条件的原因___________ 。
(4)装置D中发生反应的化学方程式为___________ 。
(5)在上述反应条件下,开始时反应缓慢,但某时刻反应速率明显加快其原因是____________ 。
(6)测定亚硝酰硫酸(NOSO4H)的纯度
已知:
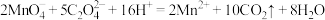
步骤如下:步骤1:准确称取14.00 g产品,在特定条件下配制成250 mL溶液。
步骤2:取25.00 mL产品于250 mL碘量瓶中,加入60.00 mL未知浓度KMnO4溶液(过量)和10.00 mL 25% H2SO4溶液,然后摇匀。
步骤3:用0.2500 mol/L Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积为20.00 mL。
把亚硝酰硫酸(NOSO4H)溶液换为蒸馏水(空白实验),重复上述步骤,消耗Na2C2O4溶液的体积为60.00 mL。
①达到滴定终点时的现象为___________ ,亚硝酰硫酸的纯度为___________ 。(精确到0.1%)
②若其它操作及读数均正确,在空白实验操作中,下列操作会导致所测定样品中NOSO4H的纯度偏小的是___________ (填字母)。
A.滴加Na2C2O4标准溶液时,滴加前仰视读数,滴加后俯视读数
B.滴加Na2C2O4标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
C.滴定过程中,将挂在锥形瓶壁上的Na2C2O4标准溶液用蒸馏水冲进瓶内

已知:
①亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解成硫酸、硝酸和一氧化氮,溶于浓硫酸而不分解。
②实验室用SO2与浓硫酸和浓硝酸的混合液制备亚硝酰硫酸。
(1)利用装置A制备SO2,写出反应的化学方程式
(2)按气流从左到右的顺序,上述仪器的连接顺序为
(3)装置D使用的是冷水浴,选择此条件的原因
(4)装置D中发生反应的化学方程式为
(5)在上述反应条件下,开始时反应缓慢,但某时刻反应速率明显加快其原因是
(6)测定亚硝酰硫酸(NOSO4H)的纯度
已知:

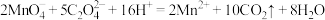
步骤如下:步骤1:准确称取14.00 g产品,在特定条件下配制成250 mL溶液。
步骤2:取25.00 mL产品于250 mL碘量瓶中,加入60.00 mL未知浓度KMnO4溶液(过量)和10.00 mL 25% H2SO4溶液,然后摇匀。
步骤3:用0.2500 mol/L Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积为20.00 mL。
把亚硝酰硫酸(NOSO4H)溶液换为蒸馏水(空白实验),重复上述步骤,消耗Na2C2O4溶液的体积为60.00 mL。
①达到滴定终点时的现象为
②若其它操作及读数均正确,在空白实验操作中,下列操作会导致所测定样品中NOSO4H的纯度偏小的是
A.滴加Na2C2O4标准溶液时,滴加前仰视读数,滴加后俯视读数
B.滴加Na2C2O4标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
C.滴定过程中,将挂在锥形瓶壁上的Na2C2O4标准溶液用蒸馏水冲进瓶内
您最近一年使用:0次
2021-04-10更新
|
333次组卷
|
3卷引用:吉林省油田高级中学2020-2021学年高三下学期第三次摸底测试化学试题



