1 . 在实验室进行下列实验,所进行的操作不能达到实验目的的是
| 选项 | 实验目的 | 操作 |
| A | 制备银氨溶液 | 在洁净的试管中加入1 mL 2%的稀氨水,然后边振荡试管边滴加3 mL 10%的硝酸银溶液 |
| B | 鉴别苯和氯仿 | 分别取少量液体于试管中,加入2 mL溴水,观察分层后的现象 |
| C | 鉴别无水硫酸铜和硫酸钡 | 分别取少许粉末于试管中,滴加少量蒸馏水,观察溶液颜色 |
| D | 除去氯化铁溶液中的氯化铜 | 加入过量铁粉,充分反应后过滤,向滤液中滴加适量氯水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 用下列实验装置进行相应实验,装置(加热和夹持装置已省略)正确且能达到相应实验目的的是( )
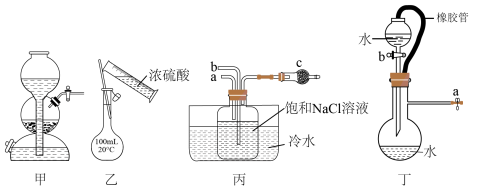

A.装置丙是模拟侯氏制碱法的部分装置,则从a口通入的气体为 |
B.用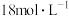 浓硫酸配制 浓硫酸配制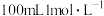 稀硫酸会涉及图乙所示操作 稀硫酸会涉及图乙所示操作 |
C.实验室可用浓盐酸和 制备氯气,用装置甲作为发生装置,其优点是随关随停 制备氯气,用装置甲作为发生装置,其优点是随关随停 |
| D.检验装置丁的气密性:关闭止水夹a,打开活塞b,水能持续顺利流下,则表示装置气密性不好 |
您最近一年使用:0次
2023-10-17更新
|
306次组卷
|
2卷引用:吉林省部分名校2023-2024学年高二上学期10月联考化学试题
名校
解题方法
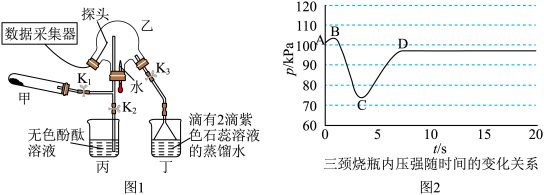
3 . 某化学兴趣小组利用图1装置(加热和夹持装置已省略)制备氨气并进行喷泉实验.
i.氨气的制备:打开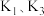 ,关闭
,关闭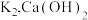 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.
ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备 ,关闭
,关闭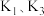 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
请回答下列问题:___________________ ;丁处倒置漏斗的作用是______________ ;氨水中含有的分子有 、
、______________ .
(2)C→D过程中,三颈烧瓶中的现象为_____________ ; 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为_____________ .
(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.__________________________ .
②烧杯中发生反应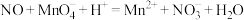 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为__________ (填化学式),氧化产物和还原产物的物质的量之比为__________ (填最简整数比).
i.氨气的制备:打开
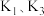 ,关闭
,关闭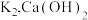 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备
 ,关闭
,关闭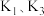 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.请回答下列问题:
 、
、(2)C→D过程中,三颈烧瓶中的现象为
 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.
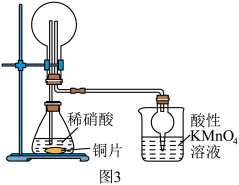
②烧杯中发生反应
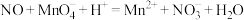 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为
您最近一年使用:0次
2024-05-08更新
|
110次组卷
|
3卷引用:吉林省长春市榆树市第一高级中学校等五校2023-2024学年高一下学期期中考试联考化学试题
名校
解题方法
4 . 铁及其化合物在生产,生活中有重要用途。某化学兴趣小组的同学设计了以下两个实验,请回答下列问题:
I.“铁与水反应”,并检验产物的性质。(夹持装置已略去)

(1)装置A中盛放碎瓷片的仪器的名称为_______ ,装置A的作用是_______ ;
(2)装置B中发生反应的化学方程式为_______ ;
(3)实验一段时间后,装置E中的实验现象为_______ ;
Ⅱ.制备Fe(OH)2。

已知:NaOH溶液是用去氧水配制的。
(4)仪器a使用之前需要采取的操作是_______ ,煤油的作用是_______ 。
(5)实验开始时的具体操作是_______ ,仪器b中产生均匀气泡后的操作是_______ 。
(6)设计实验检验仪器c中的金属离子:_______ 。
I.“铁与水反应”,并检验产物的性质。(夹持装置已略去)

(1)装置A中盛放碎瓷片的仪器的名称为
(2)装置B中发生反应的化学方程式为
(3)实验一段时间后,装置E中的实验现象为
Ⅱ.制备Fe(OH)2。

已知:NaOH溶液是用去氧水配制的。
(4)仪器a使用之前需要采取的操作是
(5)实验开始时的具体操作是
(6)设计实验检验仪器c中的金属离子:
您最近一年使用:0次
2024-01-11更新
|
227次组卷
|
2卷引用:吉林省白山市抚松县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
5 . 肉桂酸是一种重要的有机合成中间体,被广泛应用于制备药物、食品添加剂等精细化学品。实验室利用苯甲醛和乙酸酐无水环境下合成肉桂酸的原理及部分试剂物理常数如下。
某实验小组采用如下装置制备肉桂酸,实验步骤如下,按要求回答下列问题。
②反应结束稍冷,加入10mL温水,改用装置2利用水蒸气蒸馏出未反应完的苯甲醛。
③将烧瓶冷却,加入10mL10%氢氧化钠溶液溶解肉桂酸,加热煮沸后加入少量活性炭脱色,趁热抽滤。
④将滤液冷却后,搅拌并用浓盐酸酸化,冷却后抽滤,洗涤沉淀,抽干获得粗产品1.5g。
(1)仪器a的名称是___________ ,与仪器b___________ (填“能”或“不能”)互换。
(2)步骤①中加热方式可以采用___________ ;a的上口连接盛有CaCl2固体的干燥管,目的是___________ 。
(3)装置2中水蒸气发生器为___________ (填“1”或“2”),判断水蒸气蒸馏操作结束的实验现象为___________ 。
(4)步骤④中可采用___________ 洗涤沉淀,加入浓盐酸酸化的目的是___________ 。
(5)该实验中肉桂酸的产率约为___________ %。(保留两位有效数字)
 +
+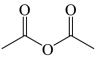
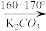
 +CH3COOH
+CH3COOH
| 名称 | 性状 | 比重 | 熔点℃ | 沸点℃ | 溶解度 |
| 苯甲醛 | 无色油状液体 | 1.044 | -26 | 179 | 微溶于水 |
| 乙酸酐 | 无色透明液体 | 1.082 | -73 | 140 | 与水缓慢反应生成乙酸 |
| 肉桂酸 | 白色晶体 | 1.248 | 135 | 300 | 难溶于冷水,可溶于热水,易溶于乙醇 |

②反应结束稍冷,加入10mL温水,改用装置2利用水蒸气蒸馏出未反应完的苯甲醛。
③将烧瓶冷却,加入10mL10%氢氧化钠溶液溶解肉桂酸,加热煮沸后加入少量活性炭脱色,趁热抽滤。
④将滤液冷却后,搅拌并用浓盐酸酸化,冷却后抽滤,洗涤沉淀,抽干获得粗产品1.5g。
(1)仪器a的名称是
(2)步骤①中加热方式可以采用
(3)装置2中水蒸气发生器为
(4)步骤④中可采用
(5)该实验中肉桂酸的产率约为
您最近一年使用:0次
2024-01-14更新
|
580次组卷
|
5卷引用:实验综合题
(已下线)实验综合题THUSSAT中学生标准学术能力2023-2024学年高三上学期1月诊断性测理科综合试卷(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
6 . 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:

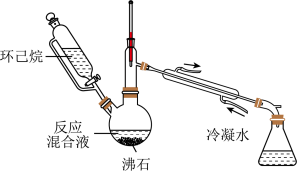
| A.以共沸体系带水促使反应正向进行 | B.反应时水浴温度需严格控制在69℃ |
| C.接收瓶中会出现分层现象 | D.根据带出水的体积可估算反应进度 |
您最近一年使用:0次
2023-06-14更新
|
8720次组卷
|
18卷引用:吉林省长春市第五中学2022-2023学年高一下学期期末考试化学试题
吉林省长春市第五中学2022-2023学年高一下学期期末考试化学试题2023年高考湖北卷化学真题(已下线)专题14 化学实验方案的设计与评价(已下线)T8-化学实验基础(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)T9-实验方案的设计与评价黑龙江省大庆实验中学实验三部2022-2023学年高二下学期期末考试化学试题福建省晋江市平山学校,泉州中远学校,晋江市内坑中学,晋江市磁灶中学,永春第二中学2022-2023学年高二下学期期末联考化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二下学期期末考试化学试题(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)第16讲物质的制备福建省龙岩市连城县第一中学2023-2024学年高三上学期8月月考化学试题江西省丰城中学2023-2024学年高二创新班上学期开学考试化学试题(已下线)考点3 物质的制备与性质实验 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第3讲 物质制备实验的设计与评价云南省宣威市第六中学2023-2024学年高二上学期12月月考化学试题(已下线)热点09 乙醇与乙酸安徽省六安第一中学2023-2024学年高二下学期期中考试化学试题
解题方法
7 . 氢氧化亚铁制备实验是高中化学中的重要演示实验之一。某化学课外小组对氢氧化亚铁的制备作了大量研究,对制备中产生的绿色物质的成分进行了探究。
Ⅰ.学习小组用如下实验装置配制 溶液和
溶液和 溶液,所用蒸馏水均先煮沸再冷却,
溶液,所用蒸馏水均先煮沸再冷却, 溶液中加入维生素C和稀硫酸。
溶液中加入维生素C和稀硫酸。

实验一:
(1) 溶液中加入维生素C,是因为维生素C具有
溶液中加入维生素C,是因为维生素C具有_______ 。
(2)该小组同学查阅资料得知通过煮沸的方法无法除尽水中的氧气。依据上述实验,推测方法一中灰白色沉淀比方法二中灰白色沉淀存在时间长的原因为_______ 、_______ 。(任答2点)
Ⅱ.进一步探究沉淀成分。
实验二:将实验一中所得的灰白色沉淀迅速推出到滤纸上。
方法1:得到的沉淀a的颜色快速转变为红褐色,无灰绿色物质出现。
方法2:得到的沉淀b,灰绿色保持了较长时间,半小时后边缘部分逐渐变为红褐色,15小时后全部转化为红褐色。
(3)依据上述现象,沉淀a为较纯的_______ (填化学式)。将沉淀a久置于真空反应器中,固体先变为深绿色,再缓慢变为黑色,用磁铁检测,两种固体产物均可被吸引。久置过程中总反应的化学方程式为_______ 。
(4)取灰绿色的沉淀b洗涤干净,加盐酸溶解,沉淀转化为黄色溶液。将此黄色溶液滴入到 溶液中,溶液呈血红色;滴入到
溶液中,溶液呈血红色;滴入到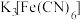 溶液中,产生蓝色沉淀;滴入到
溶液中,产生蓝色沉淀;滴入到 溶液中,产生白色沉淀,证明沉淀b中含有的离子为
溶液中,产生白色沉淀,证明沉淀b中含有的离子为_______ 。(填离子符号)
Ⅲ.学习小组依据探究结果,设计如下实验(装置如图)。
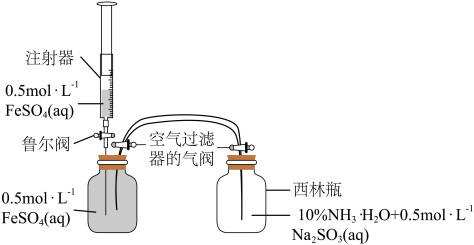
实验三:打开右瓶上方的空气过滤器的气阀,然后依次打开鲁尔阀、推动注射器,将左瓶中的 溶液压入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、右瓶上方的空气过滤器的气阀,打开左瓶上方的空气过滤器的气阀。
溶液压入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、右瓶上方的空气过滤器的气阀,打开左瓶上方的空气过滤器的气阀。
(5)实验开始时,打开右瓶上方的空气过滤器的气阀的作用是_______ ,用氨水( )代替教材实验中的
)代替教材实验中的 溶液的目的是
溶液的目的是_______ ,氨水中加入
 溶液的目的是
溶液的目的是_______ 。(用离子方程式表示)。
Ⅰ.学习小组用如下实验装置配制
 溶液和
溶液和 溶液,所用蒸馏水均先煮沸再冷却,
溶液,所用蒸馏水均先煮沸再冷却, 溶液中加入维生素C和稀硫酸。
溶液中加入维生素C和稀硫酸。
实验一:
| 编号 | 实验操作 | 实验现象 |
| 方法一 | 在注射器A中吸入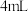   溶液,通过注射器B缓慢推入 溶液,通过注射器B缓慢推入   溶液、得沉淀a 溶液、得沉淀a | 生成灰白色沉淀(存在时间比方法二的长),20秒后表面有少许灰绿色固体 |
| 方法二 | 在注射器A中吸入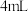   溶液,通过注射器B缓慢推入 溶液,通过注射器B缓慢推入   溶液,得沉淀b 溶液,得沉淀b | 生成灰白色沉淀(存在时间很短),20秒后颜色加深至灰绿色 |
 溶液中加入维生素C,是因为维生素C具有
溶液中加入维生素C,是因为维生素C具有(2)该小组同学查阅资料得知通过煮沸的方法无法除尽水中的氧气。依据上述实验,推测方法一中灰白色沉淀比方法二中灰白色沉淀存在时间长的原因为
Ⅱ.进一步探究沉淀成分。
实验二:将实验一中所得的灰白色沉淀迅速推出到滤纸上。
方法1:得到的沉淀a的颜色快速转变为红褐色,无灰绿色物质出现。
方法2:得到的沉淀b,灰绿色保持了较长时间,半小时后边缘部分逐渐变为红褐色,15小时后全部转化为红褐色。
(3)依据上述现象,沉淀a为较纯的
(4)取灰绿色的沉淀b洗涤干净,加盐酸溶解,沉淀转化为黄色溶液。将此黄色溶液滴入到
 溶液中,溶液呈血红色;滴入到
溶液中,溶液呈血红色;滴入到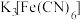 溶液中,产生蓝色沉淀;滴入到
溶液中,产生蓝色沉淀;滴入到 溶液中,产生白色沉淀,证明沉淀b中含有的离子为
溶液中,产生白色沉淀,证明沉淀b中含有的离子为Ⅲ.学习小组依据探究结果,设计如下实验(装置如图)。

实验三:打开右瓶上方的空气过滤器的气阀,然后依次打开鲁尔阀、推动注射器,将左瓶中的
 溶液压入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、右瓶上方的空气过滤器的气阀,打开左瓶上方的空气过滤器的气阀。
溶液压入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、右瓶上方的空气过滤器的气阀,打开左瓶上方的空气过滤器的气阀。(5)实验开始时,打开右瓶上方的空气过滤器的气阀的作用是
 )代替教材实验中的
)代替教材实验中的 溶液的目的是
溶液的目的是
 溶液的目的是
溶液的目的是
您最近一年使用:0次
2022-12-11更新
|
143次组卷
|
2卷引用:吉林省部分学校2022-2023学年高三上学期12月联考化学试题
8 . 某化学兴趣小组探究SO2与Ca( NO3)2溶液的反应。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是_______ (写名称) 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是_______ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究SO 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象可得出对SO2氧化起主要作用的是_______ (填O2或NO ),其理由是
),其理由是_______ 。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
| A.易沉淀固体 | B.胶状物质 | C.大颗粒沉淀 | D.絮状物质 |
实验三:探究SO
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象可得出对SO2氧化起主要作用的是
 ),其理由是
),其理由是
您最近一年使用:0次
2022-02-17更新
|
615次组卷
|
2卷引用:吉林省长春市博硕学校(原北师大长春附属学校)2021-2022学年高二下学期期末考试化学试题
名校
9 . 为了探究原电池和电解池的工作原理,某研究性学习小组分别用如图所示的装置进行实验。回答下列问题:
(1)该小组设计了图1实验装置,模拟工业处理 ,M、N均为惰性材料。
,M、N均为惰性材料。

①从物质变化的角度,该实验装置可用于制备_______ ,从能量变化角度,当看到_______ 现象时,说明该实验装置同时获得了电能。
②M极的电极反应式为_______ 。
(2)该研究性学习小组利用电解法将 转化为
转化为 ,实现了
,实现了 的资源化利用.电解的工作原理如图2所示。
的资源化利用.电解的工作原理如图2所示。
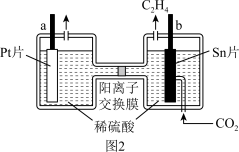
①a极接电源_______ 极,b极电极反应式为_______ 。
②若a极收集到 (标准状况)气体,则理论上消耗
(标准状况)气体,则理论上消耗 的质量为
的质量为_______ g(忽略气体的溶解)。
(1)该小组设计了图1实验装置,模拟工业处理
 ,M、N均为惰性材料。
,M、N均为惰性材料。
①从物质变化的角度,该实验装置可用于制备
②M极的电极反应式为
(2)该研究性学习小组利用电解法将
 转化为
转化为 ,实现了
,实现了 的资源化利用.电解的工作原理如图2所示。
的资源化利用.电解的工作原理如图2所示。
①a极接电源
②若a极收集到
 (标准状况)气体,则理论上消耗
(标准状况)气体,则理论上消耗 的质量为
的质量为
您最近一年使用:0次
名校
10 . 某研究性学习小组利用下列有关装置制备 ,并对
,并对 的性质进行探究(装置的气密性已检查)。已知:
的性质进行探究(装置的气密性已检查)。已知: 溶液显酸性。
溶液显酸性。

Ⅰ.探究 与可溶性钡的强酸盐是否反应(接口a接b)
与可溶性钡的强酸盐是否反应(接口a接b)
(1)滴加浓硫酸之前,打开弹簧夹,通入一段时间 ,再关闭弹簧夹,此操作的目的是
,再关闭弹簧夹,此操作的目的是_______ 。
(2)实验过程中装置B中没有明显变化,装置C中有白色沉淀生成,该沉淀不溶于稀盐酸。据B中现象得出的结论是_______ ,装置C中反应的离子方程式是_______ 。
(3)装置D中NaOH全部转化为 的标志为
的标志为_______ 。
Ⅱ.探究亚硫酸与次氯酸的酸性强弱(接口a接c)
(4)将少量装置A中生成的气体直接通入装置G中,不能根据G中现象判断亚硫酸与次氯酸的酸性强弱,理由是_______ (用化学反应方程式表示)。
(5)为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置E中药品是_______ ,其作用是_______ ,通过_______ 现象即可证明亚硫酸的酸性强于次氯酸。
 ,并对
,并对 的性质进行探究(装置的气密性已检查)。已知:
的性质进行探究(装置的气密性已检查)。已知: 溶液显酸性。
溶液显酸性。
Ⅰ.探究
 与可溶性钡的强酸盐是否反应(接口a接b)
与可溶性钡的强酸盐是否反应(接口a接b)(1)滴加浓硫酸之前,打开弹簧夹,通入一段时间
 ,再关闭弹簧夹,此操作的目的是
,再关闭弹簧夹,此操作的目的是(2)实验过程中装置B中没有明显变化,装置C中有白色沉淀生成,该沉淀不溶于稀盐酸。据B中现象得出的结论是
(3)装置D中NaOH全部转化为
 的标志为
的标志为Ⅱ.探究亚硫酸与次氯酸的酸性强弱(接口a接c)
(4)将少量装置A中生成的气体直接通入装置G中,不能根据G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
(5)为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置E中药品是
您最近一年使用:0次
2022-05-05更新
|
197次组卷
|
3卷引用:吉林省长春外国语学校2023-2024学年高二上学期9月月考化学试题



