1 . 由下列实验装置及现象一定能得出相应结论的是
| 选项 | A | B | C | D |
| 装置 |  |  | 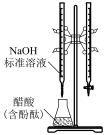 | 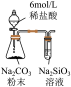 |
| 现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 产生红褐色沉淀 | 锥形瓶中溶液由无色变粉红色,半分钟不褪色 | 试管中液体变浑浊 |
| 目的 | 溶解度: AgCl>AgBr>AgI | 制备Fe(OH)3胶体 | 测定醋酸浓度 | 非金属性: Cl>C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 实验证明,胶体的凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大。
(1)向Fe(OH)3胶体中加入下列电解质时,其凝聚能力最强的为___________ 。[已知:Fe(OH)3胶体粒子带正电荷]
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,___________(填字母)效果最明显。
(3)将少量FeCl3饱和溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:将FeCl3饱和溶液滴加到冷水中;
乙:将FeCl3饱和溶液滴加到NaOH溶液中;
丙:将FeCl3饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
①丙中反应的化学方程式为___________ 。
②用最简单的方法判断丙中是否成功制备胶体,写出相关的操作、现象和结论___________ ,能产生该现象的原因是胶体粒子对光波的___________ 所致。
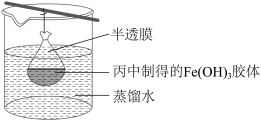
③可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。该方法名称为___________ 。
(1)向Fe(OH)3胶体中加入下列电解质时,其凝聚能力最强的为
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,___________(填字母)效果最明显。
| A.BaCl2 | B.Al2(SO4)3 | C.KCl | D.CuSO4 |
甲:将FeCl3饱和溶液滴加到冷水中;
乙:将FeCl3饱和溶液滴加到NaOH溶液中;
丙:将FeCl3饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
①丙中反应的化学方程式为
②用最简单的方法判断丙中是否成功制备胶体,写出相关的操作、现象和结论
③可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。该方法名称为

您最近一年使用:0次
3 . 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:

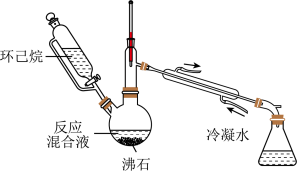
| A.以共沸体系带水促使反应正向进行 | B.反应时水浴温度需严格控制在69℃ |
| C.接收瓶中会出现分层现象 | D.根据带出水的体积可估算反应进度 |
您最近一年使用:0次
2023-06-14更新
|
8735次组卷
|
18卷引用:吉林省长春市第五中学2022-2023学年高一下学期期末考试化学试题
吉林省长春市第五中学2022-2023学年高一下学期期末考试化学试题2023年高考湖北卷化学真题(已下线)专题14 化学实验方案的设计与评价(已下线)T8-化学实验基础(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)T9-实验方案的设计与评价黑龙江省大庆实验中学实验三部2022-2023学年高二下学期期末考试化学试题福建省晋江市平山学校,泉州中远学校,晋江市内坑中学,晋江市磁灶中学,永春第二中学2022-2023学年高二下学期期末联考化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二下学期期末考试化学试题(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)第16讲物质的制备福建省龙岩市连城县第一中学2023-2024学年高三上学期8月月考化学试题江西省丰城中学2023-2024学年高二创新班上学期开学考试化学试题(已下线)考点3 物质的制备与性质实验 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第3讲 物质制备实验的设计与评价云南省宣威市第六中学2023-2024学年高二上学期12月月考化学试题(已下线)热点09 乙醇与乙酸安徽省六安第一中学2023-2024学年高二下学期期中考试化学试题
解题方法
4 . 1875年,法国化学家布瓦博德朗发现了门捷列夫预言的“类铝”,即新元素镓。金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。某学校化学兴趣小组在实验室利用如图装置模拟制备三氯化镓,同时使用该装置验证卤素单质氧化性的相对强弱。

已知:①三氯化镓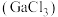 具有很强的吸湿性,在空气中吸收湿气而冒烟。
具有很强的吸湿性,在空气中吸收湿气而冒烟。
②在氯气流中加热镓可制备 ,反应方程式
,反应方程式 。
。
(1)镓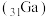 元素在周期表中的位置是
元素在周期表中的位置是___________ , 是共价化合物,其结构式为
是共价化合物,其结构式为___________ 。
(2)写出 与浓盐酸反应制取氯气的离子方程式:
与浓盐酸反应制取氯气的离子方程式:___________ 。
(3)装置B中的试剂为___________ ;装置C中试剂的作用是___________ 。
(4) 中装有
中装有 溶液,反应开始后能证明卤素单质氧化性相对强弱的现象为
溶液,反应开始后能证明卤素单质氧化性相对强弱的现象为___________ (只需写出一个现象即可)。
(5)装置 试管口内部放置湿润淀粉—
试管口内部放置湿润淀粉— 试纸的主要目的是
试纸的主要目的是___________ 。
(6)请推测写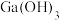 与
与 反应的化学方程式
反应的化学方程式___________ 。

已知:①三氯化镓
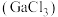 具有很强的吸湿性,在空气中吸收湿气而冒烟。
具有很强的吸湿性,在空气中吸收湿气而冒烟。②在氯气流中加热镓可制备
 ,反应方程式
,反应方程式 。
。(1)镓
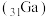 元素在周期表中的位置是
元素在周期表中的位置是 是共价化合物,其结构式为
是共价化合物,其结构式为(2)写出
 与浓盐酸反应制取氯气的离子方程式:
与浓盐酸反应制取氯气的离子方程式:(3)装置B中的试剂为
(4)
 中装有
中装有 溶液,反应开始后能证明卤素单质氧化性相对强弱的现象为
溶液,反应开始后能证明卤素单质氧化性相对强弱的现象为(5)装置
 试管口内部放置湿润淀粉—
试管口内部放置湿润淀粉— 试纸的主要目的是
试纸的主要目的是(6)请推测写
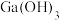 与
与 反应的化学方程式
反应的化学方程式
您最近一年使用:0次
名校
5 . 以 为原料制备氧钒(Ⅳ)碱式碳酸铵
为原料制备氧钒(Ⅳ)碱式碳酸铵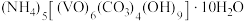 过程如下:
过程如下:
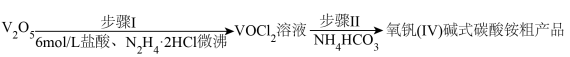
回答下列问题:
(1)步骤Ⅰ的反应装置如图(夹持及加热装置略去,下同)。

①仪器b的名称为_______ ,仪器c的作用为_______ 。
②步骤Ⅰ生成 的同时,生成一种无绝无污染的气体,该反应的化学方程式为
的同时,生成一种无绝无污染的气体,该反应的化学方程式为 _______ 。
(2)步骤Ⅱ可在下图装置中进行。

①接口的连接顺序为
_______ 。
②实验开始时,先关闭 ,打开K1,当
,打开K1,当_______ 时(写实验现象),再关闭K1,打开 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。
③C装置的作用是_______ 。
(3)测定产品纯度。称取 样品用稀硫酸溶解后,加入过量的
样品用稀硫酸溶解后,加入过量的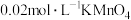 溶液,充分反应后加入过量的
溶液,充分反应后加入过量的 溶液,再加适量尿素除去
溶液,再加适量尿素除去 ,用
,用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为 。(已知:
。(已知: )
)
①样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为 )的质量分数为
)的质量分数为_______ 。
②配制 标准溶液需要用到下列操作:
标准溶液需要用到下列操作:
a.打开容量瓶玻璃塞,加入适量水,塞紧塞子,倒立
b.将塞子反转180°,倒立
c.洗涤烧杯内壁和玻璃棒2~3次
d.冷却至室温
e.轻轻振荡容量瓶
f.称取计算后的试样置于烧杯中,加入适量水充分溶解
g.将溶液转移到容量瓶中
h.定容,摇匀
上述给出操作的正确顺序:a→_______ →h(操作可重复)。
 为原料制备氧钒(Ⅳ)碱式碳酸铵
为原料制备氧钒(Ⅳ)碱式碳酸铵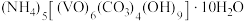 过程如下:
过程如下: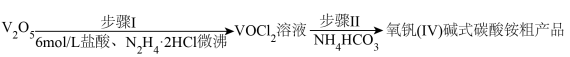
回答下列问题:
(1)步骤Ⅰ的反应装置如图(夹持及加热装置略去,下同)。

①仪器b的名称为
②步骤Ⅰ生成
 的同时,生成一种无绝无污染的气体,该反应的化学方程式为
的同时,生成一种无绝无污染的气体,该反应的化学方程式为 (2)步骤Ⅱ可在下图装置中进行。

①接口的连接顺序为

②实验开始时,先关闭
 ,打开K1,当
,打开K1,当 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。③C装置的作用是
(3)测定产品纯度。称取
 样品用稀硫酸溶解后,加入过量的
样品用稀硫酸溶解后,加入过量的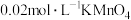 溶液,充分反应后加入过量的
溶液,充分反应后加入过量的 溶液,再加适量尿素除去
溶液,再加适量尿素除去 ,用
,用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为 。(已知:
。(已知: )
)①样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为
 )的质量分数为
)的质量分数为②配制
 标准溶液需要用到下列操作:
标准溶液需要用到下列操作:a.打开容量瓶玻璃塞,加入适量水,塞紧塞子,倒立
b.将塞子反转180°,倒立
c.洗涤烧杯内壁和玻璃棒2~3次
d.冷却至室温
e.轻轻振荡容量瓶
f.称取计算后的试样置于烧杯中,加入适量水充分溶解
g.将溶液转移到容量瓶中
h.定容,摇匀
上述给出操作的正确顺序:a→
您最近一年使用:0次
解题方法
6 . 铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
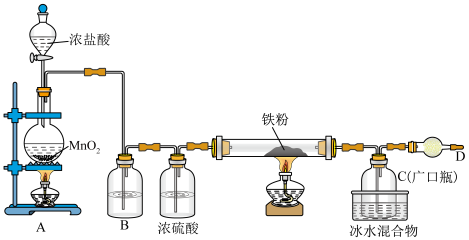
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是_______ 。
(2)A中发生反应的离子方程式为________________________________________ 。
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是_______ 。
(4)过量铁粉与氯气,加热条件下反应的化学方程式为__________________________ 。
(5)D中装的药品是碱石灰,其作用是___________________________________________ 。
(6)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于c(H+)低所致。
猜想②:是由于_______ 所致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想_______ 成立。
(7)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为_______ %(结果精确到小数点后两位)。

查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是
(2)A中发生反应的离子方程式为
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是
(4)过量铁粉与氯气,加热条件下反应的化学方程式为
(5)D中装的药品是碱石灰,其作用是
(6)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于c(H+)低所致。
猜想②:是由于
小组设计了以下实验方案进行验证:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
(7)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为
您最近一年使用:0次
7 . 用下列装置不能达到有关实验目的的是
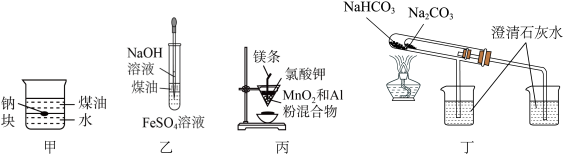

| A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水) |
| B.用乙图装置制备Fe(OH)2 |
| C.用丙图装置制取金属锰 |
| D.用丁图装置比较NaHCO3和Na2CO3的热稳定性 |
您最近一年使用:0次
2016-11-09更新
|
2128次组卷
|
26卷引用:吉林省长春市第二十九中学2021届高三上学期第二学程考试化学试题
吉林省长春市第二十九中学2021届高三上学期第二学程考试化学试题(已下线)2014届福建省福州市高三毕业班质检(第一次)理综化学试卷(已下线)2013-2014江西省南昌三中高二下学期期末考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2016届广东省东莞市六校高三上学期联考理综化学试卷12016届广东省东莞市六校高三上学期联考理综化学试卷22017届山东省济南一中高三上学期期中化学试卷苏教版2017届高三单元精练检测三化学试题苏教版2017届高三单元精练检测三化学试题陕西省黄陵中学高新部2018届高三上学期期中考试化学试题人教版2017届高三单元精练检测三化学试题福建省莆田第六中学2017-2018学年高二6月月考化学试题A【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题湖北省武汉市汉阳一中2018-2019学年高一上学期12月月考化学试题(已下线)2019年8月11日《每日一题》2020年高考一轮复习—— 每周一测重庆市八中2018-2019学年高二下学期期末考试化学试题山西大学附中2020届高三上学期第二次模块诊断化学试题湖南省长沙市长沙县第六中学2020届高三上学期第二次月考化学试题内蒙古包头市包钢第四中学2018-2019学年高二下学期期末考试化学试题四川省宜宾市第四中学校2019-2020学年高二下学期第四学月考试化学试题福建省福州市第二中学2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】高中化学20210621-019【2021】【高一下】黑龙江省牡丹江市第十五中学2020-2021学年高二下学期期末考试化学试题甘肃省武威市第六中学2020届高三上学期第三次阶段性复习过关考试化学试题山东省济南市深泉外国语学校2022-2023学年高一上学期期末考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期开学测验化学试题
名校
解题方法
8 . 铁及其化合物在生产,生活中有重要用途。某化学兴趣小组的同学设计了以下两个实验,请回答下列问题:
I.“铁与水反应”,并检验产物的性质。(夹持装置已略去)

(1)装置A中盛放碎瓷片的仪器的名称为_______ ,装置A的作用是_______ ;
(2)装置B中发生反应的化学方程式为_______ ;
(3)实验一段时间后,装置E中的实验现象为_______ ;
Ⅱ.制备Fe(OH)2。

已知:NaOH溶液是用去氧水配制的。
(4)仪器a使用之前需要采取的操作是_______ ,煤油的作用是_______ 。
(5)实验开始时的具体操作是_______ ,仪器b中产生均匀气泡后的操作是_______ 。
(6)设计实验检验仪器c中的金属离子:_______ 。
I.“铁与水反应”,并检验产物的性质。(夹持装置已略去)

(1)装置A中盛放碎瓷片的仪器的名称为
(2)装置B中发生反应的化学方程式为
(3)实验一段时间后,装置E中的实验现象为
Ⅱ.制备Fe(OH)2。

已知:NaOH溶液是用去氧水配制的。
(4)仪器a使用之前需要采取的操作是
(5)实验开始时的具体操作是
(6)设计实验检验仪器c中的金属离子:
您最近一年使用:0次
2024-01-11更新
|
227次组卷
|
2卷引用:吉林省白山市抚松县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
9 . 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,e、f、g均为含钠元素的正盐,请回答:
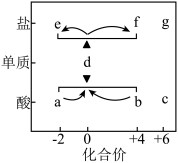
(1)当a溶液与b溶液混合时,可观察到的现象是___________ 。
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为___________ 。
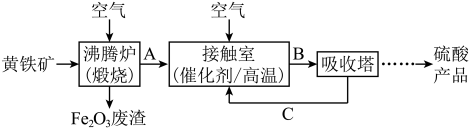
(3)工业上用黄铁矿( )为原料制备硫酸的流程如图所示,吸收塔中选择
)为原料制备硫酸的流程如图所示,吸收塔中选择___________ (填试剂名称)吸收 。
。
(4)将浓硫酸加入蔗糖中,有“黑面包”现象发生,该过程体现浓硫酸的性质是___________ 。
(5)煤和石油在燃烧过程中通常会产生 ,某同学利用下列装置测定空气中
,某同学利用下列装置测定空气中 的含量。
的含量。
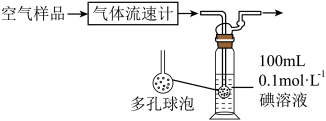
该装置中 与碘(
与碘( )溶液发生反应的化学方程式为:
)溶液发生反应的化学方程式为:___________ 。若空气流速为V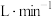 ,当
,当 与碘(
与碘( )溶液恰好完全反应时,耗时10min,则该空气样品中
)溶液恰好完全反应时,耗时10min,则该空气样品中 的含量是
的含量是___________  (用含V的最简表达式表示)。
(用含V的最简表达式表示)。

(1)当a溶液与b溶液混合时,可观察到的现象是
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为
(3)工业上用黄铁矿(
 )为原料制备硫酸的流程如图所示,吸收塔中选择
)为原料制备硫酸的流程如图所示,吸收塔中选择 。
。
(4)将浓硫酸加入蔗糖中,有“黑面包”现象发生,该过程体现浓硫酸的性质是
(5)煤和石油在燃烧过程中通常会产生
 ,某同学利用下列装置测定空气中
,某同学利用下列装置测定空气中 的含量。
的含量。
该装置中
 与碘(
与碘( )溶液发生反应的化学方程式为:
)溶液发生反应的化学方程式为: ,当
,当 与碘(
与碘( )溶液恰好完全反应时,耗时10min,则该空气样品中
)溶液恰好完全反应时,耗时10min,则该空气样品中 的含量是
的含量是 (用含V的最简表达式表示)。
(用含V的最简表达式表示)。
您最近一年使用:0次
2023-07-13更新
|
266次组卷
|
2卷引用:吉林省梅河口市第五中学2022-2023学年高一下学期期末期末考试化学试题
名校
解题方法
10 . 已知氯气与强碱溶液反应时,生成的产物受温度的影响。实验室中利用如图1装置(部分装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
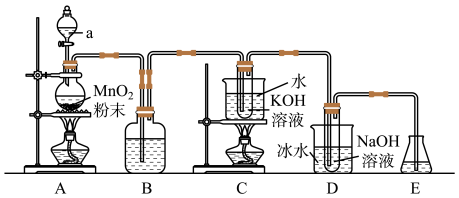
图1
回答下列问题:
(1)仪器a的名称是_______ 。
(2)装置A产生氯气的化学方程式为_______ 。
(3)装置B中的试剂为_______ ,该装置作用为_______ 。
(4)装置C采用的加热方式是_______ ,装置D中发生反应的离子方程式为_______ 。
(5)装置E的作用是_______ ,可选用试剂_______ 。(填标号)
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)
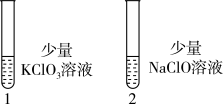
图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3_______ NaClO。(填“大于”或“小于”)
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式_______ 。

图1
回答下列问题:
(1)仪器a的名称是
(2)装置A产生氯气的化学方程式为
(3)装置B中的试剂为
(4)装置C采用的加热方式是
(5)装置E的作用是
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)

图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式
您最近一年使用:0次
2023-03-13更新
|
334次组卷
|
3卷引用:吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题
吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题(已下线)第08讲 氯气的实验室制法及氯离子的检验-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)四川省宜宾市叙州区第一中学校2023-2024学年高一上学期10月月考化学试题



