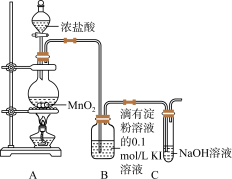
已知氯气与强碱溶液反应时,生成的产物受温度的影响。实验室中利用如图1装置(部分装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
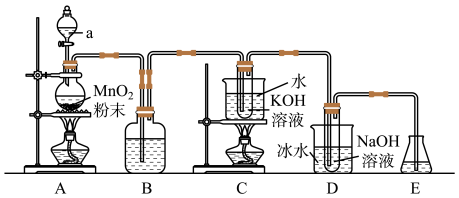
图1
回答下列问题:
(1)仪器a的名称是_______ 。
(2)装置A产生氯气的化学方程式为_______ 。
(3)装置B中的试剂为_______ ,该装置作用为_______ 。
(4)装置C采用的加热方式是_______ ,装置D中发生反应的离子方程式为_______ 。
(5)装置E的作用是_______ ,可选用试剂_______ 。(填标号)
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)
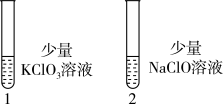
图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3_______ NaClO。(填“大于”或“小于”)
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式_______ 。

图1
回答下列问题:
(1)仪器a的名称是
(2)装置A产生氯气的化学方程式为
(3)装置B中的试剂为
(4)装置C采用的加热方式是
(5)装置E的作用是
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)

图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式
22-23高一上·吉林·期末 查看更多[3]
四川省宜宾市叙州区第一中学校2023-2024学年高一上学期10月月考化学试题(已下线)第08讲 氯气的实验室制法及氯离子的检验-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题
更新时间:2023-03-13 20:57:40
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】所示是实验室用 和浓盐酸反应制取
和浓盐酸反应制取 并净化和收集的装置。
并净化和收集的装置。

试回答以下问题:
(1)如何检验装置的气密性?___________________________________________________________ 。
(2)净化装置的顺序能否颠倒?为什么?_________________________________________________ 。
(3)用含 的浓盐酸与足量
的浓盐酸与足量 充分反应,制得的
充分反应,制得的 在标准状况下的总体积
在标准状况下的总体积_________ (填“大于”“小于”或“等于”)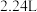 ,原因可能是①
,原因可能是①__________________________________________ ;②______________________________________________________________ 。
(4)根据4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O, , 16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O,知
, 16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O,知 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是__________________________________________ 。
 和浓盐酸反应制取
和浓盐酸反应制取 并净化和收集的装置。
并净化和收集的装置。
试回答以下问题:
(1)如何检验装置的气密性?
(2)净化装置的顺序能否颠倒?为什么?
(3)用含
 的浓盐酸与足量
的浓盐酸与足量 充分反应,制得的
充分反应,制得的 在标准状况下的总体积
在标准状况下的总体积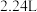 ,原因可能是①
,原因可能是①(4)根据4HCl(浓)+MnO2
 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O, , 16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O,知
, 16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O,知 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氯气是一种重要的化工原料,大量用于制造盐酸、漂白剂、农药、染料和药品等。
Ⅰ.为探究氯气与 溶液的反应,某课外小组用下图装置进行实验(夹持仪器已略去)
溶液的反应,某课外小组用下图装置进行实验(夹持仪器已略去)
(1)装置A中生成氯气的化学反应方程式为___________ 。
(2)装置C中 的作用是
的作用是___________ 。
(3)能证明氯气的氧化性强于碘的实验现象是___________ 。
(4)为探究B中溶液颜色变化的原因,小组同学查阅资料并进行实验。
查阅资料: 和
和 在溶液中会发生反应:
在溶液中会发生反应: ,
, 显棕黄色且遇淀粉变蓝;
显棕黄色且遇淀粉变蓝; 可被氯气氧化为
可被氯气氧化为 (红色)和
(红色)和 (黄色),两种离子可继续被氧化成
(黄色),两种离子可继续被氧化成 (无色)。
(无色)。
进行实验:
①操作Ⅰ的实验目的是___________ 。
②写出 在水溶液中与氯气反应生成
在水溶液中与氯气反应生成 的离子方程式
的离子方程式___________ 。
③由以上实验可推断 中溶液颜色变成浅棕色的原因是
中溶液颜色变成浅棕色的原因是___________ 。
Ⅱ.84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。某兴趣小组同学研究84消毒液的漂白性,实验如下。
;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。某兴趣小组同学研究84消毒液的漂白性,实验如下。
a.向 消毒液中加入
消毒液中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。
b.向 消毒液中加入
消毒液中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。
c.测得84消毒液在不同温度时ORP随时间的变化曲线如图。

(5)①已知白醋显酸性,不具有漂白性。实验a、b现象不同的原因是___________ 。
②由实验c可得出的结论是___________ 。
Ⅰ.为探究氯气与
 溶液的反应,某课外小组用下图装置进行实验(夹持仪器已略去)
溶液的反应,某课外小组用下图装置进行实验(夹持仪器已略去)
| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
(1)装置A中生成氯气的化学反应方程式为
(2)装置C中
 的作用是
的作用是(3)能证明氯气的氧化性强于碘的实验现象是
(4)为探究B中溶液颜色变化的原因,小组同学查阅资料并进行实验。
查阅资料:
 和
和 在溶液中会发生反应:
在溶液中会发生反应: ,
, 显棕黄色且遇淀粉变蓝;
显棕黄色且遇淀粉变蓝; 可被氯气氧化为
可被氯气氧化为 (红色)和
(红色)和 (黄色),两种离子可继续被氧化成
(黄色),两种离子可继续被氧化成 (无色)。
(无色)。进行实验:
| 实验操作 | 实验现象 |
Ⅰ.取反应后B中的溶液 分成两等份,第一份滴入1滴碘水;第二份滴入1滴淀粉溶液 分成两等份,第一份滴入1滴碘水;第二份滴入1滴淀粉溶液 | 第一份溶液变蓝色 第二份溶液颜色没有变化 |
Ⅱ.将 溶于 溶于 溶液中配制得碘总浓度为 溶液中配制得碘总浓度为 的溶液,取上述溶液 的溶液,取上述溶液 ,滴加1滴淀粉溶液,再通入氯气 ,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通入氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
②写出
 在水溶液中与氯气反应生成
在水溶液中与氯气反应生成 的离子方程式
的离子方程式③由以上实验可推断
 中溶液颜色变成浅棕色的原因是
中溶液颜色变成浅棕色的原因是Ⅱ.84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有
 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。某兴趣小组同学研究84消毒液的漂白性,实验如下。
;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。某兴趣小组同学研究84消毒液的漂白性,实验如下。a.向
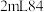 消毒液中加入
消毒液中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。b.向
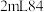 消毒液中加入
消毒液中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。c.测得84消毒液在不同温度时ORP随时间的变化曲线如图。

(5)①已知白醋显酸性,不具有漂白性。实验a、b现象不同的原因是
②由实验c可得出的结论是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】Ⅰ.钠是典型的金属元素,钠的化合物具有广泛的用途。请回答以下问题:
(1)15.6g 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中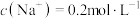 ,则X的摩尔质量为
,则X的摩尔质量为______ 。
(2) 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: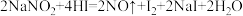 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为______ 。标况下,每生成11.2L的NO气体,转移的电子数约为______ 个。
(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO______  (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为______ (填字母序号)。
A. B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClO
Ⅱ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为______ 。
(5)流程中可循环利用的物质为______ (填化学式)。
(6)产品分析:把5.8g含有少量NaCl杂质的 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为______ (用百分数表示,保留到小数点后1位)。
(1)15.6g
 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中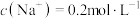 ,则X的摩尔质量为
,则X的摩尔质量为(2)
 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: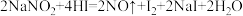 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为A.
 B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClOⅡ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为
(5)流程中可循环利用的物质为
(6)产品分析:把5.8g含有少量NaCl杂质的
 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氯气是一种重要的工业原料。某校化学实验兴趣小组同学设计了如下图所示的实验装置,利用如下原理探究氯气的某些性质。实验开始一段时间后,观察到D中溶液变为蓝色。

(1)A中产生现象是①___________ ,甲同学认为是 与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式②
与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式②___________ 、③___________ ,乙同学则认为A中的现象不足以说明白色沉淀是 与水反应产生新物质的结果,理由是④
与水反应产生新物质的结果,理由是④___________ 。
(2)B和C中出现的不同现象可得出的结论是___________ 。
(3)E是尾气吸收装置,写出其中发生的反应方程式:___________ ;若吸收了标准状况下的22.4mL氯气,则该过程中转移的电子个数为___________ 。

(1)A中产生现象是①
 与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式②
与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式② 与水反应产生新物质的结果,理由是④
与水反应产生新物质的结果,理由是④(2)B和C中出现的不同现象可得出的结论是
(3)E是尾气吸收装置,写出其中发生的反应方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某同学利用如图实验装置制备少量的漂白粉。回答下列问题:___________ (填化学式);
(2)仪器a的名称是___________ 。装置A为实验室制取氯气的装置,其发生反应的离子方程式为___________ ;
(3)装置B中反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生Ca(ClO3)2,该副反应的化学方程式为___________ ;
(4)装置C中发生反应的化学方程式为___________ ;
(5)用化学方程式表示漂白粉的漂白原理___________ 。
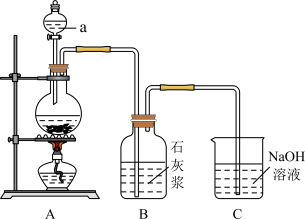
(2)仪器a的名称是
(3)装置B中反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生Ca(ClO3)2,该副反应的化学方程式为
(4)装置C中发生反应的化学方程式为
(5)用化学方程式表示漂白粉的漂白原理
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.某同学设计如图所示装置探究氯气能否与水发生反应。气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:


(1)气体a由右图甲或乙制备 ,若选用图中的甲装置,反应的离子方程式是_____ ,若选用装置乙,其中的导管 a 的作用是_____ 。
(2)证明氯气和水发生反应的实验现象为_____________ 。
(3)该实验设计存在缺陷,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_________________ 。
II.如图为浓硫酸与铜反应及其产物检验的实验装置

回答下列问题:
(1)指出试管c中产生的实验现象:______________________ 。
(2) 用可抽动的铜丝代替铜片的优点___________ 。
(3)写出浓硫酸与铜反应的化学方程式:_____________________________ 。


(1)气体a由右图甲或乙制备 ,若选用图中的甲装置,反应的离子方程式是
(2)证明氯气和水发生反应的实验现象为
(3)该实验设计存在缺陷,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为
II.如图为浓硫酸与铜反应及其产物检验的实验装置

回答下列问题:
(1)指出试管c中产生的实验现象:
(2) 用可抽动的铜丝代替铜片的优点
(3)写出浓硫酸与铜反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
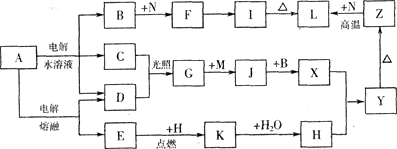
(1)工业上,在电解A溶液的设备中将阴极区和阳极区用________ 隔开。(填设备名称)
(2)写出A的水溶液电解的离子方程式_______________________________________ 。
(3)写出K与CO2反应的化学方程式_________________________________________ 。
(4)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,写出该反应的离子方程式_________________________________________________________ 。
(5)一定量的Z与N的混合物分为两等分,一份直接与足量氢氧化钠溶液产生气体为amol,另一份高温下充分反应(不考虑固体与氧气的反应)后的固体混合物与足量盐酸产生气体为bmol,现有a:b=9:7,则混合物中Z与N的物质的量之比为____________ 。

(1)工业上,在电解A溶液的设备中将阴极区和阳极区用
(2)写出A的水溶液电解的离子方程式
(3)写出K与CO2反应的化学方程式
(4)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,写出该反应的离子方程式
(5)一定量的Z与N的混合物分为两等分,一份直接与足量氢氧化钠溶液产生气体为amol,另一份高温下充分反应(不考虑固体与氧气的反应)后的固体混合物与足量盐酸产生气体为bmol,现有a:b=9:7,则混合物中Z与N的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以在常温下利用反应:
制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是_______ ,该装置相比普通分液漏斗的优点是_______ 。
(2)装置B的作用是_______ ,装置C中盛装的药品是_______ 。
(3)D装置收集氯气采用了方法_______。(填序号)
(4)装置E中发生反应的化学方程式是_______ 。
(5)工业上制备氯气通常利用反应_______ (填化学方程式),阴极的产物是_______ 。

制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是
(2)装置B的作用是
(3)D装置收集氯气采用了方法_______。(填序号)
| A.向下排空气法 | B.向上排空气法 | C.排水法 | D.排饱和食盐水 |
(5)工业上制备氯气通常利用反应
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】已知物质A~I之间的转化关系符合下图所示。其中A、C、F、G、I为常见固体且焰色反应均为黄色;A为海水中主要溶质,B为常温下常见液体;E为黄绿色气体,H是无色无味且能使澄清石灰水变浑浊的气体。

试回答下列问题:
(1)写出下列物质的化学式:D______________ H______________
(2)反应①的化学方程式为:_______________________________ 。
(3)反应②的化学方程式为:_______________________________ 。

试回答下列问题:
(1)写出下列物质的化学式:D
(2)反应①的化学方程式为:
(3)反应②的化学方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。

(1)连接上述仪器的正确顺序(填各接口处的字母):E接________ ;__________ 接__________ ;________ 接________ ;__________ 接F。
(2)装置中,饱和食盐水的作用是_____________________________________ ;浓硫酸的作用是________________________________________________ 。
(3)化学实验中检验是否有Cl2产生的常用方法是_________________________ 。
(4)写出下列反应的化学方程式:
①气体发生装置中的反应:_____________________________________ 。
②NaOH溶液中发生的反应:________________________________________ 。
(5)工业上用氯气制取漂白粉的化学反应方程式为__________________ ,漂白粉用于漂白、杀菌的原理用化学方程式表示为____________________ 。

(1)连接上述仪器的正确顺序(填各接口处的字母):E接
(2)装置中,饱和食盐水的作用是
(3)化学实验中检验是否有Cl2产生的常用方法是
(4)写出下列反应的化学方程式:
①气体发生装置中的反应:
②NaOH溶液中发生的反应:
(5)工业上用氯气制取漂白粉的化学反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某研究小组制备氯气并对产生氯气的条件进行探究。
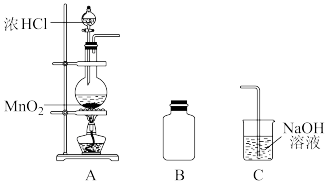
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的____ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是____ 。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向____ 。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____ 。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是____ 。
②Ⅱ中发生了分解反应,反应的化学方程式是____ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
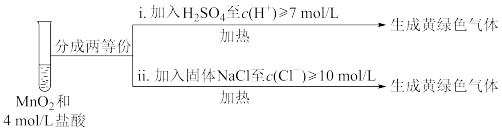
将实验Ⅲ、Ⅳ作对比,得出的结论是____ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质可能是
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
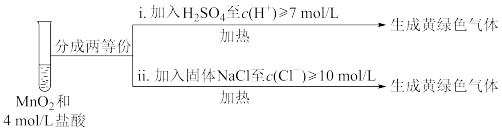
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以在常温下利用反应:
制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是_______ ,该装置相比普通分液漏斗的优点是_______ 。
(2)装置B的作用是_______ ,装置C中盛装的药品是_______ 。
(3)D装置收集氯气采用了方法_______。(填序号)
(4)装置E中发生反应的化学方程式是_______ 。
(5)工业上制备氯气通常利用反应_______ (填化学方程式),阴极的产物是_______ 。

制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是
(2)装置B的作用是
(3)D装置收集氯气采用了方法_______。(填序号)
| A.向下排空气法 | B.向上排空气法 | C.排水法 | D.排饱和食盐水 |
(5)工业上制备氯气通常利用反应
您最近一年使用:0次



