1 . 双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: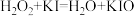 ;
;
反应②: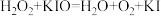 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。
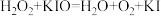
4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为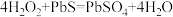 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入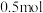 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
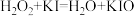 ;
;反应②:
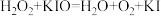 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.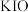 | D. |
A.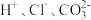 | B.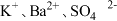 |
C. | D.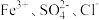 |
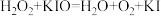
4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为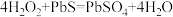 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入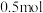 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.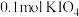 | B.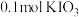 | C.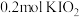 | D.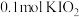 |
您最近一年使用:0次
2 . 草酸亚铁是一种被广泛使用的化工原料,可用于染料、涂料、陶瓷、玻璃器皿等的着色剂、新型感光材料的生产,也是合成纳米磁性材料、超级电容器的多孔材料及锂离子电池磷酸铁锂正极材料所需的主要原材料。
实验室制备草酸亚铁并测定其中Fe2+和 的物质的量之比确定其纯度,步骤如下:
的物质的量之比确定其纯度,步骤如下:
I.称取一定质量的硫酸亚铁铵[(NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取mgI中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热,用cmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液V1mL(其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用cmo1/LKMnO4溶液滴定滤液至终点,消耗KMnO4溶液V2mL。
Ⅳ.重复上述实验3次,计算。
已知:①草酸有较强还原性。②pH>4时,Fe2+易被O2氧化。③酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
回答下列问题:
1.0.1mol/L(NH4)2Fe(SO4)2、(NH4)2SO4、NH4Cl和NH4HCO3溶液中, 浓度关系为_____(单选)。
浓度关系为_____(单选)。
2.Ⅰ中加入稀硫酸的目的是_____ 。
3.Ⅱ中与KMnO4溶液反应的微粒是_____ 。
4.配平Ⅲ中反应的离子方程式:_____ 。
_____Fe2++_____ +_____H+=_____Fe3++_____Mn2++_H2O
+_____H+=_____Fe3++_____Mn2++_H2O
5.Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V,比较大小V_____ V2(单选)。
A.= B.< C.>
6.在标有“20℃,25mL”的滴定管内装液至刻度“0”时,管内液体的体积_____(单选)
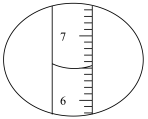
7.图分别是量筒和滴定管的两个液面。下列有关读数正确的是_____(单选)

8.Ⅲ中滴定时,当_____ 即为滴定终点。
9.写出Fe2+离子结构示意图_____ 。
10.mgI中制得的晶体中,Fe2+和 的物质的量之比是
的物质的量之比是_____ (用含V1、V2的计算式表示)。提示:5 +2
+2 +16H+=10CO2↑+2Mn2++8H2O
+16H+=10CO2↑+2Mn2++8H2O
实验室制备草酸亚铁并测定其中Fe2+和
 的物质的量之比确定其纯度,步骤如下:
的物质的量之比确定其纯度,步骤如下:I.称取一定质量的硫酸亚铁铵[(NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取mgI中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热,用cmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液V1mL(其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用cmo1/LKMnO4溶液滴定滤液至终点,消耗KMnO4溶液V2mL。
Ⅳ.重复上述实验3次,计算。
已知:①草酸有较强还原性。②pH>4时,Fe2+易被O2氧化。③酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
回答下列问题:
1.0.1mol/L(NH4)2Fe(SO4)2、(NH4)2SO4、NH4Cl和NH4HCO3溶液中,
 浓度关系为_____(单选)。
浓度关系为_____(单选)。| A.(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl>NH4HCO3 |
| B.(NH4)2SO4>(NH4)2Fe(SO4)2>NH4Cl>NH4HCO3 |
| C.((NH4)2Fe(SO4)2=(NH4)2SO4>NH4Cl>NH4HCO3 |
| D.(NH4)2SO4>(NH4)2Fe(SO4)2>NH4HCO3>NH4Cl |
3.Ⅱ中与KMnO4溶液反应的微粒是
4.配平Ⅲ中反应的离子方程式:
_____Fe2++_____
 +_____H+=_____Fe3++_____Mn2++_H2O
+_____H+=_____Fe3++_____Mn2++_H2O5.Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V,比较大小V
A.= B.< C.>
6.在标有“20℃,25mL”的滴定管内装液至刻度“0”时,管内液体的体积_____(单选)
| A.等于25mL | B.大于25mL | C.小于25mL | D.无法确定 |


| A.量筒读数是6.5mL,滴定管读数是15.5mL |
| B.量筒读数是7.5mL,滴定管读数是16.50mL |
| C.量筒读数是6.5mL,滴定管读数是15.50mL |
| D.量筒读数是6.5mL,滴定管读数是16.50mL |
9.写出Fe2+离子结构示意图
10.mgI中制得的晶体中,Fe2+和
 的物质的量之比是
的物质的量之比是 +2
+2 +16H+=10CO2↑+2Mn2++8H2O
+16H+=10CO2↑+2Mn2++8H2O
您最近一年使用:0次
名校
3 . A、B、C、D、E为常见的主族元素,根据下表信息回答问题。
(1)写出元素A的原子结构示意图___________ 。
(2)A、B最高价氧化物对应水化物的碱性强弱:___________ >___________ (填化学式),从原子结构角度解释原因___________ 。
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式________________ 。
(4)用电子式表示C和D形成化合物的过程:_______________ 。
(5)元素E在周期表中的位置___________ ,关于元素E及其化合物的推断中,正确的是___________ 。
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)___________ ,原因是________________ 。
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为___________ ,任意写出一个能体现②的类别通性的反应方程式_____________ 。
(8)第四周期ⅥA族的元素硒 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)___________ 。
a.硒原子的半径比硫原子的大 b. 的稳定性比HCl的强
的稳定性比HCl的强
c. 能与NaOH溶液反应 d.
能与NaOH溶液反应 d.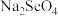 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
| 元素 | 元素性质/原子结构信息 |
| A | 短周期元素原子半径最大(稀有气体不参与比较) |
| B | +3价阳离子的核外电子排布与氖原子相同 |
| C | 原子核外M电子层与K电子层的电子数相等 |
| D | 与A同周期,化合价有-1、+7等 |
| E | 原子结构示意图: |
(1)写出元素A的原子结构示意图
(2)A、B最高价氧化物对应水化物的碱性强弱:
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式
(4)用电子式表示C和D形成化合物的过程:
(5)元素E在周期表中的位置
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为
(8)第四周期ⅥA族的元素硒
 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)a.硒原子的半径比硫原子的大 b.
 的稳定性比HCl的强
的稳定性比HCl的强c.
 能与NaOH溶液反应 d.
能与NaOH溶液反应 d.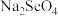 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
您最近一年使用:0次
名校
4 . 若两种化合物为 ,向溶于水所得溶液中通入足量的
,向溶于水所得溶液中通入足量的 气体,随
气体,随 的通入生成的沉淀质量如图所示:
的通入生成的沉淀质量如图所示: 通入
通入 混合溶液,反应分多个阶段,
混合溶液,反应分多个阶段,
① 阶段的离子反应方程式:
阶段的离子反应方程式:___________ 、___________ 。
②从离子反应发生条件角度说明 段反应先于
段反应先于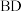 反应的理由:
反应的理由:___________ 。
2.随着 的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。
的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。
3.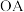 段和
段和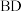 段消耗
段消耗 用量的关系:___________(用
用量的关系:___________(用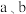 和c表示)。
和c表示)。
 ,向溶于水所得溶液中通入足量的
,向溶于水所得溶液中通入足量的 气体,随
气体,随 的通入生成的沉淀质量如图所示:
的通入生成的沉淀质量如图所示:
 通入
通入 混合溶液,反应分多个阶段,
混合溶液,反应分多个阶段,①
 阶段的离子反应方程式:
阶段的离子反应方程式:②从离子反应发生条件角度说明
 段反应先于
段反应先于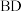 反应的理由:
反应的理由:2.随着
 的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。
的通入,混合溶液的导电性会发生一些变化,导电性:O点___________B点。| A.> | B.= | C.< | D.无法确定 |
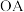 段和
段和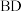 段消耗
段消耗 用量的关系:___________(用
用量的关系:___________(用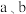 和c表示)。
和c表示)。A.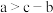 | B. | C.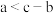 | D.无法确定 |
您最近一年使用:0次
名校
解题方法
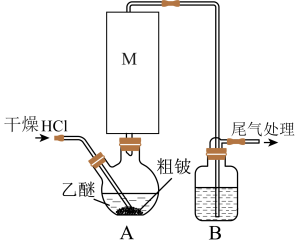
5 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④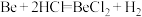 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用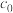 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸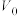 mL(已知:
mL(已知: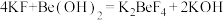 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含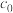 、
、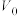 和
和 的字母表示)。
的字母表示)。
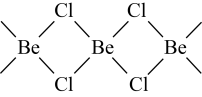
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
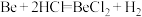 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用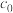 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸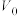 mL(已知:
mL(已知: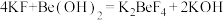 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为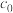 、
、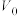 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次
6 . 2023年9月23日第19届亚运会在我国杭州正式开幕。开幕式主火炬首次使用了零碳甲醇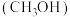 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应 ;
;
反应ii: 。
。
1.反应体系中存在反应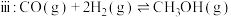 ,则
,则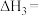
_______  。
。
将 和
和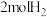 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: 点
点 的体积分数为
的体积分数为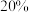 ,则
,则 的转化率为
的转化率为_______ 。(计算结果保留三位有效数字)。
3. 轴上
轴上 点的数值比
点的数值比 点
点_______ (填“大”或“小”)。
在不同压强下,按照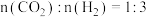 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和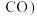 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: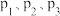 由大到小的顺序为_______。
由大到小的顺序为_______。
5.曲线_______ (填“ ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。
6.在 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数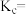
_______ (填含 的表达式)。
的表达式)。
光催化 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。_______ 。
8.太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成_______ (填写微粒名称)参与 的还原再生。
的还原再生。
9.请至少从2方面写出光催化CO2制备甲醇与原方法的优劣比较:_______ 。
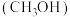 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:反应
 ;
;反应ii:
 。
。1.反应体系中存在反应
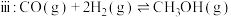 ,则
,则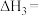
 。
。将
 和
和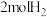 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示:
 点
点 的体积分数为
的体积分数为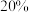 ,则
,则 的转化率为
的转化率为3.
 轴上
轴上 点的数值比
点的数值比 点
点在不同压强下,按照
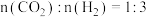 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和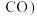 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: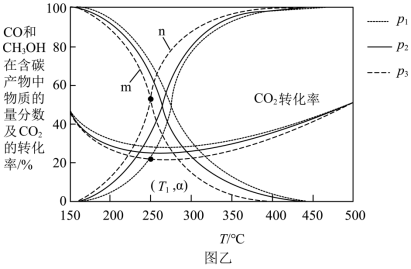
 由大到小的顺序为_______。
由大到小的顺序为_______。A.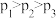 | B.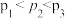 | C. | D. |
 ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。6.在
 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数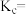
 的表达式)。
的表达式)。光催化
 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
8.太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成
 的还原再生。
的还原再生。9.请至少从2方面写出光催化CO2制备甲醇与原方法的优劣比较:
您最近一年使用:0次
名校
解题方法
7 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: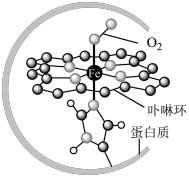
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
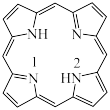
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。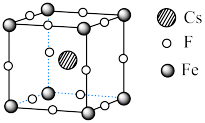
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
2024-05-11更新
|
324次组卷
|
3卷引用:期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)
(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题天津市耀华中学2024届高三下学期第二次模拟化学试题
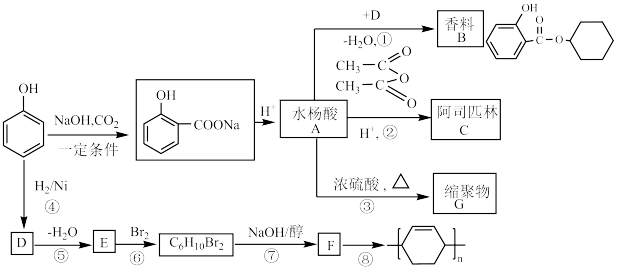
8 . 苯酚是生产某些树脂、杀菌剂、防腐制以及药物(如阿司匹林)的重要原料。通过如图所示流程可合成香料B、阿司匹林和一些高分子化合物。
1.水杨酸A的分子式为___________ 。阿司匹林C中官能团的名称为___________ 。F中σ键和π键的个数比为___________ 。
2.能说明羟基对苯环有影响的事实是
3.苯酚与Fe(III)盐溶液的显色反应原理可表示为
4.①和⑦的反应类型分别是___________ 、___________ 。
5.写出阿司匹林C在酸性条件下水解生成水杨酸A的化学方程式___________ 。
6.写出G的结构简式:___________ 。
7.写出1种满足下列条件的D的同分异构体的结构简式:___________ 。
①核磁共振氢谱显示有三组峰;
②能发生银镜反应。
8.写出由 制备丁烯二酸酐
制备丁烯二酸酐 的合成路线(其他无机试剂任选)
的合成路线(其他无机试剂任选) ___________ 。
已知: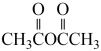 +CH3OH→CH3COCH3+CH3COOH
+CH3OH→CH3COCH3+CH3COOH
1.水杨酸A的分子式为
2.能说明羟基对苯环有影响的事实是
| A.室温时苯酚不易溶解于水 | B.苯酚的水溶液具有酸性 |
| C.苯酚能与浓溴水迅速反应 | D.液态苯酚能与钠反应放出氢气 |
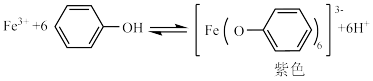
A.苯酚的电离方程式是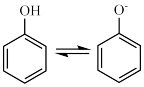 +H+ +H+ |
| B.紫色物质中Fe3+的配位数是6 |
| C.向苯酚与FeCl3混合溶液中滴加盐酸,溶液颜色变深 |
| D.可用FeCl3溶液鉴别苯酚和水杨酸 |
5.写出阿司匹林C在酸性条件下水解生成水杨酸A的化学方程式
6.写出G的结构简式:
7.写出1种满足下列条件的D的同分异构体的结构简式:
①核磁共振氢谱显示有三组峰;
②能发生银镜反应。
8.写出由
 制备丁烯二酸酐
制备丁烯二酸酐 的合成路线(其他无机试剂任选)
的合成路线(其他无机试剂任选)
您最近一年使用:0次
9 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.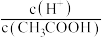 C.
C.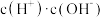 D.
D. E.
E. 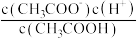
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
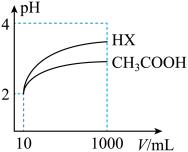
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
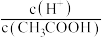 C.
C.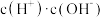 D.
D. E.
E. 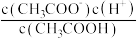
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
您最近一年使用:0次
解题方法
10 . 二氧化碲(TeO2)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为Cu2Te,还含有少量Cu,Ag)为原料制备TeO2并获得海绵铜的工艺流程如图所示。
(1)Te位于元素周期表的___________ 族。
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为___________ ,为了加快反应速率,不可以采取的措施为___________ (写字母)
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:______ 。
□Ag+□H++□ =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。
③若使用稀硝酸代替NaClO3,不足之处可能是___________ 。
(3)“碱浸提碲”时,TeO2反应的化学方程式为___________ ,浸渣b的主要成分为___________ 。
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为___________ 。
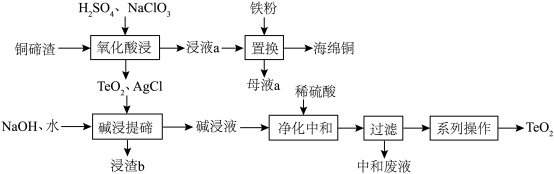
(1)Te位于元素周期表的
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:
□Ag+□H++□
 =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。③若使用稀硝酸代替NaClO3,不足之处可能是
(3)“碱浸提碲”时,TeO2反应的化学方程式为
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为
您最近一年使用:0次