研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.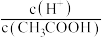 C.
C.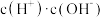 D.
D. E.
E. 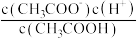
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
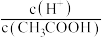 C.
C.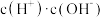 D.
D. E.
E. 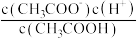
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
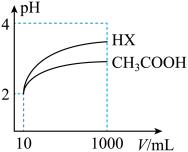
23-24高二下·广东东莞·阶段练习 查看更多[2]
更新时间:2024-05-06 10:25:19
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有32个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
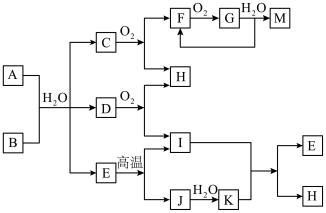
(1)写出B的电子式_____________
(2)写出下列反应的离子方程式:
①在A溶液中加入M__________________________________________
②向A溶液中加入过量NaOH溶液,并加热_______________________
(3)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式:_________
(4)写出A与B反应的化学方程式_________________________________ 。

(1)写出B的电子式
(2)写出下列反应的离子方程式:
①在A溶液中加入M
②向A溶液中加入过量NaOH溶液,并加热
(3)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式:
(4)写出A与B反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】回答下列问题。
Ⅰ.已知 晶体易溶于水,它溶于水时,电离出三种不同的离子,电离方程式为:
晶体易溶于水,它溶于水时,电离出三种不同的离子,电离方程式为: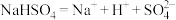 ,因此
,因此 溶液显酸性。
溶液显酸性。
(1)下列关于 的说法中错误的是
的说法中错误的是___________ 。
A. 为酸式盐,也为硫酸盐
为酸式盐,也为硫酸盐
B. 溶液能与锌反应产生
溶液能与锌反应产生
C. 固体中阳离子和阴离子的个数比是2∶1
固体中阳离子和阴离子的个数比是2∶1
D. 溶液的导电性一定强于
溶液的导电性一定强于 溶液
溶液
E. 在熔融状态下电离方程式
在熔融状态下电离方程式
F. 在水溶液或者熔融状态下都能导电,
在水溶液或者熔融状态下都能导电, 为电解质
为电解质
(2)向 溶液中滴加
溶液中滴加 溶液,反应的离子方程式为
溶液,反应的离子方程式为___________ 。
(3)离子方程式 ,它可能表示
,它可能表示___________ 。
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与硫酸氢钠溶液反应
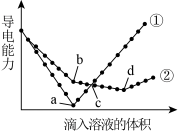
(4)在两份相同的 溶液中,分别滴入
溶液中,分别滴入 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是___________。
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是___________。
Ⅱ.A、B、C、D、E五瓶透明溶液分别是 溶液、
溶液、 溶液、HCl溶液、
溶液、HCl溶液、 溶液、
溶液、 溶液中的一种。已知:
溶液中的一种。已知:
①A与D反应有气体生成,②A与E反应有沉淀生成,
③B与E反应有沉淀生成,④B与C反应有沉淀生成,
⑤C与D反应有气体生成,⑥在②和③的反应中生成的沉淀是同一种物质。
请回答下列问题:
(5)B与E反应的离子方程式为___________ ,C与D反应产生气体的离子方程式为___________ 。
(6)向一定量的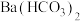 溶液中逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为
溶液中逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为___________ 。
Ⅰ.已知
 晶体易溶于水,它溶于水时,电离出三种不同的离子,电离方程式为:
晶体易溶于水,它溶于水时,电离出三种不同的离子,电离方程式为: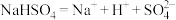 ,因此
,因此 溶液显酸性。
溶液显酸性。(1)下列关于
 的说法中错误的是
的说法中错误的是A.
 为酸式盐,也为硫酸盐
为酸式盐,也为硫酸盐B.
 溶液能与锌反应产生
溶液能与锌反应产生
C.
 固体中阳离子和阴离子的个数比是2∶1
固体中阳离子和阴离子的个数比是2∶1D.
 溶液的导电性一定强于
溶液的导电性一定强于 溶液
溶液E.
 在熔融状态下电离方程式
在熔融状态下电离方程式
F.
 在水溶液或者熔融状态下都能导电,
在水溶液或者熔融状态下都能导电, 为电解质
为电解质(2)向
 溶液中滴加
溶液中滴加 溶液,反应的离子方程式为
溶液,反应的离子方程式为(3)离子方程式
 ,它可能表示
,它可能表示①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与硫酸氢钠溶液反应
(4)在两份相同的
 溶液中,分别滴入
溶液中,分别滴入 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是___________。
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是___________。
A.b点溶液大量存在的离子是 、 、 、 、 |
B.bd段发生的离子方程式 |
C.c点,两溶液中含有相同量的 |
| D.a、d两点对应的溶液均显中性 |
Ⅱ.A、B、C、D、E五瓶透明溶液分别是
 溶液、
溶液、 溶液、HCl溶液、
溶液、HCl溶液、 溶液、
溶液、 溶液中的一种。已知:
溶液中的一种。已知:①A与D反应有气体生成,②A与E反应有沉淀生成,
③B与E反应有沉淀生成,④B与C反应有沉淀生成,
⑤C与D反应有气体生成,⑥在②和③的反应中生成的沉淀是同一种物质。
请回答下列问题:
(5)B与E反应的离子方程式为
(6)向一定量的
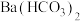 溶液中逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为
溶液中逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某实验小组设计以下装置欲制取 并验证其性质,实验过程中,发现Y形管中
并验证其性质,实验过程中,发现Y形管中 与浓
与浓 反应的现象与预期现象不同,对此进行探究。
反应的现象与预期现象不同,对此进行探究。
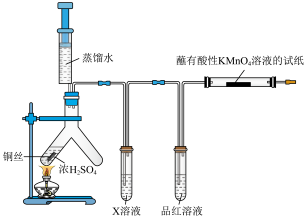
观察到Y形管中实验现象是:有大量气体产生,溶液逐渐变为墨绿色浊液,试管底部开始有灰白色沉淀生成:继续加热,试管中产生“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多。
查阅资料知:
①温度越高,浓 氧化性越强;浓硫酸沸点为
氧化性越强;浓硫酸沸点为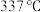 ;
;
②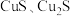 不溶于稀盐酸,能溶于浓盐酸,
不溶于稀盐酸,能溶于浓盐酸, 能溶于稀盐酸和氨水:
能溶于稀盐酸和氨水: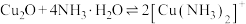 (极浅蓝色)
(极浅蓝色) ;
; 呈深蓝色;
呈深蓝色;
③工业用铜丝表面覆盖有一层聚氯乙烯薄膜,聚氯乙烯在加热条件下易分解放出 气体;
气体;
④ 呈蓝色,
呈蓝色, 离子呈黄绿色,二者存在转化:
离子呈黄绿色,二者存在转化: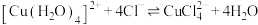
回答下列问题:
(1)试管中X溶液可除去“白雾”中含有的硫酸酸雾,则X是___________ 溶液。
(2)写出 与酸性
与酸性 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
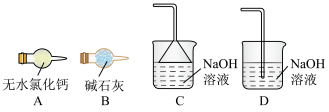
(3)下图所示的装置中,可以选择___________ 进行尾气处理。
(4)取反应初始阶段的墨绿色溶液,倒入盛有蒸馏水的烧杯中,溶液由墨绿色变为蓝色,结合资料分析,实验开始时混合液呈墨绿色是由___________ 和___________ (填离子符号)引起的。
(5)实验结束后,将Y形管中液体倒入右支管,左管中用注射器加入蒸馏水洗涤灰白色沉淀,取出沉淀后用蒸馏水多次洗涤,干燥,得到沉淀物试样,设计如下实验:
②中实验得出的结论是固体中可能含有___________ (写化学式)
(6)用离子方程式表示实验③颜色变化的原因___________ 。
 并验证其性质,实验过程中,发现Y形管中
并验证其性质,实验过程中,发现Y形管中 与浓
与浓 反应的现象与预期现象不同,对此进行探究。
反应的现象与预期现象不同,对此进行探究。
观察到Y形管中实验现象是:有大量气体产生,溶液逐渐变为墨绿色浊液,试管底部开始有灰白色沉淀生成:继续加热,试管中产生“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多。
查阅资料知:
①温度越高,浓
 氧化性越强;浓硫酸沸点为
氧化性越强;浓硫酸沸点为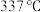 ;
;②
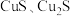 不溶于稀盐酸,能溶于浓盐酸,
不溶于稀盐酸,能溶于浓盐酸, 能溶于稀盐酸和氨水:
能溶于稀盐酸和氨水: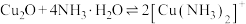 (极浅蓝色)
(极浅蓝色) ;
; 呈深蓝色;
呈深蓝色;③工业用铜丝表面覆盖有一层聚氯乙烯薄膜,聚氯乙烯在加热条件下易分解放出
 气体;
气体;④
 呈蓝色,
呈蓝色, 离子呈黄绿色,二者存在转化:
离子呈黄绿色,二者存在转化: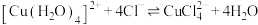
回答下列问题:
(1)试管中X溶液可除去“白雾”中含有的硫酸酸雾,则X是
(2)写出
 与酸性
与酸性 溶液反应的离子方程式
溶液反应的离子方程式(3)下图所示的装置中,可以选择

(4)取反应初始阶段的墨绿色溶液,倒入盛有蒸馏水的烧杯中,溶液由墨绿色变为蓝色,结合资料分析,实验开始时混合液呈墨绿色是由
(5)实验结束后,将Y形管中液体倒入右支管,左管中用注射器加入蒸馏水洗涤灰白色沉淀,取出沉淀后用蒸馏水多次洗涤,干燥,得到沉淀物试样,设计如下实验:
| 组别 | 实验方案 | 实验现象 | 实验结论 |
| ① | 取少量试样,滴加适量浓硝酸 | 沉淀溶解,产生红棕色气体 | 可能含有 、 、 、 、 、S等 、S等 |
| ② | 试管a:取少量试样,滴加适量稀盐酸,加热试管b:取少量试样,滴加适量浓盐酸,加热 | 试管a:沉淀不溶解试管b:沉淀完全溶解 | 可能含有_________ |
| ③ | 取少量试样,滴加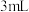 氨水,观察现象,在空气中放置一段时间,观察现象 氨水,观察现象,在空气中放置一段时间,观察现象 | 开始溶液呈极浅蓝色,久置后逐渐加深至深蓝色 | 含有 |
(6)用离子方程式表示实验③颜色变化的原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】氧化铋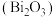 俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋(
俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋( )为原料转型脱氯制备氧化铋的方法如下:
)为原料转型脱氯制备氧化铋的方法如下:
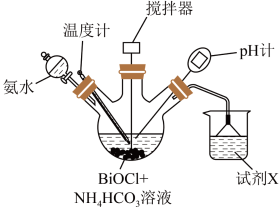
步骤1:准确称取 ,先与
,先与 脱氯剂
脱氯剂 溶液混合,加入氨水至
溶液混合,加入氨水至 下搅拌
下搅拌 可得前驱体(
可得前驱体( (难溶于水),反应装置如图所示(加热装置已略去);
(难溶于水),反应装置如图所示(加热装置已略去);
步骤2:将前驱体干燥后灼烧,可得 。
。
回答下列问题:
(1) 的原子序数为83,则
的原子序数为83,则 位于元素周期表第
位于元素周期表第_____ 周期,第_____ 族。
(2)试剂 的作用为
的作用为_____ 。
(3)步骤1中生成(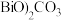 的化学方程式为
的化学方程式为_____ 。
(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2-3次,将滤液和洗涤液合并,稀释至 ,取
,取 于锥形瓶中,滴入2滴
于锥形瓶中,滴入2滴 溶液作指示剂,再用
溶液作指示剂,再用 标准
标准 溶液滴定,平行测定三组。
溶液滴定,平行测定三组。
①分离前驱体的操作名称是_____ ;盛装标准 溶液应选用
溶液应选用_____ (填“酸式”或“碱式”)滴定管。
②若消耗 标准液的平均体积为
标准液的平均体积为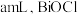 的摩尔质量为
的摩尔质量为 ,则脱氯率为
,则脱氯率为_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(5)灼烧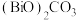 时用到的硅酸盐制品有
时用到的硅酸盐制品有_____ 、_____ 、酒精灯、玻璃棒,发生反应的化学方程式为_____ 。
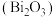 俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋(
俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋( )为原料转型脱氯制备氧化铋的方法如下:
)为原料转型脱氯制备氧化铋的方法如下:步骤1:准确称取
 ,先与
,先与 脱氯剂
脱氯剂 溶液混合,加入氨水至
溶液混合,加入氨水至 下搅拌
下搅拌 可得前驱体(
可得前驱体( (难溶于水),反应装置如图所示(加热装置已略去);
(难溶于水),反应装置如图所示(加热装置已略去);
步骤2:将前驱体干燥后灼烧,可得
 。
。回答下列问题:
(1)
 的原子序数为83,则
的原子序数为83,则 位于元素周期表第
位于元素周期表第(2)试剂
 的作用为
的作用为(3)步骤1中生成(
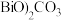 的化学方程式为
的化学方程式为(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2-3次,将滤液和洗涤液合并,稀释至
 ,取
,取 于锥形瓶中,滴入2滴
于锥形瓶中,滴入2滴 溶液作指示剂,再用
溶液作指示剂,再用 标准
标准 溶液滴定,平行测定三组。
溶液滴定,平行测定三组。①分离前驱体的操作名称是
 溶液应选用
溶液应选用②若消耗
 标准液的平均体积为
标准液的平均体积为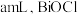 的摩尔质量为
的摩尔质量为 ,则脱氯率为
,则脱氯率为 (用含
(用含 的代数式表示)。
的代数式表示)。(5)灼烧
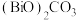 时用到的硅酸盐制品有
时用到的硅酸盐制品有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH CO+ H2O (快)
CO+ H2O (快)
Ⅱ.HCOOH CO2+H2 (慢)
CO2+H2 (慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1)反应Ⅰ正反应速率方程为:v =kc(H+)c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka。当HCOOH平衡浓度为x mol/L时,H+浓度为___________ mol/L,此时反应Ⅰ正反反应速率v=___________ mol/(L·h)(用含 Ka、x和k的代数式表示)。
(2)T2温度下,在密封石英管内完全充满1.0 mol/LHCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70mol/L、0.16 mol/L,反应Ⅱ达平衡时,测得H2的浓度为ymol/L。体系达平衡后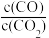 =
=___________ (用含y的代数式表示,下同),反应Ⅱ的平衡常数为___________ 。

相同条件下,若反应起始时溶液中同时还含有0.10 mol/L盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是___________ (填标号)。与不含盐酸相比,CO达浓度峰值时,CO2浓度___________ (填“增大”“减小”或“不变”)。 的值
的值___________ (填“增大”“减小”或“不变”)。
 CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:Ⅰ.HCOOH
 CO+ H2O (快)
CO+ H2O (快)Ⅱ.HCOOH
 CO2+H2 (慢)
CO2+H2 (慢)研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1)反应Ⅰ正反应速率方程为:v =kc(H+)c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka。当HCOOH平衡浓度为x mol/L时,H+浓度为
(2)T2温度下,在密封石英管内完全充满1.0 mol/LHCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70mol/L、0.16 mol/L,反应Ⅱ达平衡时,测得H2的浓度为ymol/L。体系达平衡后
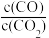 =
=
相同条件下,若反应起始时溶液中同时还含有0.10 mol/L盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是
 的值
的值
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】硫及其化合物的转化是资源利用和环境保护的重要研究课题,回答下列问题:
Ⅰ.若在绝热、恒容的密闭容器中通入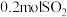 和
和 ,发生反应
,发生反应
 ,一段时间内,正反应速率随时间的变化曲线如图所示。
,一段时间内,正反应速率随时间的变化曲线如图所示。
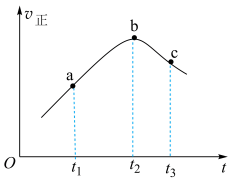
(1)混合气体的密度:a___________ (填“>”、“<”或“=”,下同)c,混合气体的平均摩尔质量:a___________ c。
(2)b点时,
___________ (用分式表示)。
(3)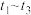 内,
内, 先增大后减小的主要原因为
先增大后减小的主要原因为___________ 。
Ⅱ.常温下,氢硫酸( 的水溶液)的电离方程式可表示为
的水溶液)的电离方程式可表示为 和
和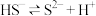 。现将氢硫酸与氢氧化钠溶液混合。已知:
。现将氢硫酸与氢氧化钠溶液混合。已知: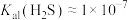 ,
, 。
。
(4)对于反应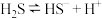 ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为___________ 。
(5)若将等体积、等浓度的氢硫酸与氢氧化钠溶液混合,发生反应的化学方程式:___________ 。
(6)常温下,当混合后溶液中的 时,该溶液的pH约为
时,该溶液的pH约为___________ [已知: ,
, ]。
]。
Ⅰ.若在绝热、恒容的密闭容器中通入
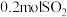 和
和 ,发生反应
,发生反应
 ,一段时间内,正反应速率随时间的变化曲线如图所示。
,一段时间内,正反应速率随时间的变化曲线如图所示。
(1)混合气体的密度:a
(2)b点时,

(3)
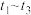 内,
内, 先增大后减小的主要原因为
先增大后减小的主要原因为Ⅱ.常温下,氢硫酸(
 的水溶液)的电离方程式可表示为
的水溶液)的电离方程式可表示为 和
和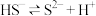 。现将氢硫酸与氢氧化钠溶液混合。已知:
。现将氢硫酸与氢氧化钠溶液混合。已知: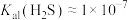 ,
, 。
。(4)对于反应
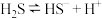 ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为(5)若将等体积、等浓度的氢硫酸与氢氧化钠溶液混合,发生反应的化学方程式:
(6)常温下,当混合后溶液中的
 时,该溶液的pH约为
时,该溶液的pH约为 ,
, ]。
]。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol
再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol
则Q1、Q2、Q3、Q4的数学关系式是___________________________________ ;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=_______ ,该步电离的电离度α=______ (已知:10-5.6=2.5×10-6,保留一位小数);
②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3)_____ c(CO32-)(填“>”“=”或“<”),原因是__________________________________________________ ;(用离子方程式和必要的文字说明);
③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
(1)下列事实中,能证明碳酸是弱酸的是
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol
再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol
则Q1、Q2、Q3、Q4的数学关系式是
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3)
③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】(1)已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述溶液加水稀释至1000 mL,溶液pH数值范围为_______ ,溶液中
_______ (填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=_______ 。用pH试纸测定该氨水pH的操作方法为_______ 。
③25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的电离平衡常数约为_______ 。
(2)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。
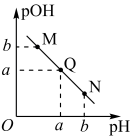
①图中M、Q、N三点所示溶液中水的电离程度最大的点是_______ (填字母)。
②N点溶液加水稀释,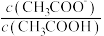 的值
的值_______ (填变大、变小、不变)
(3)在pH=3的NH4Al(SO4)2溶液中,由水电离出来的c(H+)=_______ mol·L-1,pH值相同的NH4Al(SO4)2中的c(NH )
)_______ (填“=”“>”“<”) NH4HSO4中的c(NH )
)
(4)将等浓度CH3COOH和CH3COONa按2:3的体积比混合,混合溶液中存在等式:2c(CH3COO-)-3c(CH3COOH)=_______ (用c(H+)和c(OH-)表示)
①将上述溶液加水稀释至1000 mL,溶液pH数值范围为

②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=
③25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的电离平衡常数约为
(2)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。

①图中M、Q、N三点所示溶液中水的电离程度最大的点是
②N点溶液加水稀释,
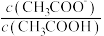 的值
的值(3)在pH=3的NH4Al(SO4)2溶液中,由水电离出来的c(H+)=
 )
) )
)(4)将等浓度CH3COOH和CH3COONa按2:3的体积比混合,混合溶液中存在等式:2c(CH3COO-)-3c(CH3COOH)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
①N2(g)+O2(g) ⇌2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g) ⇌ 2NO2(g) △H=+68 kJ/mol
则2NO(g)+O2(g) ⇌2NO2(g) △H=_____ kJ/mol
(2)对于反应2NO(g)+O2(g) ⇌ 2NO2(g)的反应历程如下:
第一步:2NO(g)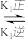 N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g) 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1正·c2(NO),υ 逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是_____
a.整个反应的速率由第一步反应速率决定
b.同一温度下,平衡时第一步反应的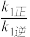 越大,反应正向程度越大
越大,反应正向程度越大
c.第二步反应速率慢,因而平衡转化率也低
d.第二步反应的活化能比第一步反应的活化能高
(3)将氨气与二氧化碳在有催化剂的反应器中反应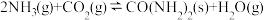 △H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
△H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
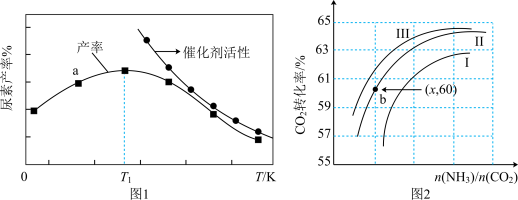
①a点_____ (填是或不是)处于平衡状态,T1之后尿素产率下降的原因可能是 _____________ 。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比 、水碳比
、水碳比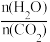 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____ ,测得b点氨的转化率为30%,则x=______________ 。
(4)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O⇌N2H5++OH- K1=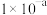 ;N2H5++H2O⇌N2H62++OH - K2=
;N2H5++H2O⇌N2H62++OH - K2=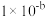 ;
;
①25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+ )>c(N2H4 ),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________ (用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为__________ 。
(1)已知汽车气缸中氮及其化合物发生如下反应:
①N2(g)+O2(g) ⇌2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g) ⇌ 2NO2(g) △H=+68 kJ/mol
则2NO(g)+O2(g) ⇌2NO2(g) △H=
(2)对于反应2NO(g)+O2(g) ⇌ 2NO2(g)的反应历程如下:
第一步:2NO(g)
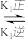 N2O2(g)(快速平衡)
N2O2(g)(快速平衡)第二步:N2O2(g)+O2(g)
 2NO(g)(慢反应)
2NO(g)(慢反应)其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1正·c2(NO),υ 逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是
a.整个反应的速率由第一步反应速率决定
b.同一温度下,平衡时第一步反应的
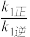 越大,反应正向程度越大
越大,反应正向程度越大c.第二步反应速率慢,因而平衡转化率也低
d.第二步反应的活化能比第一步反应的活化能高
(3)将氨气与二氧化碳在有催化剂的反应器中反应
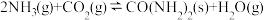 △H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
△H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
①a点
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比
 、水碳比
、水碳比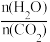 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是(4)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O⇌N2H5++OH- K1=
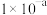 ;N2H5++H2O⇌N2H62++OH - K2=
;N2H5++H2O⇌N2H62++OH - K2=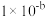 ;
;①25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+ )>c(N2H4 ),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为
您最近一年使用:0次



