名校
1 . 工业上采用Si与HCl在350℃左右反应生成 ,之后将其还原、结晶得到高纯度的单晶硅产品。已知
,之后将其还原、结晶得到高纯度的单晶硅产品。已知 的熔点为-128℃,沸点为33℃,且遇
的熔点为-128℃,沸点为33℃,且遇 和
和 均剧烈反应。现要在实验室中制取少量
均剧烈反应。现要在实验室中制取少量 ,其实验装置如下图所示,则下列说法正确的是
,其实验装置如下图所示,则下列说法正确的是
 ,之后将其还原、结晶得到高纯度的单晶硅产品。已知
,之后将其还原、结晶得到高纯度的单晶硅产品。已知 的熔点为-128℃,沸点为33℃,且遇
的熔点为-128℃,沸点为33℃,且遇 和
和 均剧烈反应。现要在实验室中制取少量
均剧烈反应。现要在实验室中制取少量 ,其实验装置如下图所示,则下列说法正确的是
,其实验装置如下图所示,则下列说法正确的是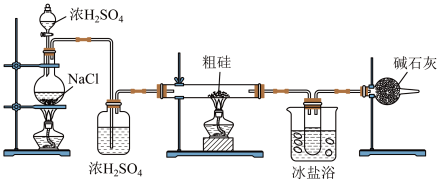
| A.反应时,应该先点燃“粗硅”处的酒精灯 |
B.冰盐浴的目的为降低收集容器的温度,使 冷凝为液体 冷凝为液体 |
C.可以用无水 替换干燥管中的碱石灰 替换干燥管中的碱石灰 |
D.使用浓 和NaCl混合加热制取HCl利用了浓 和NaCl混合加热制取HCl利用了浓 的脱水性和强酸性 的脱水性和强酸性 |
您最近一年使用:0次
2 . X、Y、Z、W为原子序数依次增大的四种元素, 和
和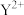 具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是
具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是
 和
和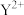 具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是
具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是| A.Z的最高价氧化物的熔点高于Y的最高价氧化物的熔点 |
| B.W和Y的氢化物所属的晶体类型分别为分子晶体和离子晶体 |
| C.基态X原子的核外电子有8种不同的空间运动状态 |
D.工业上常采用电解熔融化合物 的方式制备单质Y 的方式制备单质Y |
您最近一年使用:0次
3 . 某实验小组在探究铵盐的性质时进行了如下实验:
下列说法不正确的是
实验操作 | 实验现象 | |
实验① | 取少量 固体放入试管中,将试管固定在铁架台上(试管口略向下倾斜),将湿润的 固体放入试管中,将试管固定在铁架台上(试管口略向下倾斜),将湿润的 试纸置于试管口附近,对试管底部进行加热 试纸置于试管口附近,对试管底部进行加热 | 试纸颜色变化:黄色 蓝色 蓝色  黄色 黄色 红色 红色 ;试管中部有固体附着 ;试管中部有固体附着 |
实验② | 将饱和 溶液滴在 溶液滴在 试纸上 试纸上 | 试纸颜色变化:黄色 橙黄色 橙黄色 |
A.实验①中试纸变蓝说明 固体发生了分解 固体发生了分解 |
B.实验①中 试纸变红是由于扩散出来的 试纸变红是由于扩散出来的 与 与 反应生成 反应生成 |
C.根据实验①可得: 的扩散速率比 的扩散速率比 快 快 |
D.该实验说明不宜通过加热 固体制备 固体制备 |
您最近一年使用:0次
4 . 如图所示为一些晶体的结构,下列说法错误的是

A.在 晶体中,距 晶体中,距 最近的 最近的 形成正八面体 形成正八面体 |
B.在 晶体中,每个晶胞平均含有4个 晶体中,每个晶胞平均含有4个 |
| C.冰晶体中每个水分子与另外四个水分子形成四面体结构 |
D.该气态团簇分子的分子式为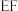 |
您最近一年使用:0次
名校
解题方法
5 . 近年来,我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
I.甲基胺离子导向的钙钛矿类杂化材料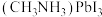 ,该物质因具有较高的光电转换效率而在太阳能电池领域具有重要的应用价值。
,该物质因具有较高的光电转换效率而在太阳能电池领域具有重要的应用价值。
(1)C、N基态原子中,第一电离能较大的是_______ 。
(2) 的电子式为
的电子式为_______ , 中存在
中存在_______ (填标号)。
a. 键 b.
键 b. 键 c.配位键 d.氢键
键 c.配位键 d.氢键
(3)已知甲基的供电子能力强于氢原子,则 、
、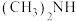 中接受质子能力较强的是
中接受质子能力较强的是_______ 。
II.硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为该晶胞沿z轴方向在xy平面的投影,已知晶胞边长为apm,阿伏加德罗常数的值为 。
。_______ (s、p、d、ds)区。
(5)基态Se原子核外电子有_______ 种不同空间运动状态。
(6)A点原子的分数坐标为 ,则B点原子的分数坐标为
,则B点原子的分数坐标为_______ 。
(7)该晶体密度为_______  (用含a和
(用含a和 的代数式表示)。
的代数式表示)。
I.甲基胺离子导向的钙钛矿类杂化材料
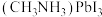 ,该物质因具有较高的光电转换效率而在太阳能电池领域具有重要的应用价值。
,该物质因具有较高的光电转换效率而在太阳能电池领域具有重要的应用价值。(1)C、N基态原子中,第一电离能较大的是
(2)
 的电子式为
的电子式为 中存在
中存在a.
 键 b.
键 b. 键 c.配位键 d.氢键
键 c.配位键 d.氢键(3)已知甲基的供电子能力强于氢原子,则
 、
、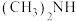 中接受质子能力较强的是
中接受质子能力较强的是II.硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为该晶胞沿z轴方向在xy平面的投影,已知晶胞边长为apm,阿伏加德罗常数的值为
 。
。
(5)基态Se原子核外电子有
(6)A点原子的分数坐标为
 ,则B点原子的分数坐标为
,则B点原子的分数坐标为(7)该晶体密度为
 (用含a和
(用含a和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
6 . 减少 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。
在 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:
反应i:
 kJ/mol
kJ/mol
反应ii:
 kJ/mol
kJ/mol
(1)反应iii: 的
的
___________ 。
(2)在 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]
①反应i的平衡常数
___________ (写出计算式即可)。
②反应ii的净速率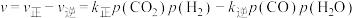 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,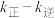
___________ (填“增大”“减小”或“不变”)。
③其他条件相同时,反应温度对 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是___________ 。 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:___________ 。
(4)利用如图所示原理去除NO:___________ ,每产生224 mL  (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为___________ mol。
 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。在
 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:反应i:

 kJ/mol
kJ/mol反应ii:

 kJ/mol
kJ/mol(1)反应iii:
 的
的
(2)在
 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。| A.若在绝热恒容容器,反应i的平衡常数K保持不变,说明反应i、ii都已达平衡 |
| B.若气体的平均相对分子质量不变,说明反应i、ii都已达平衡 |
| C.体系达平衡后,若压缩体积,反应i平衡正向移动,反应i平衡不移动 |
| D.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol
 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]①反应i的平衡常数

②反应ii的净速率
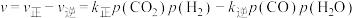 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,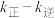
③其他条件相同时,反应温度对
 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是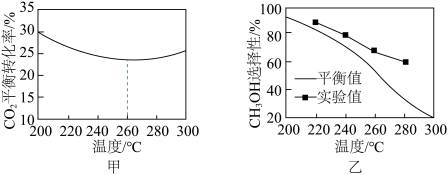
 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:(4)利用如图所示原理去除NO:
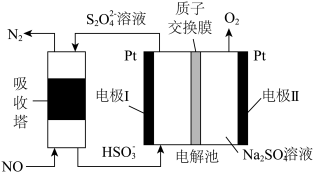
 (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为
您最近一年使用:0次
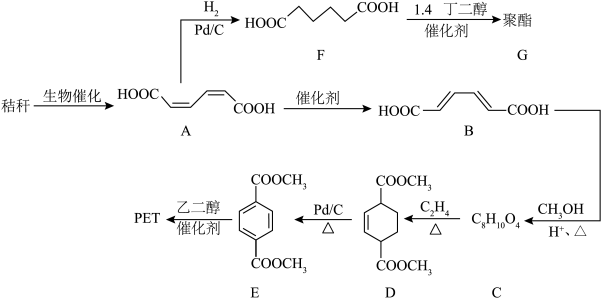
7 . 秸秆(含多糖类物质)的综合利用具有重要意义。以秸秆为原料合成聚酯类高分子的路线如图。
(1)下列有关A的说法正确的是___________ (填标号)。
a.无顺反异构体 b.实验式为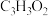
c.不能发生氧化反应 d.能与金属Na、NaOH和 反应
反应
(2)B中所含官能团的名称为___________ ,0.1molB最多可与___________ L(标准状况下) 发生加成反应。
发生加成反应。
(3)C→D的反应类型为___________ 。
(4)乙二醇的结构简式为___________ 。
(5)F→G的反应方程式为___________ 。
(6)J是E的同分异构体,符合下列条件的J的结构有___________ 种(不考虑立体异构)。
①不含 ;
;
②除苯环外不含其他环;
③能与 发生反应且0.1molJ最多可消耗0.2mol
发生反应且0.1molJ最多可消耗0.2mol 。
。
其中核磁共振氢谱显示只有三组峰且峰面积之比为1∶2∶2的结构简式为___________ 。
(7)结合所学知识并参考上述合成路线,设计仅以 为碳源合成
为碳源合成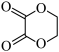 的路线
的路线___________ (无机试剂任选)。
(1)下列有关A的说法正确的是
a.无顺反异构体 b.实验式为
c.不能发生氧化反应 d.能与金属Na、NaOH和
 反应
反应(2)B中所含官能团的名称为
 发生加成反应。
发生加成反应。(3)C→D的反应类型为
(4)乙二醇的结构简式为
(5)F→G的反应方程式为
(6)J是E的同分异构体,符合下列条件的J的结构有
①不含
 ;
;②除苯环外不含其他环;
③能与
 发生反应且0.1molJ最多可消耗0.2mol
发生反应且0.1molJ最多可消耗0.2mol 。
。其中核磁共振氢谱显示只有三组峰且峰面积之比为1∶2∶2的结构简式为
(7)结合所学知识并参考上述合成路线,设计仅以
 为碳源合成
为碳源合成 的路线
的路线
您最近一年使用:0次
解题方法
8 . 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要元素,也是重要的非金属元素。回答下列问题:
(1)基态磷原子的价层电子排布式为___________ 。
(2)N和P同主族:
①酸性:
___________ (填“>”或“<”) 。
。
② 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
③ 与水反应的化学方程式为
与水反应的化学方程式为___________ 。
(3)将磷酸加强热可发生分子间脱水反应生成焦磷酸(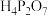 ,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是
,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是___________ 。 为阿伏加德罗常数的值,磷化硼晶体的密度为
为阿伏加德罗常数的值,磷化硼晶体的密度为 。
。___________ (用含 、
、 的代数式表示)cm。
的代数式表示)cm。
②估测该晶体的熔点___________ (填“高于”或“低于”)石墨。
③a原子的参数坐标为___________ 。
(1)基态磷原子的价层电子排布式为
(2)N和P同主族:
①酸性:

 。
。②
 的VSEPR模型名称为
的VSEPR模型名称为③
 与水反应的化学方程式为
与水反应的化学方程式为(3)将磷酸加强热可发生分子间脱水反应生成焦磷酸(
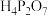 ,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是
,结构如图所示)、连三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是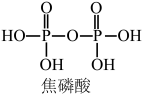
 为阿伏加德罗常数的值,磷化硼晶体的密度为
为阿伏加德罗常数的值,磷化硼晶体的密度为 。
。
 、
、 的代数式表示)cm。
的代数式表示)cm。②估测该晶体的熔点
③a原子的参数坐标为
您最近一年使用:0次
解题方法
9 . 叶绿素铜钠是国家食品安全允许使用的食品添加剂,医疗领域叶绿素铜钠能止血、抗炎、促进伤口愈合。某实验小组利用茭白叶,在实验室制备叶绿素铜钠,反应原理如下:
Ⅰ.称取洗净剪碎的茭白叶10.0g(叶绿素含量为17.84%),加入少量石英砂、碳酸钙粉末,研磨。
Ⅱ.加入10mL96%乙醇继续研磨成均匀浆状,微波加热6min后抽滤。滤渣加入10mL96%乙醇,再次微波加热、浸提、抽滤,将两次滤液合并。
Ⅲ.滤液装入三颈烧瓶,加入硫酸酸化至pH=5,加入硫酸铜晶体,搅拌至硫酸铜晶体溶解后,再加入盐酸调节溶液pH至2~3,搅拌加热半小时以上。
Ⅳ.冷却后向混合物中加入适量蒸馏水,静置后过滤、洗涤、干燥,得到叶绿素铜。
Ⅴ.……
Ⅵ.将叶绿素铜酸放入烧杯中,保温80℃,逐滴加入2%氢氧化钠溶液至pH为10,过滤,滤液经操作X,烘干即得成品1.026g。
已知:
1.茭白叶研磨过程中会释放有机酸,有机酸产生的氢离子会代替叶绿素中的镁离子,使叶绿素变质。
2.
回答下列问题:
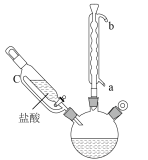
(1)仪器C的名称是___________ ,冷却水应从___________ (填“a”或“b”)口流出。
(2)步骤Ⅰ加入碳酸钙粉末的主要作用是___________ 。
(3)步骤Ⅲ中加入硫酸酸化至pH=5的目的是___________ (结合离子方程式和化学平衡移动原理说明)。
(4)步骤Ⅳ向混合物中加入适量蒸馏水的目的是___________ 。
(5)步骤Ⅴ的操作为:将叶绿素铜与50%乙醇混合,加入___________ (填标号,下同)溶液,加热15min,再加入___________ 溶液,加热至有墨绿色物质浮起,过滤、洗涤、干燥,得到叶绿素铜酸。
A.稀 B.稀
B.稀 C.NaOH D.KOH
C.NaOH D.KOH
(6)步骤Ⅵ中操作X的名称为___________ 。
(7)本实验的产率为___________ 。

Ⅰ.称取洗净剪碎的茭白叶10.0g(叶绿素含量为17.84%),加入少量石英砂、碳酸钙粉末,研磨。
Ⅱ.加入10mL96%乙醇继续研磨成均匀浆状,微波加热6min后抽滤。滤渣加入10mL96%乙醇,再次微波加热、浸提、抽滤,将两次滤液合并。
Ⅲ.滤液装入三颈烧瓶,加入硫酸酸化至pH=5,加入硫酸铜晶体,搅拌至硫酸铜晶体溶解后,再加入盐酸调节溶液pH至2~3,搅拌加热半小时以上。
Ⅳ.冷却后向混合物中加入适量蒸馏水,静置后过滤、洗涤、干燥,得到叶绿素铜。
Ⅴ.……
Ⅵ.将叶绿素铜酸放入烧杯中,保温80℃,逐滴加入2%氢氧化钠溶液至pH为10,过滤,滤液经操作X,烘干即得成品1.026g。
已知:
1.茭白叶研磨过程中会释放有机酸,有机酸产生的氢离子会代替叶绿素中的镁离子,使叶绿素变质。
2.
| 物质 | 相对分子质量 | 部分性质 |
| 叶绿素 | 892 | 蓝绿色固体,不溶于水,易溶于有机溶剂,对热不稳定,最佳提取温度约为80℃ |
| 叶绿素铜 | 932 | 绿色固体,不溶于水和50%乙醇 |
| 叶绿素铜酸 | 640 | 墨绿色固体,不溶于水 |
| 叶绿素铜钠 | 684 | 墨绿色固体,易溶于水,水溶液透明,受热较稳定 |
(1)仪器C的名称是
(2)步骤Ⅰ加入碳酸钙粉末的主要作用是
(3)步骤Ⅲ中加入硫酸酸化至pH=5的目的是
(4)步骤Ⅳ向混合物中加入适量蒸馏水的目的是
(5)步骤Ⅴ的操作为:将叶绿素铜与50%乙醇混合,加入
A.稀
 B.稀
B.稀 C.NaOH D.KOH
C.NaOH D.KOH(6)步骤Ⅵ中操作X的名称为
(7)本实验的产率为
您最近一年使用:0次
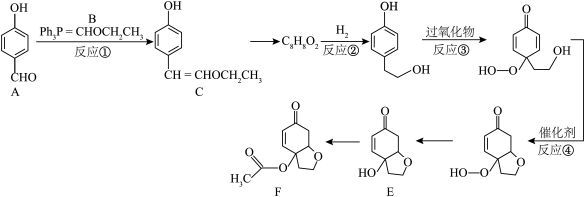
10 . 以化合物A为原料合成一种具有抗疟活性物质E及其衍生物F的路线如图所示(部分反应条件省略,Ph表示苯基):___________ 。
(2)反应①除产物C外,另一产物的分子式为___________ 。
(3)②和③的反应类型分别为___________ 、___________ 。
(4)E分子中手性碳原子有___________ 个,1 mol F最多加成___________ mol  。
。
(5)化合物E发生消去反应的产物中,同时满足如下条件的同分异构体有___________ 种;
a.属于芳香族化合物;
b.能与 溶液发生显色反应;
溶液发生显色反应;
c.能发生银镜反应。
其中,核磁共振氢谱有五组峰且峰面积之比为1∶2∶2∶2∶1的结构简式为___________ 。
(6)根据上述信息,写出以对甲基苯酚及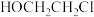 为原料合成
为原料合成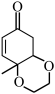 的路线(无机试剂任选)。
的路线(无机试剂任选)。___________
已知: 。
。
(2)反应①除产物C外,另一产物的分子式为
(3)②和③的反应类型分别为
(4)E分子中手性碳原子有
 。
。(5)化合物E发生消去反应的产物中,同时满足如下条件的同分异构体有
a.属于芳香族化合物;
b.能与
 溶液发生显色反应;
溶液发生显色反应;c.能发生银镜反应。
其中,核磁共振氢谱有五组峰且峰面积之比为1∶2∶2∶2∶1的结构简式为
(6)根据上述信息,写出以对甲基苯酚及
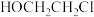 为原料合成
为原料合成 的路线(无机试剂任选)。
的路线(无机试剂任选)。
您最近一年使用:0次



