1 . N、S元素化合物知识在高中化学体系中占有重要地位,请根据题意回答下列问题。
(1)工业制硝酸中NH3的催化氧化化学方程式_______ 。
(2)检验溶液中含有NH4+的离子方程式_______ ,实验室一般使用_______ 检验该反应有氨气生成。
(3)向蔗糖中滴加浓硫酸,蔗糖变黑并膨胀,散发刺激性气味,说明浓硫酸具有_______ 和_______ 。(填浓硫酸的性质)
(4)铜与浓硫酸的化学反应方程式为_______ 。
(5)请用方程式解释实验室盛放碱液的试剂瓶不用玻璃塞的原因_______ 。
(1)工业制硝酸中NH3的催化氧化化学方程式
(2)检验溶液中含有NH4+的离子方程式
(3)向蔗糖中滴加浓硫酸,蔗糖变黑并膨胀,散发刺激性气味,说明浓硫酸具有
(4)铜与浓硫酸的化学反应方程式为
(5)请用方程式解释实验室盛放碱液的试剂瓶不用玻璃塞的原因
您最近一年使用:0次
名校
2 . 能源的开发、利用与人类社会息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
(1)下列列举的能源中属于新能源的是_______ (填标号)。
a.煤炭 b.氢能 c.风能 d.地热能 e.太阳能 f.天然气
(2) 与
与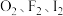 均能发生反应。
均能发生反应。
① 在
在 中燃烧生成水的过程中,能量转化的主要形式为
中燃烧生成水的过程中,能量转化的主要形式为_______ 转化为_______ 。
② 与
与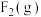 反应生成
反应生成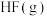 过程中的能量变化示意图如图1。
过程中的能量变化示意图如图1。 中的化学键需要
中的化学键需要_______ (填“吸收”或“放出”)的能量为_______  ;形成
;形成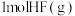 中的化学键需要
中的化学键需要_______ (填“吸收”或“放出”)的能量为_______  。
。
③ 与
与 反应生成
反应生成 过程中的能量变化示意图如图2。
过程中的能量变化示意图如图2。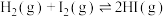 的正向反应为
的正向反应为_______ (填“吸热”或“放热”)反应;当反应 中有
中有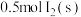 完全转化为
完全转化为 时,
时,_______ (填“吸收”或“放出”)的能量为_______  。
。
(1)下列列举的能源中属于新能源的是
a.煤炭 b.氢能 c.风能 d.地热能 e.太阳能 f.天然气
(2)
 与
与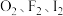 均能发生反应。
均能发生反应。①
 在
在 中燃烧生成水的过程中,能量转化的主要形式为
中燃烧生成水的过程中,能量转化的主要形式为②
 与
与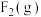 反应生成
反应生成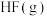 过程中的能量变化示意图如图1。
过程中的能量变化示意图如图1。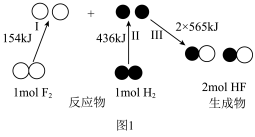
 中的化学键需要
中的化学键需要 ;形成
;形成 中的化学键需要
中的化学键需要 。
。③
 与
与 反应生成
反应生成 过程中的能量变化示意图如图2。
过程中的能量变化示意图如图2。
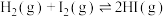 的正向反应为
的正向反应为 中有
中有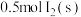 完全转化为
完全转化为 时,
时, 。
。
您最近一年使用:0次
3 . 硫的氧化物、氮的氧化物、硅的氧化物都是重要的化工原料。将其合理利用,既能减少污染,又能充分利用资源,创造价值。
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英的成分是_______ (填化学式),该物质的类别属于_______ 氧化物(填“碱性”、 “酸性”或“两性”),实验室中不能用带玻璃塞的试剂瓶盛放NaOH溶液,原因是_______________ (用离子方程式表示)。
(2)玻璃是常用的硅酸盐材料,生产普通玻璃的主要材料有________ 、_______ 、_______ ,工艺师常用_________ (填物质名称)来雕刻玻璃,其作用过程产生________ 气体。
(3)石英坩埚可以用来灼烧下面哪种物质_______。(填字母)
(4)SiO2在自然界中广泛存在,它是制备现代通讯材料_________ (写该材料名称)的主要原料
(5)在一定量的浓硫酸中加入过量铜片,加热使之反应,反应结束后。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为_________________ 。
(6)硝酸是一种重要的工业原料。在实验室中通常保存在棕色试剂瓶中,则原因是_______________ (用化学方程式表示)。硝酸是一种易挥发性的酸,用蘸浓硝酸和蘸浓氨水的玻璃棒靠近会产生大量白烟,白烟的成分是__________ 。
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英的成分是
(2)玻璃是常用的硅酸盐材料,生产普通玻璃的主要材料有
(3)石英坩埚可以用来灼烧下面哪种物质_______。(填字母)
| A.碳酸钠 | B.氢氧化钠 | C.氢氧化钾 | D.氯化钠 |
(5)在一定量的浓硫酸中加入过量铜片,加热使之反应,反应结束后。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(6)硝酸是一种重要的工业原料。在实验室中通常保存在棕色试剂瓶中,则原因是
您最近一年使用:0次
名校
解题方法
4 . 高铁酸钠 微溶于
微溶于 溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生
溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生 。某化学兴趣小组利用如图所示装置(夹持装置略),制取
。某化学兴趣小组利用如图所示装置(夹持装置略),制取 并探究有关性质。回答下列问题:
并探究有关性质。回答下列问题:___________ 。
(2)检查装置B气密性的方法:关闭 ,
, ,
,___________ ,则装置气密性良好。
(3)盛放氯酸钾的仪器名称为___________ ,装置B中试剂的作用为___________ 。
(4)装置C中产生 的离子方程式为
的离子方程式为___________ 。
(5)充分反应后,将装置C中所得混合物经净化处理后得到产品 ,进行如下性质探究:
,进行如下性质探究:
①净水作用:取适量样品溶于蒸馏水后,用一束光照射出现丁达尔效应,用离子方程式解释该出现该现象的原因:___________ 。
②强氧化性:将样品溶于 制成稀溶液,取该溶液滴入
制成稀溶液,取该溶液滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,证明氧化性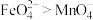 。判断该实验设计是否合理并说明理由:
。判断该实验设计是否合理并说明理由:___________ 。
 微溶于
微溶于 溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生
溶液,在碱性溶液中较稳定,溶液呈紫色,在酸性或中性溶液中快速产生 。某化学兴趣小组利用如图所示装置(夹持装置略),制取
。某化学兴趣小组利用如图所示装置(夹持装置略),制取 并探究有关性质。回答下列问题:
并探究有关性质。回答下列问题: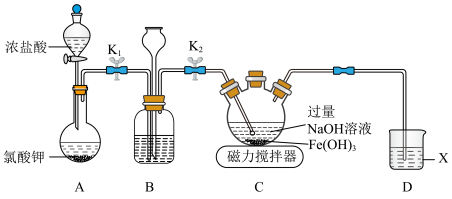
(2)检查装置B气密性的方法:关闭
 ,
, ,
,(3)盛放氯酸钾的仪器名称为
(4)装置C中产生
 的离子方程式为
的离子方程式为(5)充分反应后,将装置C中所得混合物经净化处理后得到产品
 ,进行如下性质探究:
,进行如下性质探究:①净水作用:取适量样品溶于蒸馏水后,用一束光照射出现丁达尔效应,用离子方程式解释该出现该现象的原因:
②强氧化性:将样品溶于
 制成稀溶液,取该溶液滴入
制成稀溶液,取该溶液滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,证明氧化性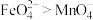 。判断该实验设计是否合理并说明理由:
。判断该实验设计是否合理并说明理由:
您最近一年使用:0次
2024-05-30更新
|
258次组卷
|
2卷引用:2023-2024学年广东省汕头市汕头金南实验学校三模化学试题
名校
解题方法
5 . 火箭发射时可以用肼( )作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题:
)作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题: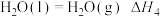 。
。
(1)由图可知,
______ (填“ ”或“
”或“ ”)0,理由为
”)0,理由为_____________ 。
(2)基态氮原子的电子排布式为______ 。
(3)0.1mol 分子中含有
分子中含有______ mol极性共价键, 分子中氮原子的杂化方式为
分子中氮原子的杂化方式为______ 。
(4) 分子中,
分子中, 键和
键和 键的数目之比为
键的数目之比为______ 。
(5)稳定性:
______ (填“ ”或“
”或“ ”)
”) 。
。
(6)由图可知,每转移0.2mol电子,消耗 的体积为
的体积为______ L(标准状况下)。
(7)表示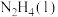 燃烧热的热化学方程式为
燃烧热的热化学方程式为______________ (焓变用含 和
和 的代数式表示)。
的代数式表示)。
 )作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题:
)作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题: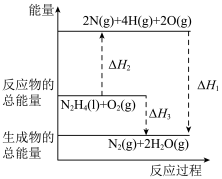
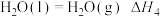 。
。(1)由图可知,

 ”或“
”或“ ”)0,理由为
”)0,理由为(2)基态氮原子的电子排布式为
(3)0.1mol
 分子中含有
分子中含有 分子中氮原子的杂化方式为
分子中氮原子的杂化方式为(4)
 分子中,
分子中, 键和
键和 键的数目之比为
键的数目之比为(5)稳定性:

 ”或“
”或“ ”)
”) 。
。(6)由图可知,每转移0.2mol电子,消耗
 的体积为
的体积为(7)表示
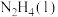 燃烧热的热化学方程式为
燃烧热的热化学方程式为 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
6 . 研究有机物的结构和性质对生产生活意义深远。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。___________ ,B物质的分子式为:___________ 。
(2)按官能团分类,D所属的类别是___________ 。
(3)1molE与足量的金属钠反应产生___________ L氢气(标况下)。
(4)实验室制取C的化学方程式___________ 。
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。___________ (填名称)。
(6)脱氢维生素C中,键角①___________ 键角②(填“>”、“=”或“<”)。
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是___________ 。
(8)标出维生素C中所有的手性碳原子(用*标注)___________ 。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。A. 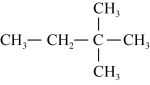 B.
B. 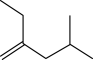 C.
C. D.
D. 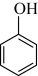 E.
E.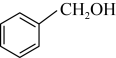
(2)按官能团分类,D所属的类别是
(3)1molE与足量的金属钠反应产生
(4)实验室制取C的化学方程式
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。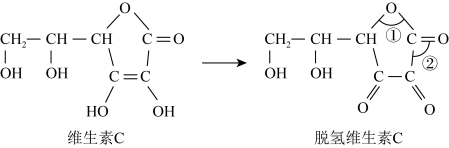
(6)脱氢维生素C中,键角①
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是
(8)标出维生素C中所有的手性碳原子(用*标注)
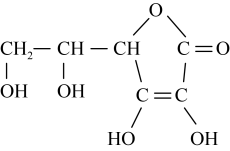
您最近一年使用:0次
7 . 科学家开发了“氧化裂解技术”,将废弃物中的聚苯乙烯(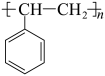 )转变为有用的苯甲酸(
)转变为有用的苯甲酸(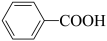 ),变废为宝。转变反应如下:
),变废为宝。转变反应如下: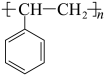
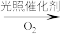
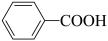 。结合上述材料,回答下列问题:
。结合上述材料,回答下列问题:
| A.属于氧化反应 | B.属于加聚反应 |
| C.发生了碳碳键的断裂 | D.反应物和产物都含有苯分子 |
(2)关于聚苯乙烯的说法正确的是___________。
| A.其单体是乙烯 | B.难溶于水 |
| C.可以制成泡沫包装材料 | D.难以自然降解,应回收处理 |
(3)苯乙烯的一些性质类似于乙烯。苯乙烯___________。
| A.属于烷烃 | B.属于不饱和烃 |
C.不能使溴的 溶液褪色 溶液褪色 | D.能使酸性 溶液褪色 溶液褪色 |
(4)苯甲酸的一些性质类似于乙酸。苯甲酸___________。
| A.可与Na反应 | B.可与NaOH反应 |
| C.一定条件下可与乙醇反应 | D.是一种常见的食品防腐剂 |
(5)一些苯环上有取代基的聚苯乙烯类高分子,也能利用上述的“氧化裂解技术”发生类似的反应。已知一种高分子R的结构如图。下列有关R的说法正确的是___________。
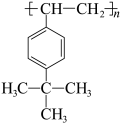
| A.能发生取代反应 | B.能在空气中燃烧 |
C.分子式为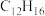 | D.能氧化裂解生成含羧基的物质 |
您最近一年使用:0次
8 . “民以食为天”,对元素周期表中有关元素的认识可使我们更好地了解食品的营养和安全。
结合上述材料,回答下列问题:
(1)仅含a、b、d三种元素的营养物质有___________。
(2)成熟水果会释放出由a和b按原子数目比 组成的气体。该气体分子___________。
组成的气体。该气体分子___________。
(3)某些元素的单质或化合物常用于食品加工和保存。下列说法正确的是___________。
(4)土豆中富含淀粉。淀粉___________。
(5)由a、b、d和e四种元素形成的物质可用作糕点膨松剂。下列说法正确的是___________。
| 周期 | ⅠA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | b | c | d | |||||
| 3 | e | f | g | h |
(1)仅含a、b、d三种元素的营养物质有___________。
| A.脂肪 | B.葡萄糖 | C.蛋白质 | D.氨基酸 |
 组成的气体。该气体分子___________。
组成的气体。该气体分子___________。A.分子式为 | B.呈四面体结构 |
| C.呈三角锥形结构 | D.所有原子共平面 |
| A.a的单质可与植物油发生加成反应 | B.c的单质充入食品包装袋中可防腐 |
| C.f的单质制作的容器可用于贮存酸菜 | D.e和h形成的化合物可用于腌制食品 |
| A.遇碘溶液变色 | B.可水解得到乙醇 |
| C.由a、b、g三种元素组成 | D.水解的最终产物能发生银镜反应 |
| A.非金属性:b>a>d | B.原子半径:e>b>d |
| C.e的最高价氧化物的水化物是强碱 | D.b、d、e原子具有相同的电子层数 |
您最近一年使用:0次
名校
9 . I、按要求写出下列方程式:
(1)FeCl3水解的离子方程式:___________ 。
(2)NaHCO3水解的离子方程式:___________ 。
(3)NH3•H2O的电离方程式:___________ 。
(4)Mg(OH)2在水中的沉淀溶解平衡用离子方程式表示:___________ 。
Ⅱ、回答下列问题。
(5)25℃时,0.01mol/L的NaOH溶液的pH=___________ ;由水电离出c(H+)=___________ mol/L。
(6)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH___________ 4(填“大于”“小于”或“等于”)。
(7)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=___________ mol/L
(1)FeCl3水解的离子方程式:
(2)NaHCO3水解的离子方程式:
(3)NH3•H2O的电离方程式:
(4)Mg(OH)2在水中的沉淀溶解平衡用离子方程式表示:
Ⅱ、回答下列问题。
(5)25℃时,0.01mol/L的NaOH溶液的pH=
(6)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH
(7)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题。
(1)理论上不能设计为原电池的化学反应是___________ 。
a.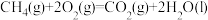
b.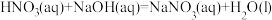
c.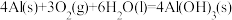
d.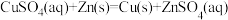
(2)某小组为探究 与
与 能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和
能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和 溶液的琼脂)。该装置石墨棒上发生的电极反应式为
溶液的琼脂)。该装置石墨棒上发生的电极反应式为___________ ,盐桥中 向
向___________ 烧杯移动(填“甲”或“乙”)。___________ ,B电极的电极反应方程式为___________ 。 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式___________ 。
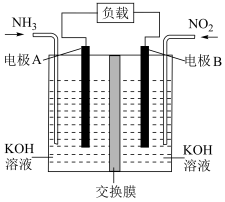
(5)汽车尾气中含有的 是造成城市空气污染的主要因素之一,通过
是造成城市空气污染的主要因素之一,通过 传感器可监测汽车尾气史
传感器可监测汽车尾气史 含量,其工作原理如图所示:
含量,其工作原理如图所示: 电极为
电极为___________ (填“正极”或“负极), 电极上发生的电极反应式为
电极上发生的电极反应式为___________ 。
(1)理论上不能设计为原电池的化学反应是
a.
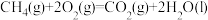
b.
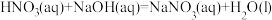
c.
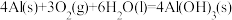
d.
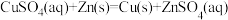
(2)某小组为探究
 与
与 能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和
能否发生氧化还原反应,设计如下图所示双液原电池(盐桥中为饱和 溶液的琼脂)。该装置石墨棒上发生的电极反应式为
溶液的琼脂)。该装置石墨棒上发生的电极反应式为 向
向
 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式(5)汽车尾气中含有的
 是造成城市空气污染的主要因素之一,通过
是造成城市空气污染的主要因素之一,通过 传感器可监测汽车尾气史
传感器可监测汽车尾气史 含量,其工作原理如图所示:
含量,其工作原理如图所示:
 电极为
电极为 电极上发生的电极反应式为
电极上发生的电极反应式为
您最近一年使用:0次



