名校
解题方法
1 . 如图为元素周期表的一部分,请参照a~h在表中的位置,回答下列问题:
(1)g在周期表中的位置是___________ 。
(2)元素d、g、h形成的简单离子中,离子半径最大的是___________ 。(填离子符号)
(3)元素c和元素f形成的化合物的化学式为___________ ,化学键为___________ 。
(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号。已知Te与S元素同主族。
①碲及其化合物可能具有的性质为___________ (填标号)。
A.单质Te在常温下是固体
B.H2Te比H2O稳定
C.H2TeO4的酸性比H2SO4的弱
D.Cl2通入H2Te溶液中不发生反应
E.Te元素位于周期表中第六周期
②TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。写出TeO2与过量NaOH溶液反应的离子方程式___________ 。
③工业上,把SO2通入TeCl4溶液中,可得到Te,该反应的化学方程式是___________ 。
| a | |||||||||
| b | c | d | |||||||
| e | f | g | h |
(2)元素d、g、h形成的简单离子中,离子半径最大的是
(3)元素c和元素f形成的化合物的化学式为
(4)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号。已知Te与S元素同主族。
①碲及其化合物可能具有的性质为
A.单质Te在常温下是固体
B.H2Te比H2O稳定
C.H2TeO4的酸性比H2SO4的弱
D.Cl2通入H2Te溶液中不发生反应
E.Te元素位于周期表中第六周期
②TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。写出TeO2与过量NaOH溶液反应的离子方程式
③工业上,把SO2通入TeCl4溶液中,可得到Te,该反应的化学方程式是
您最近一年使用:0次
名校
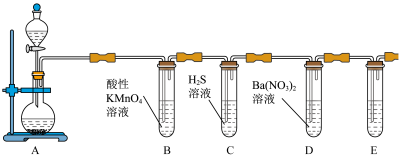
2 . 在装置A圆底烧瓶中加入Na2SO3固体,分液漏斗中滴加浓硫酸制备SO2气体,然后验证SO2的性质,根据题意回答下列问题。_______ 。
(2)B中溶液褪色,请用离子方程式解释_______ 。
(3)C中有黄色沉淀生成说明SO2具有_____ ,D中有白色沉淀生成说明SO2具有_____ 。(填“氧化性”、“还原性”或“酸性”)
(4)E装置中的试剂为_______ 。
(5)某兴趣小组欲证明还原性SO2>Fe2+,请设计试验方案_______ (请写明实验操作、现象和结论;限选试剂:SO2,硫酸铁,FeCl3,酸性高锰酸钾,盐酸,BaCl2溶液)
(2)B中溶液褪色,请用离子方程式解释
(3)C中有黄色沉淀生成说明SO2具有
(4)E装置中的试剂为
(5)某兴趣小组欲证明还原性SO2>Fe2+,请设计试验方案
您最近一年使用:0次
名校
3 . Ⅰ.用如图所示的装置测定中和反应的反应热。____ ,其能否用铜质材料替代?____ (填“能”或“不能”)。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:
 的
的
_______ (保留一位小数)。
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
根据表中数据计算可得该NaOH溶液的物质的量浓度为_______ (保留四位有效数字)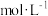 。
。
(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000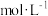 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。
(6)写出滴定的离子方程式:_______ 。
(7)用酸性 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在_______ (填“酸式”或“碱式”)滴定管中,滴定终点的现象是_______ 。

(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:| 反应物 | 起始温度 /℃ /℃ | 最高温度 /℃ /℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
 的
的
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000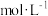 硫酸的体积/mL 硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
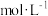 。
。(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始时仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的
 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000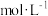 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。(6)写出滴定的离子方程式:
(7)用酸性
 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在
您最近一年使用:0次
名校
解题方法
4 . 有机物的种类多,在日常生活中有重要的用途。请回答下列问题:_____ 。
(2)请用系统命名法命名有机物②_____ 。
(3)⑤与⑦发生共聚反应的化学方程式_____ 。
(4)属于非极性分子的是_____ (填序号)。
(5)⑥中基态氧原子的核外电子的空间运动状态有_____ 种。
(6)硼在成键时能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子价电子轨道表示式:_____ ,该过程形成的原子光谱为_____ (填“吸收”或“发射”)光谱。
①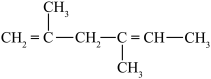 ;②
;②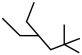 ;③
;③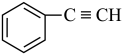 ;④
;④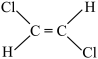 ;⑤
;⑤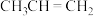 ;⑥
;⑥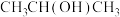 ;⑦
;⑦
(2)请用系统命名法命名有机物②
(3)⑤与⑦发生共聚反应的化学方程式
(4)属于非极性分子的是
(5)⑥中基态氧原子的核外电子的空间运动状态有
(6)硼在成键时能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子价电子轨道表示式:
您最近一年使用:0次
名校
5 . 锑(Sb)是银白色金属,广泛应用于电气、医药等领域。某科研小组从精炼铋烟尘(主要成分为 、
、 、
、 等)中提炼金属锑的流程如图所示:
等)中提炼金属锑的流程如图所示: 、
、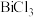 、
、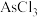 。
。
②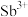 易水解生成两种氯氧锑沉淀
易水解生成两种氯氧锑沉淀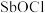 、
、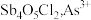 、
、 在上述情况下水解非常微弱。
在上述情况下水解非常微弱。
③ “还原熔炼”的主要反应为 ,熔炼过程中原料之间可能会形成泡渣而结块。
,熔炼过程中原料之间可能会形成泡渣而结块。
回答下列问题:
(1)基态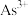 的价电子排布式为
的价电子排布式为_______ 。
(2)“水解”步骤发生的反应为 、
、 ,加入少量水时,
,加入少量水时,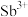 的水解产物以
的水解产物以_______  填化学式
填化学式 为主;促进
为主;促进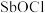 转化为
转化为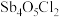 的措施有
的措施有_______ (任写一种)。
(3)“转化”步骤中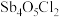 转化为
转化为 的化学方程式为
的化学方程式为_______ 。
(4)“还原熔炼”时碳的用量对锑回收率的影响如图 所示。碳用量超过
所示。碳用量超过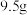 时,锑的回收率降低的原因可能是
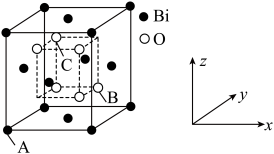
时,锑的回收率降低的原因可能是_______ 。 的立方晶胞结构如图所示
的立方晶胞结构如图所示 占据部分
占据部分 的四面体空隙
的四面体空隙 ,以
,以 点为原点建立分数坐标,已知
点为原点建立分数坐标,已知 点坐标为
点坐标为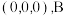 点坐标为
点坐标为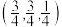 ,则
,则 点坐标为
点坐标为_______ 。晶胞边长为 ,则密度为
,则密度为_______ g cm-3(
cm-3( 的摩尔质量为
的摩尔质量为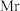 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
 、
、 、
、 等)中提炼金属锑的流程如图所示:
等)中提炼金属锑的流程如图所示: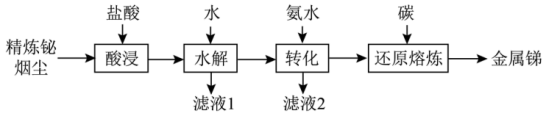
 、
、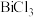 、
、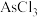 。
。②
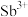 易水解生成两种氯氧锑沉淀
易水解生成两种氯氧锑沉淀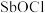 、
、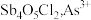 、
、 在上述情况下水解非常微弱。
在上述情况下水解非常微弱。③ “还原熔炼”的主要反应为
 ,熔炼过程中原料之间可能会形成泡渣而结块。
,熔炼过程中原料之间可能会形成泡渣而结块。回答下列问题:
(1)基态
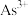 的价电子排布式为
的价电子排布式为(2)“水解”步骤发生的反应为
 、
、 ,加入少量水时,
,加入少量水时,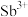 的水解产物以
的水解产物以 填化学式
填化学式 为主;促进
为主;促进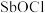 转化为
转化为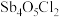 的措施有
的措施有(3)“转化”步骤中
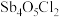 转化为
转化为 的化学方程式为
的化学方程式为(4)“还原熔炼”时碳的用量对锑回收率的影响如图
 所示。碳用量超过
所示。碳用量超过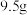 时,锑的回收率降低的原因可能是
时,锑的回收率降低的原因可能是
 的立方晶胞结构如图所示
的立方晶胞结构如图所示 占据部分
占据部分 的四面体空隙
的四面体空隙 ,以
,以 点为原点建立分数坐标,已知
点为原点建立分数坐标,已知 点坐标为
点坐标为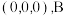 点坐标为
点坐标为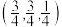 ,则
,则 点坐标为
点坐标为 ,则密度为
,则密度为 cm-3(
cm-3( 的摩尔质量为
的摩尔质量为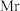 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
您最近一年使用:0次
7日内更新
|
84次组卷
|
2卷引用:广东省深圳市龙岗区龙城高级中学、深圳大学附属中学2023-2024学年高二下学期5月月考化学试题
解题方法
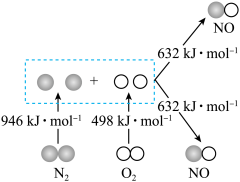
6 . 建设“美丽中国”首先要做好环境保护与治理.氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题.
Ⅰ.汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示:______ (填“吸收”或“放出”)______ kJ热量,1mol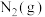 和1mol
和1mol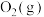 的总能量
的总能量______ (填“大于”“等于”或“小于”)2mol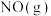 的总能量。
的总能量。
Ⅱ.某科研机构设计了几种如下转化氮氧化物的方案.请回答下列问题:
方案1:利用CO在催化剂条件下还原: 。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:
。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:
(2)①甲容器中,NO2的平衡转化率为______ ;
②温度为T1℃时,0~8min内用CO表示的平均反应速率v(CO)=______ mol·L-1·min-1;
③10min时,反应速率:甲______ (填“>”“<”或“=”)乙,其判断依据是______ ;
(3)在恒温、恒容密闭容器中进行上述反应,下列不能说明该反应一定达到平衡状态的是______ (填标号).
A.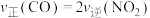 B.混合气体的密度不变
B.混合气体的密度不变
C.容器内气体颜色不变 D.气体平均相对分子质量不变
E.容器内
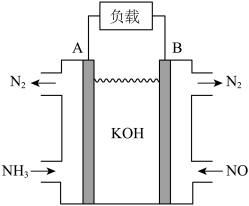
方案2:利用NH3可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示;______ (填“正”或“负”)极;该电池的总反应式为______ 。
Ⅰ.汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示:
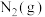 和1mol
和1mol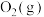 的总能量
的总能量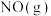 的总能量。
的总能量。Ⅱ.某科研机构设计了几种如下转化氮氧化物的方案.请回答下列问题:
方案1:利用CO在催化剂条件下还原:
 。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:
。向甲、乙两个容积均为2L的恒容密闭容器中分别充入2molNO2(g)和3molCO(g),分别在不同温度下反应.反应过程中测得CO2物质的量如下表:容器 | 甲(T1/℃) | 乙(T2/℃) | ||||||||
反应时间/min | 0 | 4 | 8 | 10 | 20 | 0 | 8 | 10 | 20 | 21 |
n(CO2)/mol | 0 | 0.8 | 1.2 | 1.2 | 1.2 | 0 | 1.0 | 1.2 | 2.0 | 2.0 |
(2)①甲容器中,NO2的平衡转化率为
②温度为T1℃时,0~8min内用CO表示的平均反应速率v(CO)=
③10min时,反应速率:甲
(3)在恒温、恒容密闭容器中进行上述反应,下列不能说明该反应一定达到平衡状态的是
A.
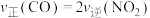 B.混合气体的密度不变
B.混合气体的密度不变C.容器内气体颜色不变 D.气体平均相对分子质量不变
E.容器内

方案2:利用NH3可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示;
您最近一年使用:0次
名校
解题方法
7 . I.磷是构成生命的基本元素之一。
(1)由磷原子形成的三种微粒:a.[Ne]3s23p3、b.[Ne]3s23p2、c.[Ne]3s23p24s1,半径最小的是___________ (填小写字母,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(2)PCl5可发生自耦电离产生一种四面体结构的离子和一种正八面体结构的离子,这两种离子的化学式分别为___________ 。
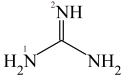
Ⅱ.胍是一类有机物,最简单胍类物质的结构简式如图所示:___________ ,分子中所有原子共平面,胍中N原子杂化方式为___________ 。
(4)胍分子在水中的溶解度___________ (填“大于”、“小于”或“等于”)在苯中的溶解度,原因是___________ 。
(5)2号N原子的孤电子对位于___________ (填选项序号)。
a.sp杂化轨道 b.sp2杂化轨道 c.sp3杂化轨道 d.2p轨道
(1)由磷原子形成的三种微粒:a.[Ne]3s23p3、b.[Ne]3s23p2、c.[Ne]3s23p24s1,半径最小的是
(2)PCl5可发生自耦电离产生一种四面体结构的离子和一种正八面体结构的离子,这两种离子的化学式分别为
Ⅱ.胍是一类有机物,最简单胍类物质的结构简式如图所示:
(4)胍分子在水中的溶解度
(5)2号N原子的孤电子对位于
a.sp杂化轨道 b.sp2杂化轨道 c.sp3杂化轨道 d.2p轨道
您最近一年使用:0次
名校
解题方法
8 . 硅元素及其化合物在生产生活中应用广泛。
回答下列问题:
(1)基态硅原子核外电子有___________ 种空间运动状态,价电子的电子排布图为___________ 。
(2)硅与碳同主族,但硅烷(SiH4)稳定性弱于甲烷,其原因是___________ 。
(3)高纯四氯化硅为无色透明液体,四氯化硅的空间构型为___________ ,四氯化硅易溶于苯,其原因是___________ ,四氯化硅熔点远低于氯化镁,其原因是___________ 。
(4)硅酸盐是地壳的主要成分。硅酸盐的最简单阴离子为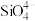 ,为硅氧四面体,结构如图1所示:
,为硅氧四面体,结构如图1所示:___________ 。
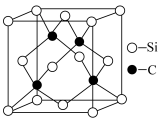
(5)碳化硅俗名金刚砂,其硬度大、熔点高,是良好的耐磨材料,其晶胞结构如图所示。晶体中碳原子位于硅原子组成的___________ (填“正方体”、“正四面体”或“正八面体”)中心;与碳原子距离最近且相等的碳原子有___________ 个,晶胞参数为anm,则碳化硅晶体的密度为___________ 。g·cm-3(列出计算式即可)。
回答下列问题:
(1)基态硅原子核外电子有
(2)硅与碳同主族,但硅烷(SiH4)稳定性弱于甲烷,其原因是
(3)高纯四氯化硅为无色透明液体,四氯化硅的空间构型为
(4)硅酸盐是地壳的主要成分。硅酸盐的最简单阴离子为
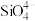 ,为硅氧四面体,结构如图1所示:
,为硅氧四面体,结构如图1所示: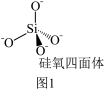

(5)碳化硅俗名金刚砂,其硬度大、熔点高,是良好的耐磨材料,其晶胞结构如图所示。晶体中碳原子位于硅原子组成的
您最近一年使用:0次
名校
9 . 按要求填空。
(1)等质量的 Zn粉分别投入pH=1 体积均为10ml的试管A(盐酸)和试管B (醋酸)中,开始时反应速率A___________ B(填>,=,<),若Zn过量,产生H2的体积A___________ B(填>,=,<)。
(2)有以下物质:
① 溶液、②干冰、③液态HCl、④铜、⑤
溶液、②干冰、③液态HCl、④铜、⑤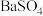 固体、⑥蔗糖、⑦
固体、⑥蔗糖、⑦ 、⑧
、⑧ 固体、⑨盐酸、⑩
固体、⑨盐酸、⑩
属于强电解质的是___________ (填序号,下同)﹔属于非电解质的是___________ 。
(3)理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________ 。
(4)SO2(g)+2H2S(g) =3S(s)+2H2O(l) ΔH<0,该反应熵变ΔS___________ 0,该反应自发进行的条件是___________ (填“低温”“高温”或“任意温度”)。
(5)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO 水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)___________ 。
(1)等质量的 Zn粉分别投入pH=1 体积均为10ml的试管A(盐酸)和试管B (醋酸)中,开始时反应速率A
(2)有以下物质:
①
 溶液、②干冰、③液态HCl、④铜、⑤
溶液、②干冰、③液态HCl、④铜、⑤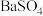 固体、⑥蔗糖、⑦
固体、⑥蔗糖、⑦ 、⑧
、⑧ 固体、⑨盐酸、⑩
固体、⑨盐酸、⑩
属于强电解质的是
(3)理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式
(4)SO2(g)+2H2S(g) =3S(s)+2H2O(l) ΔH<0,该反应熵变ΔS
(5)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO
 水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
您最近一年使用:0次
名校
10 .  是有机物发生羟基化、氧化、芳香化等反应的催化剂。回答下列问题:
是有机物发生羟基化、氧化、芳香化等反应的催化剂。回答下列问题:
(1)C、K、I、O四种元素中,电负性最大的是_______ (填元素符号);碳在形成化合物时,其键型以共价键为主,原因是_______ 。
(2)只含碳元素和氢元素的有机物属于烃,金刚烷和立方烷的结构简式如图所示:_______ ;立方烷中_______ (填“有”或“无”)手性碳原子。
②金刚烷的一氯代物有2种,立方烷的一氯代物有_______ 种。
③ 属于离子晶体,结合已学知识,
属于离子晶体,结合已学知识, 、立方烷、金刚石和
、立方烷、金刚石和 四种物质熔点由高到低的排列顺序为
四种物质熔点由高到低的排列顺序为_______ 。
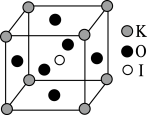
(3) 晶体又是一种性能良好的非线性光学材料,晶胞结构如图所示,晶胞边长为
晶体又是一种性能良好的非线性光学材料,晶胞结构如图所示,晶胞边长为 。
。_______  。
。
②在 晶胞结构的另一种表示中,I处于各顶角位置,则K处于
晶胞结构的另一种表示中,I处于各顶角位置,则K处于_______ 位置,O处于_______ 位置。
③设 为阿伏加德罗常数的值,则该
为阿伏加德罗常数的值,则该 晶体的密度为
晶体的密度为_______  (用含a和
(用含a和 的代数式表示)。
的代数式表示)。
 是有机物发生羟基化、氧化、芳香化等反应的催化剂。回答下列问题:
是有机物发生羟基化、氧化、芳香化等反应的催化剂。回答下列问题:(1)C、K、I、O四种元素中,电负性最大的是
(2)只含碳元素和氢元素的有机物属于烃,金刚烷和立方烷的结构简式如图所示:
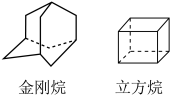
②金刚烷的一氯代物有2种,立方烷的一氯代物有
③
 属于离子晶体,结合已学知识,
属于离子晶体,结合已学知识, 、立方烷、金刚石和
、立方烷、金刚石和 四种物质熔点由高到低的排列顺序为
四种物质熔点由高到低的排列顺序为(3)
 晶体又是一种性能良好的非线性光学材料,晶胞结构如图所示,晶胞边长为
晶体又是一种性能良好的非线性光学材料,晶胞结构如图所示,晶胞边长为 。
。
 。
。②在
 晶胞结构的另一种表示中,I处于各顶角位置,则K处于
晶胞结构的另一种表示中,I处于各顶角位置,则K处于③设
 为阿伏加德罗常数的值,则该
为阿伏加德罗常数的值,则该 晶体的密度为
晶体的密度为 (用含a和
(用含a和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



