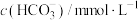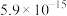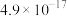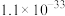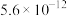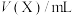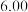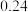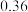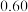名校
1 . 氰化物是指含有氰基或氰根离子的一类化合物,广泛应用于工业与农业中。
(1)工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ: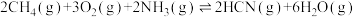
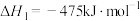
反应Ⅱ: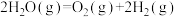
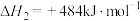
则反应Ⅲ: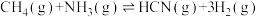

________
(2)在一定温度条件下,向1L恒容密闭容器中加入2mol 和2mol
和2mol 发生反应Ⅲ,10min时反应达到平衡, 此时
发生反应Ⅲ,10min时反应达到平衡, 此时 体积分数为30%。
体积分数为30%。
①0~10min内用 表示的平均反应速率为
表示的平均反应速率为________  。若保持温度不变,再向容器中加入
。若保持温度不变,再向容器中加入 和
和 各1mol,则此时
各1mol,则此时
________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②由实验得到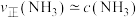 的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的
的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的________ 点(填字母标号)。
(3) 可做
可做 氧化废水中
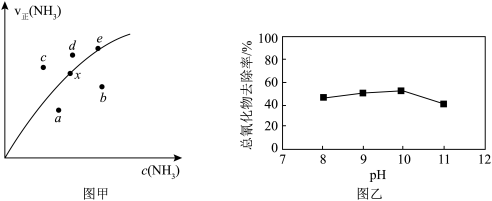
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是________ 。
(4)常温下(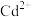 -
- 溶液体系中存在平衡关系:
溶液体系中存在平衡关系: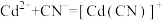 ;
;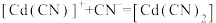 ;
;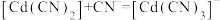 ;
;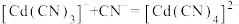 ,平衡常数依次为
,平衡常数依次为 、
、 、
、 、
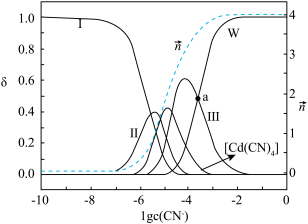
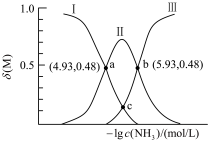
、 。含Cd物种的组分分布分数δ、平均配位数
。含Cd物种的组分分布分数δ、平均配位数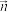 与
与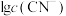 的关系如图所示。
的关系如图所示。
已知: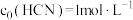 (过程中HCN浓度几乎不变),
(过程中HCN浓度几乎不变), ;
;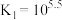 ,
,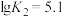 ,
, ,
,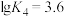 ;平均配位数
;平均配位数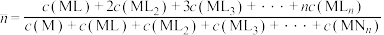 ,其中M代表中心离子,L代表配体。
,其中M代表中心离子,L代表配体。
①曲线Ⅱ代表的含Cd微粒为________ 。
②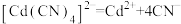 的平衡常数为
的平衡常数为________ 。
③下列有关说法中,正确的是________ 。
A.降低pH,有利于生成
B.pH=7时,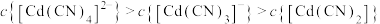
C.平衡后加水稀释,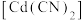 与
与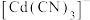 的浓度之比增大
的浓度之比增大
④a点时,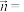
________ 。(写出计算过程,结果保留2位有效数字)。
(1)工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ:
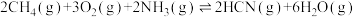
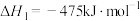
反应Ⅱ:
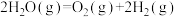
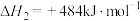
则反应Ⅲ:
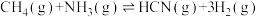

(2)在一定温度条件下,向1L恒容密闭容器中加入2mol
 和2mol
和2mol 发生反应Ⅲ,10min时反应达到平衡, 此时
发生反应Ⅲ,10min时反应达到平衡, 此时 体积分数为30%。
体积分数为30%。①0~10min内用
 表示的平均反应速率为
表示的平均反应速率为 。若保持温度不变,再向容器中加入
。若保持温度不变,再向容器中加入 和
和 各1mol,则此时
各1mol,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②由实验得到
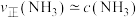 的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的
的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的(3)
 可做
可做 氧化废水中
氧化废水中 的催化剂,氧化过程中总氰化物(
的催化剂,氧化过程中总氰化物( 、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是
(4)常温下(
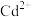 -
- 溶液体系中存在平衡关系:
溶液体系中存在平衡关系: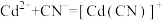 ;
;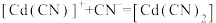 ;
;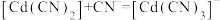 ;
;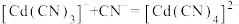 ,平衡常数依次为
,平衡常数依次为 、
、 、
、 、
、 。含Cd物种的组分分布分数δ、平均配位数
。含Cd物种的组分分布分数δ、平均配位数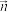 与
与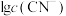 的关系如图所示。
的关系如图所示。
已知:
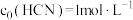 (过程中HCN浓度几乎不变),
(过程中HCN浓度几乎不变), ;
;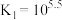 ,
,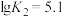 ,
, ,
,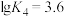 ;平均配位数
;平均配位数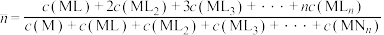 ,其中M代表中心离子,L代表配体。
,其中M代表中心离子,L代表配体。①曲线Ⅱ代表的含Cd微粒为
②
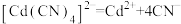 的平衡常数为
的平衡常数为③下列有关说法中,正确的是
A.降低pH,有利于生成

B.pH=7时,
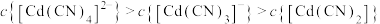
C.平衡后加水稀释,
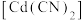 与
与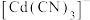 的浓度之比增大
的浓度之比增大④a点时,
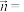
您最近一年使用:0次
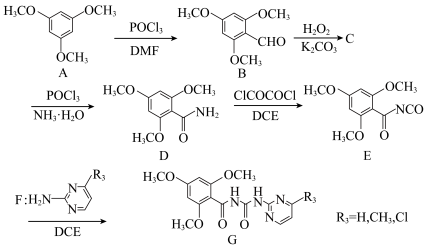
2 . 近年来,香鳞毛蕨药用价值开发已成为全球热点,其主要活性成分为间苯三酚的化合物。化合物G为间苯三酚衍生物,具有良好的抗肿瘤效果,以下是其合成路线:
(1)B中含氧官能团的名称为___________ 。
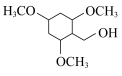
(2)C的分子式为C10H12O5,能与碳酸氢钠反应,写出其结构简式___________ 。
(3)设阿伏伽德罗常数为NA,下列说法正确的是___________(填写序号)。
(4)有机物X与A互为同分异构体,同时满足下列三个条件的X的种数有___________ 种:
①苯环上有两个取代基;②能使FeCl3发生显色反应;③1molX能与3molNa反应。
(5)根据有机物B的结构特征,分析预测其可能的化学性质,完成下表:
(6)参照上述合成路线,以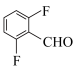 、
、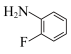 合成
合成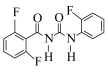 (上述已给试剂任选),回答以下问题:
(上述已给试剂任选),回答以下问题:
①合成路线中生成一元酰胺的反应方程式为:___________ 。
②最后一步的反应物的结构简式为:___________ 。
(1)B中含氧官能团的名称为
(2)C的分子式为C10H12O5,能与碳酸氢钠反应,写出其结构简式
(3)设阿伏伽德罗常数为NA,下列说法正确的是___________(填写序号)。
| A.有机物D的分子式为C10H13NO4; |
| B.有机物D与有机物E中N原子均采用sp3杂化; |
| C.有机物D与有机物E中均含有手性碳原子; |
| D.1mol有机物E含有28NA个σ键。 |
①苯环上有两个取代基;②能使FeCl3发生显色反应;③1molX能与3molNa反应。
(5)根据有机物B的结构特征,分析预测其可能的化学性质,完成下表:
| 序号 | 反应试剂及条件 | 反应后形成的新物质 | 反应类型 |
| i | 银氨溶液,加热 | ||
| ii |
|
 、
、 合成
合成 (上述已给试剂任选),回答以下问题:
(上述已给试剂任选),回答以下问题:①合成路线中生成一元酰胺的反应方程式为:
②最后一步的反应物的结构简式为:
您最近一年使用:0次
3 . 1.滴定法是用于测定溶液中微粒浓度的重要方法。某实验小组利用滴定法测定碘酒中碘的含量。
1.配制稀碘液:移取10.00mL碘酒,准确配制100mL稀碘液。需要的玻璃仪器有:烧杯、玻璃棒、(从下列图中选择,填选项) 。 后,用浓度为0.1000
后,用浓度为0.1000
 标准溶液滴定,实验数据如下表所示。
标准溶液滴定,实验数据如下表所示。
已知: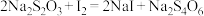
①第1次实验 溶液的用量明显多于后两次,原因可能是
溶液的用量明显多于后两次,原因可能是___________
A.盛装标准溶液的滴定管用蒸馏水洗净后,未润洗
B.滴入半滴标准溶液,溶液变色,即判定达滴定终点
C.滴定达终点时发现滴定管尖嘴内有气泡产生
D.滴定终点读取滴定管刻度时,俯视标准液液面
②该碘酒中碘的含量为___________  。(已知
。(已知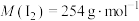 )
)
(2)借鉴(2)的方法,用图所示的流程测定海带中的碘含量。 发生的离子反应方程式是
发生的离子反应方程式是_____________ 。
②预测达到滴定终点的实验现象为_____________ ,在实验时却发现溶液变色片刻后,恢复滴定前的颜色。继续滴加 ,溶液变色片刻后再一次恢复原色。
,溶液变色片刻后再一次恢复原色。
(3)探究异常现象产生的原因。
该学习小组通过设计对照实验,发现空气中的氧气并不能较快地氧化待测液中的 。
。
提出猜想:过量的_______ 将生成的 重新氧化成碘单质。
重新氧化成碘单质。
验证猜想:将2mL待测液、2滴0.1
 溶液、2滴淀粉溶液和
溶液、2滴淀粉溶液和________ 混合,用 溶液滴定,若待测液变为无色后又反复变色,则证明猜想不成立。
溶液滴定,若待测液变为无色后又反复变色,则证明猜想不成立。
提出疑问:什么物质反复氧化碘离子。
寻找证据:按图中的流程, 用量改为少量,氧化后的待测液静置半小时,利用氧化还原电势传感器测定滴定过程中电势的变化,待溶液变色后停止滴定,溶液恢复原色后继续滴加
用量改为少量,氧化后的待测液静置半小时,利用氧化还原电势传感器测定滴定过程中电势的变化,待溶液变色后停止滴定,溶液恢复原色后继续滴加 至溶液变色,循环往复,得到图所示的曲线。
至溶液变色,循环往复,得到图所示的曲线。
ⅰ氧化性物质的电势值高于还原性物质:
ⅱ一定条件下,氧化性物质的浓度越高,电势越高,还原性物质浓度越高,电势越低。
a-b段电势升高的原因是_____________ (填化学式)被氧化。由a-b段电势变化的斜率小于b-c段可推测溶液反复变色的原因是________________________ 。
优化流程:将用 氧化后的待测液
氧化后的待测液________________ ,再进行滴定,到达滴定终点时待测液变色后不会恢复原色。
1.配制稀碘液:移取10.00mL碘酒,准确配制100mL稀碘液。需要的玻璃仪器有:烧杯、玻璃棒、(从下列图中选择,填选项) 。
A.  B.
B.  C.
C. 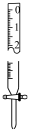 D.
D. 
 后,用浓度为0.1000
后,用浓度为0.1000
 标准溶液滴定,实验数据如下表所示。
标准溶液滴定,实验数据如下表所示。序号 |
| 稀碘液的用量/mL |
1 | 21.32 | 25.00 |
2 | 20.02 | 25.00 |
3 | 19.98 | 25.00 |
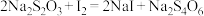
①第1次实验
 溶液的用量明显多于后两次,原因可能是
溶液的用量明显多于后两次,原因可能是A.盛装标准溶液的滴定管用蒸馏水洗净后,未润洗
B.滴入半滴标准溶液,溶液变色,即判定达滴定终点
C.滴定达终点时发现滴定管尖嘴内有气泡产生
D.滴定终点读取滴定管刻度时,俯视标准液液面
②该碘酒中碘的含量为
 。(已知
。(已知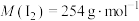 )
)(2)借鉴(2)的方法,用图所示的流程测定海带中的碘含量。

 发生的离子反应方程式是
发生的离子反应方程式是②预测达到滴定终点的实验现象为
 ,溶液变色片刻后再一次恢复原色。
,溶液变色片刻后再一次恢复原色。(3)探究异常现象产生的原因。
该学习小组通过设计对照实验,发现空气中的氧气并不能较快地氧化待测液中的
 。
。提出猜想:过量的
 重新氧化成碘单质。
重新氧化成碘单质。验证猜想:将2mL待测液、2滴0.1

 溶液、2滴淀粉溶液和
溶液、2滴淀粉溶液和 溶液滴定,若待测液变为无色后又反复变色,则证明猜想不成立。
溶液滴定,若待测液变为无色后又反复变色,则证明猜想不成立。提出疑问:什么物质反复氧化碘离子。
寻找证据:按图中的流程,
 用量改为少量,氧化后的待测液静置半小时,利用氧化还原电势传感器测定滴定过程中电势的变化,待溶液变色后停止滴定,溶液恢复原色后继续滴加
用量改为少量,氧化后的待测液静置半小时,利用氧化还原电势传感器测定滴定过程中电势的变化,待溶液变色后停止滴定,溶液恢复原色后继续滴加 至溶液变色,循环往复,得到图所示的曲线。
至溶液变色,循环往复,得到图所示的曲线。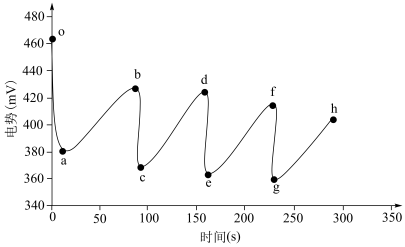
ⅰ氧化性物质的电势值高于还原性物质:
ⅱ一定条件下,氧化性物质的浓度越高,电势越高,还原性物质浓度越高,电势越低。
a-b段电势升高的原因是
优化流程:将用
 氧化后的待测液
氧化后的待测液
您最近一年使用:0次
名校
4 . 铜及其化合物是高中化学的重要组成部分,在工农业生产中具有重要的应用。
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要___________ (填化学式)。
(2)已知CuCl在氨水中络合后极易被空气中的 氧化。
氧化。
①补齐下列离子方程式:__________ 。
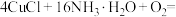 ___________
___________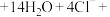 ___________
___________
②现将Cu置于 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为___________ 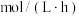 。
。
(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:

ⅱ: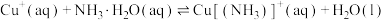

ⅲ: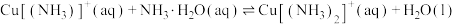
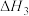
①反应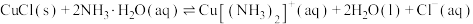
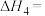
___________ (用 、
、 、
、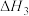 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是___________ (填元素符号)。
②对于上述相关平衡体系,下列说法不正确的是:___________ (填编号)
A.加水稀释,平衡后溶液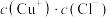 不变
不变
B.向体系中通入 ,有利于提高
,有利于提高 平衡转化率
平衡转化率
C.升高温度,有利于生成
D.溶液中存在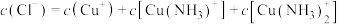
③向一定浓度的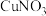 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数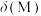 与
与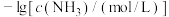 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数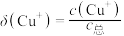 ,
, 。
。___________ 分布系数(填离子符号)。
(b)反应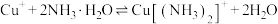 的
的
___________ 。(已知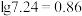 )
)
(c)c点的坐标为___________ 。(已知 )
)
(1)在农业上可用含铜的波尔多液作为农药,配制波尔多液需要
(2)已知CuCl在氨水中络合后极易被空气中的
 氧化。
氧化。①补齐下列离子方程式:
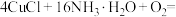 ___________
___________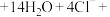 ___________
___________②现将Cu置于
 溶液中,通入
溶液中,通入 ,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为
,反应1小时,测得体系中铜离子总浓度为160mg/L,Cu的溶解速率为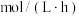 。
。(3)查阅文献:在无氧条件下CuCl在氨水溶液中存下如下平衡(含足量CuCl固体)
ⅰ:


ⅱ:
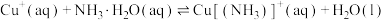

ⅲ:
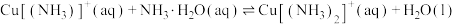
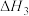
①反应
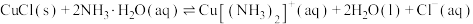
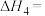
 、
、 、
、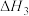 来表示);在上述反应中,配原子是
来表示);在上述反应中,配原子是②对于上述相关平衡体系,下列说法不正确的是:
A.加水稀释,平衡后溶液
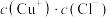 不变
不变B.向体系中通入
 ,有利于提高
,有利于提高 平衡转化率
平衡转化率C.升高温度,有利于生成

D.溶液中存在
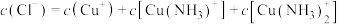
③向一定浓度的
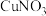 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数
得到澄清溶液(设溶液体积不变),测得平衡体系中含铜微粒分布系数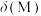 与
与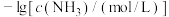 关系如下图所示(其中M代表体系中含铜微粒)。如
关系如下图所示(其中M代表体系中含铜微粒)。如 的分布系数
的分布系数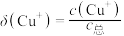 ,
, 。
。
(b)反应
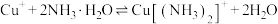 的
的
 )
)(c)c点的坐标为
 )
)
您最近一年使用:0次
5 . 某小组探秘人体血液中的运载氧平衡及酸碱平衡,回答下列问题:
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:
ⅰ.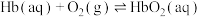
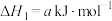
ⅱ.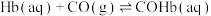
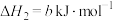
ⅱ.

ⅳ.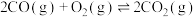

(1)
________ (用含a、b或c的代数式表示)。
(2) 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。
(3)36.5℃时,氧饱和度[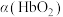 ,
,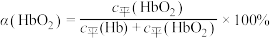 ]与氧气的平衡分压[
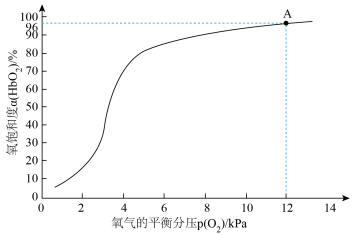
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
____________________ (写出计算过程;氧气的平衡浓度可用氧气的平衡分压代替)。
正常人体血液中主要含有 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
(4)37℃时 的水解常数
的水解常数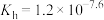 ,
,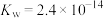 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式___________ ;请判断该同学血液的pH是否正常________ 。(填“是”或“否”)
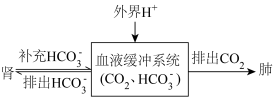
(5)人体酸碱平衡维持机制简要表达如下图: 会
会__________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法__________ 。(选填字母)
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合
 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:ⅰ.
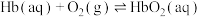
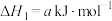
ⅱ.
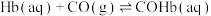
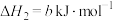
ⅱ.


ⅳ.
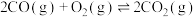

(1)

(2)
 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。A.当 不变时,反应达到平衡 不变时,反应达到平衡 | B.若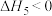 ,则该反应任意温度下能自发 ,则该反应任意温度下能自发 |
C.高氧条件下,血液中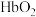 浓度增加 浓度增加 | D.人体代谢酸增加,该反应K值变大 |
(3)36.5℃时,氧饱和度[
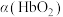 ,
,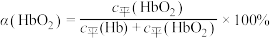 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
正常人体血液中主要含有
 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:项目名称 | 结果浓度 | 参考范围 | |
正常人 | 代谢性酸中毒病人 | ||
| 40 | 50 | 35~45 |
| 24.2 | 19 | 23.3~24.8 |
血液酸碱度(pH) | 7.40 | 7.21 | 7.35~7.45 |
(4)37℃时
 的水解常数
的水解常数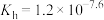 ,
,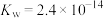 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式(5)人体酸碱平衡维持机制简要表达如下图:
 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
您最近一年使用:0次
名校
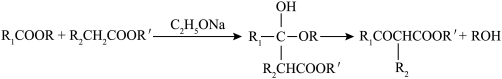
6 . 有机物G是合成中草药活性成分Psoralidin的中间体,其合成路线如下:
(1)化合物A的名称为______ ;C中官能团的名称为______ 。
(2)结合已有知识,写出E→F的方程式:______ ;该反应类型为______ 。
(3)下列关于反应F→G的说法中,正确的有______
(4)化合物E的芳香族同分异构体中,同时满足如下条件的有______ 种,
a)只含一种官能团且能与碳酸钠反应生成 ;
;
b)核磁共振氢谱确定分子中有9个化学环境相同的氢原子。
其中核磁共振氢谱有4组峰的结构简式为______ 。(写出一种即可)
(5)对甲氧基苯甲酸(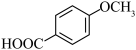 )可用作防腐剂或制备香料,结合上述信息,写出以苯酚为主要原料制备
)可用作防腐剂或制备香料,结合上述信息,写出以苯酚为主要原料制备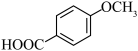 的合成路线
的合成路线____ 。

(1)化合物A的名称为
(2)结合已有知识,写出E→F的方程式:
(3)下列关于反应F→G的说法中,正确的有______
| A.反应过程中有极性键、非极性键的断裂和形成 |
| B.化合物F存在顺反异构体 |
| C.该反应有乙醇生成 |
| D.化合物G中碳原子的杂化方式有两种 |
(4)化合物E的芳香族同分异构体中,同时满足如下条件的有
a)只含一种官能团且能与碳酸钠反应生成
 ;
;b)核磁共振氢谱确定分子中有9个化学环境相同的氢原子。
其中核磁共振氢谱有4组峰的结构简式为
(5)对甲氧基苯甲酸(
 )可用作防腐剂或制备香料,结合上述信息,写出以苯酚为主要原料制备
)可用作防腐剂或制备香料,结合上述信息,写出以苯酚为主要原料制备 的合成路线
的合成路线
您最近一年使用:0次
2024-04-28更新
|
718次组卷
|
2卷引用:广东省汕头市2024届高三二模考试化学试
7 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
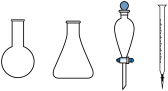
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示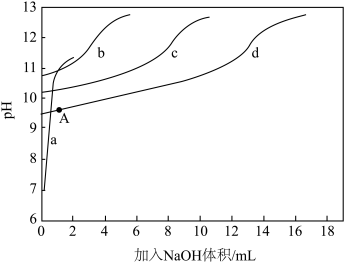
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近一年使用:0次
8 . 锆被称为原子时代的头号金属。一种以氧氯化锆(主要含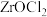 ,还含有少量
,还含有少量 、
、 、
、 等元素)为原料生产金属锆的工艺流程如下:
等元素)为原料生产金属锆的工艺流程如下:
①“酸溶”后溶液中各金属元素的存在形式为: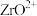 、
、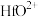 、
、 、
、 ;
;
②25℃时, ,
,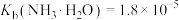 ;
;
回答下列问题:
(1)“酸溶”后, 元素的化合价为
元素的化合价为________ 。
(2)“萃取”时,锆元素可与萃取剂形成多种络合物,写出生成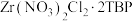 的离子方程式:
的离子方程式:____________________ 。
(3)“沉淀”后,“废液”中 ,则“废液”中
,则“废液”中
________  。
。
(4)“沸腾氯化”时,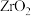 转化为
转化为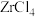 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为____________________ 。
(5)①“还原”的主要目的是____________________ 。
② 沸点远低于
沸点远低于 的可能原因为
的可能原因为____________________ 。
(6)某种掺杂 的
的 晶胞如图所示,
晶胞如图所示, 位于晶胞的面心。
位于晶胞的面心。________ 。
②已知该晶胞为立方晶胞,晶胞中O与Zr的最小间距为 ,设
,设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为________ 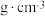 (列出计算式)。
(列出计算式)。
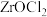 ,还含有少量
,还含有少量 、
、 、
、 等元素)为原料生产金属锆的工艺流程如下:
等元素)为原料生产金属锆的工艺流程如下:
①“酸溶”后溶液中各金属元素的存在形式为:
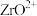 、
、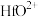 、
、 、
、 ;
;②25℃时,
 ,
,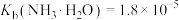 ;
;物质 |
|
|
|
|
|
沸点/℃ | 331 | 315 | 1300 | 700 | 1150 |
(1)“酸溶”后,
 元素的化合价为
元素的化合价为(2)“萃取”时,锆元素可与萃取剂形成多种络合物,写出生成
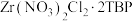 的离子方程式:
的离子方程式:(3)“沉淀”后,“废液”中
 ,则“废液”中
,则“废液”中
 。
。(4)“沸腾氯化”时,
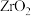 转化为
转化为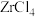 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为(5)①“还原”的主要目的是
②
 沸点远低于
沸点远低于 的可能原因为
的可能原因为(6)某种掺杂
 的
的 晶胞如图所示,
晶胞如图所示, 位于晶胞的面心。
位于晶胞的面心。
②已知该晶胞为立方晶胞,晶胞中O与Zr的最小间距为
 ,设
,设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为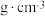 (列出计算式)。
(列出计算式)。③如图所示结构( )与上述晶胞结构不一致的是
)与上述晶胞结构不一致的是
A.  B.
B. C.
C.  D.
D.
您最近一年使用:0次
名校
9 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al等)制备Co2O3和Li2CO3。工艺流程如下: 如下表:
如下表:
②常温时, 的溶度积
的溶度积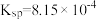 ,该数值随温度升高而减小。
,该数值随温度升高而减小。
(1)LiCoO2中Co元素的化合价为______ ;基态Co原子的价层电子轨道表示式为______ 。
(2)“酸浸”时发生反应: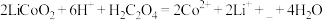 。
。
①补充完整上述离子方程式______ ;
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是______ 。
(3)已知滤渣2中含有 ,则常温下滤液2中
,则常温下滤液2中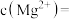
______ mol/L。
(4)滤液3中含金属元素的离子主要是 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为______ 。
(5)沉锂操作过程中的存在反应: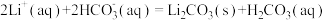 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是______ 。
(6)由 进一步制得的
进一步制得的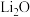 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为______ ;
②设阿伏加德罗常数的值为 。晶胞
。晶胞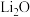 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为______ pm。

 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
 的溶度积
的溶度积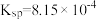 ,该数值随温度升高而减小。
,该数值随温度升高而减小。(1)LiCoO2中Co元素的化合价为
(2)“酸浸”时发生反应:
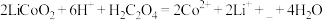 。
。①补充完整上述离子方程式
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是
(3)已知滤渣2中含有
 ,则常温下滤液2中
,则常温下滤液2中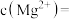
(4)滤液3中含金属元素的离子主要是
 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为(5)沉锂操作过程中的存在反应:
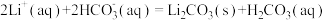 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是(6)由
 进一步制得的
进一步制得的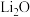 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。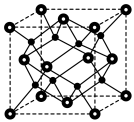
 在晶胞中的位置为
在晶胞中的位置为②设阿伏加德罗常数的值为
 。晶胞
。晶胞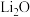 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为
您最近一年使用:0次
2024-03-15更新
|
1045次组卷
|
3卷引用:广东省江门市2023-2024学年高三一模考试化学卷
广东省江门市2023-2024学年高三一模考试化学卷广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题 (已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
解题方法
10 . 铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1) 铁粉与
铁粉与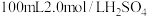 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。 反应平均速率
反应平均速率
_______ 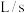 ;
;
② 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:_______ 。
(2)常温下, 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)
(3)反应 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。__________________________________________ ;
②反应过程中由于 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:____________________________________ 。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为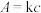 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: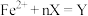 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为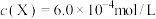 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
根据此数据,可以推断反应计量数 ,并计算
,并计算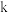 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。
已知:1.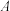 为吸光度,无单位;
为吸光度,无单位;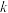 为常数,单位为
为常数,单位为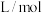 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。
①使用该方法时,需要控制 在2~9之间,其原因为:
在2~9之间,其原因为:____________________ 。
② 中
中 的配位数为
的配位数为_______ 。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下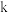 值为
值为______________ 。
(1)
 铁粉与
铁粉与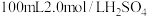 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。
 反应平均速率
反应平均速率
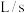 ;
;②
 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:(2)常温下,
 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)A.增大 溶液的浓度,平衡常数增大 溶液的浓度,平衡常数增大 |
B.向上述平衡体系中加入适量 固体,平衡不移动 固体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,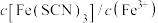 减小 减小 |
(3)反应
 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。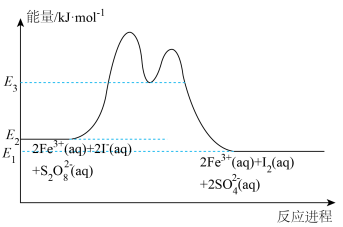
②反应过程中由于
 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为
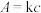 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: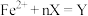 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为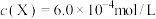 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 ,并计算
,并计算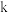 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。已知:1.
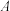 为吸光度,无单位;
为吸光度,无单位;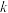 为常数,单位为
为常数,单位为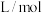 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。2.邻二氮菲的结构如图所示: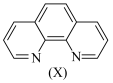
①使用该方法时,需要控制
 在2~9之间,其原因为:
在2~9之间,其原因为:②
 中
中 的配位数为
的配位数为A.2 B.3 C.6 D.8
③该实验条件下
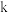 值为
值为
您最近一年使用:0次