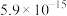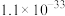某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al等)制备Co2O3和Li2CO3。工艺流程如下: 如下表:
如下表:
②常温时, 的溶度积
的溶度积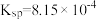 ,该数值随温度升高而减小。
,该数值随温度升高而减小。
(1)LiCoO2中Co元素的化合价为______ ;基态Co原子的价层电子轨道表示式为______ 。
(2)“酸浸”时发生反应: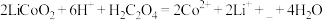 。
。
①补充完整上述离子方程式______ ;
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是______ 。
(3)已知滤渣2中含有 ,则常温下滤液2中
,则常温下滤液2中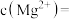
______ mol/L。
(4)滤液3中含金属元素的离子主要是 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为______ 。
(5)沉锂操作过程中的存在反应: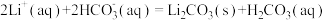 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是______ 。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为______ ;
②设阿伏加德罗常数的值为 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为______ pm。

 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
 的溶度积
的溶度积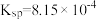 ,该数值随温度升高而减小。
,该数值随温度升高而减小。(1)LiCoO2中Co元素的化合价为
(2)“酸浸”时发生反应:
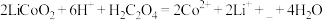 。
。①补充完整上述离子方程式
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是
(3)已知滤渣2中含有
 ,则常温下滤液2中
,则常温下滤液2中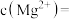
(4)滤液3中含金属元素的离子主要是
 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为(5)沉锂操作过程中的存在反应:
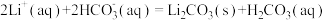 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。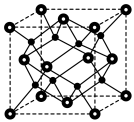
 在晶胞中的位置为
在晶胞中的位置为②设阿伏加德罗常数的值为
 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为
2024·广东江门·一模 查看更多[3]
广东省江门市2023-2024学年高三一模考试化学卷(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
更新时间:2024-03-15 17:28:25
|
相似题推荐
解答题-工业流程题
|
困难
(0.15)
名校
【推荐1】绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:

回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为___________ 。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)工序③中发生反应的离子方程式为___________ 。
(4)热解工序产生的混合气体最适宜返回工序___________ (填“①”或“②”或“③”或“④”)参与内循环。
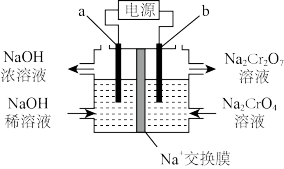
(5)工序③也可以利用电解法制 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的___________ 极相连,制备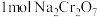 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重___________ g。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的 为
为___________ 。(通常认为溶液中离子浓度等于 为恰好沉淀完全;已知
为恰好沉淀完全;已知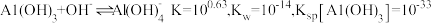 )
)
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)热解工序产生的混合气体最适宜返回工序
(5)工序③也可以利用电解法制
 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的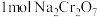 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重
(6)工序④溶液中的铝元素恰好完全转化为沉淀的
 为
为 为恰好沉淀完全;已知
为恰好沉淀完全;已知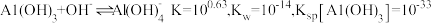 )
)
您最近一年使用:0次
【推荐2】二氧化铈 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成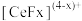 ,也能与
,也能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: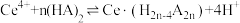 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比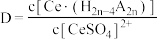 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率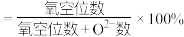 )
) 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂 后得到
后得到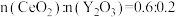 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: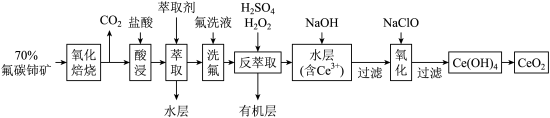
 能与
能与 结合成
结合成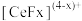 ,也能与
,也能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
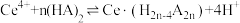 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比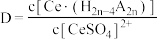 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: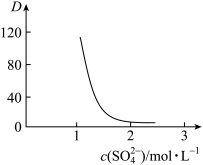
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率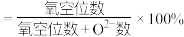 )
)
 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
 后得到
后得到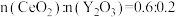 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
【推荐3】铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是_______ 。
(2)阴极附近溶液pH升高的原因是______________________ (用电极反应式解释)溶液中同时生成的沉淀还有_________ 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:


已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是_____ ,pH控制在3. 4的作用是_____ 。已知25°C时, ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K=
Cu(OH)2+2H+的平衡常数K=______ 。
(4)如何判断步骤③中沉淀是否洗涤干净_________ ?
(5)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为____ 。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是
(2)阴极附近溶液pH升高的原因是
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:


已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是
 ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K=
Cu(OH)2+2H+的平衡常数K=(4)如何判断步骤③中沉淀是否洗涤干净
(5)制备氮化铁磁粉的反应:
 (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
解题方法
【推荐1】氮化亚铜用于制备P型半导体,其可用 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:
(1)基态N原子核外电子的电子排布图(轨道表示式)为___________ 。
(2)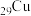 、
、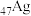 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为___________ ;但铜的熔点和沸点均比银的高,这是由于___________ 。
(3) 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为___________ , 的价电子数为
的价电子数为___________ 。
(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:
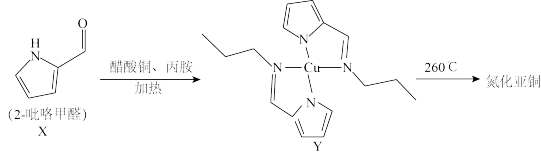
①配合物Y中,Cu的配位数为___________ 。
②基态 中未成对电子数为
中未成对电子数为___________ 。
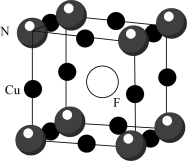
(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为___________ pm,设 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。
 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:(1)基态N原子核外电子的电子排布图(轨道表示式)为
(2)
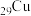 、
、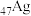 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为(3)
 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为 的价电子数为
的价电子数为(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:

①配合物Y中,Cu的配位数为
②基态
 中未成对电子数为
中未成对电子数为(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为
 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐2】铁、镍、铜在医药、催化及材料等领域中都有广泛的应用。回答下列问题:
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为___________ (填轨道表示式)。
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为___________ 。
②不存在的化学键有___________ (填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
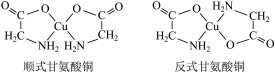
①甘氨酸铜中氮原子的杂化类型为___________ 。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是___________ 。
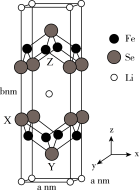
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1, ),Y的坐标为(
),Y的坐标为( ,
, ,
, ),设NA为阿伏加德罗常数的值。坐标为(
),设NA为阿伏加德罗常数的值。坐标为( ,1,
,1, )的是
)的是___________ 原子,Se原子X与Se原子Y之间的距离为___________ nm,该晶体的密度为___________ g·cm-3。
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为
②不存在的化学键有
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中氮原子的杂化类型为
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1,
 ),Y的坐标为(
),Y的坐标为( ,
, ,
, ),设NA为阿伏加德罗常数的值。坐标为(
),设NA为阿伏加德罗常数的值。坐标为( ,1,
,1, )的是
)的是
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
解题方法
【推荐3】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________ ,D原子的杂化类型为_______________ 。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________ (填“大于”、“小于”、或“等于”)N的沸点,原因是_______________ 。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________ 。写出相应的化学反应方程式:____________________ 。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________ ,加入乙醇的作用是________________ 。
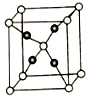
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________ 。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______ g.cm-3
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为

您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
解题方法
【推荐1】“物质的性质、性能,不仅与组成有关,还与晶体结构有关。完成如下有关的问题。
(1)铁有 、
、 、
、 三种同素异形体,如图所示,三种晶体在不同温度下能发生转化。
三种同素异形体,如图所示,三种晶体在不同温度下能发生转化。

三种晶体中,与每个铁原子等距离且最近的铁原子: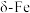 有8个、
有8个、 有
有_______ 个、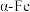 有
有_______ 个;将铁缓慢加热到1500℃再降温到常温,缓慢冷却得固体A和急速冷却得固体B,两者密度不同,较大的是固体_______ (填“A”或“B”)。
(2)金刚石和 都由碳元素组成,
都由碳元素组成,_______ 晶体中构成微粒的配位数较大,原因是_______ 。
(3)PTC元件(热敏电阻)的主要成分 热稳定性好、介电常数高,在小型的变压器、话筒中都有应用。晶体中,Ba在由12个O围成的十四面体(六个正方形、八个正三角形)的中心,Ti在由6个O围成的正八面体的中心,则O在由
热稳定性好、介电常数高,在小型的变压器、话筒中都有应用。晶体中,Ba在由12个O围成的十四面体(六个正方形、八个正三角形)的中心,Ti在由6个O围成的正八面体的中心,则O在由_______ 围成的立体结构的中心。
(4)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

①若A原子的坐标参数为(0,0.0),C为(l,1,1),则B原子的坐标参数为_______ 。
②三种微粒半径: ,
, ,则Cu、Mn原子之间的最短核间距离为
,则Cu、Mn原子之间的最短核间距离为_______ pm。
③将Cu-Mn-Al合金晶胞沿棱投影于垂直面可得如图3。下列属于沿面对角线或体对角线投影于垂直面的是_______ 。(填字母序号)


(1)铁有
 、
、 、
、 三种同素异形体,如图所示,三种晶体在不同温度下能发生转化。
三种同素异形体,如图所示,三种晶体在不同温度下能发生转化。
三种晶体中,与每个铁原子等距离且最近的铁原子:
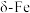 有8个、
有8个、 有
有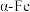 有
有(2)金刚石和
 都由碳元素组成,
都由碳元素组成,(3)PTC元件(热敏电阻)的主要成分
 热稳定性好、介电常数高,在小型的变压器、话筒中都有应用。晶体中,Ba在由12个O围成的十四面体(六个正方形、八个正三角形)的中心,Ti在由6个O围成的正八面体的中心,则O在由
热稳定性好、介电常数高,在小型的变压器、话筒中都有应用。晶体中,Ba在由12个O围成的十四面体(六个正方形、八个正三角形)的中心,Ti在由6个O围成的正八面体的中心,则O在由(4)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

①若A原子的坐标参数为(0,0.0),C为(l,1,1),则B原子的坐标参数为
②三种微粒半径:
 ,
, ,则Cu、Mn原子之间的最短核间距离为
,则Cu、Mn原子之间的最短核间距离为③将Cu-Mn-Al合金晶胞沿棱投影于垂直面可得如图3。下列属于沿面对角线或体对角线投影于垂直面的是


您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
解题方法
【推荐2】硅可以和多种金属形成组成各异、结构丰富的二元化合物。例如,在Ca-Si体系中,有Ca₅Si,Ca2Si,CaSi2,CaSi3等等。随着高压科学和技术的发展,总来越多的新物相新结构得以发现且呈现出有趣的成键特点。在20GPa条件下得到的二元Ca-Si化合物D属四方晶系,晶胞参数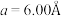 ,
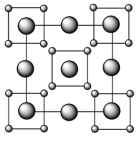
,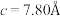 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为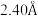 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元___________ 。(提示:注意同号电荷相斥!)
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数_______ 。
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构___________ 。
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图___________ 。(要求:示出结构特征,至少包含20个硅原子,并勾勒出二维晶胞)
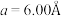 ,
,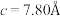 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为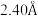 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
解题方法
【推荐3】现代科技的发展离不开材料的开发与应用,而物质结构理论是材料研究的基础,请回答Ⅰ-Ⅳ的问题。
Ⅰ.使用 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
(1) 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_______________ 和_______________ 。
(2)1个 分子中存在
分子中存在_______________ 个 键。
键。
(3) 易溶于水的原因是
易溶于水的原因是_____________________ 。
Ⅱ.硒( )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
(4)在基态K原子中,能量最低的空轨道的符号是_____ , 原子的价电子排布式为
原子的价电子排布式为______ 。
(5) 的空间构型为
的空间构型为___________ ,写出一个与 互为等电子体的分子
互为等电子体的分子_____ (填分子式)。
(6)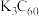 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在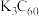 晶胞中,
晶胞中,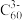 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为_______________ 。

Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是_______________ (填化学名称)。
(8)已知咪唑中存在大 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是_______________ (填“①”或“②”)号氮原子。
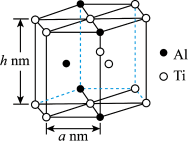
Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示( 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。
(9)列出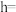
_____ cm的计算式,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
Ⅰ.使用
 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。(1)
 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(2)1个
 分子中存在
分子中存在 键。
键。(3)
 易溶于水的原因是
易溶于水的原因是Ⅱ.硒(
 )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。(4)在基态K原子中,能量最低的空轨道的符号是
 原子的价电子排布式为
原子的价电子排布式为(5)
 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(6)
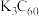 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在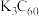 晶胞中,
晶胞中,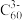 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为
Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是
(8)已知咪唑中存在大
 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(
 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。(9)列出
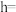
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐1】工业上利用回收的合金废料(主要含Fe、Cu、Co、Si、Li)进行深度加工的工艺流程如图:

已知:①Fe、Co、Ni为同族元素,化学性质相似
②Li2CO3微溶于水,其饱和溶液的物质的量浓度与温度关系如表所示
回答下列问题:
(1)流程中残渣M的主要成分为____ 。
(2)“浸出液”中加入H2O2后,为检测Fe2+是否完全被氧化,最佳试剂为____ ;加入氨水发生反应的离子方程式为_________________ 。
(3)为减少Li2CO3的溶解损失,“操作3”应为蒸发浓缩、______ 、洗涤、干燥。
(4)将CoC2O4·2H2O样品于空气中加热,样品质量随温度变化的曲线如图所示,曲线中300℃及以上所得固体为钴的氧化物。实验室中应置于______ (填仪器名称)焙烧样品。通过计算确定C点剩余固体的化学成分为_______ ;试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_______________ 。


已知:①Fe、Co、Ni为同族元素,化学性质相似
②Li2CO3微溶于水,其饱和溶液的物质的量浓度与温度关系如表所示
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
(1)流程中残渣M的主要成分为
(2)“浸出液”中加入H2O2后,为检测Fe2+是否完全被氧化,最佳试剂为
(3)为减少Li2CO3的溶解损失,“操作3”应为蒸发浓缩、
(4)将CoC2O4·2H2O样品于空气中加热,样品质量随温度变化的曲线如图所示,曲线中300℃及以上所得固体为钴的氧化物。实验室中应置于

您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐2】铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。某厂以硅铍石(主要含有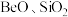 ,还有少量
,还有少量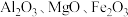 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以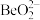 的形式存在;
的形式存在;
②氯化铍在熔融态时较难电离;
③ 为离子化合物,熔点为
为离子化合物,熔点为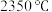 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;
④不同金属离子在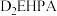 中的溶解性如表所示:
中的溶解性如表所示:
(1)“滤渣”的主要成分为_______ (填化学式)。
(2)“萃取分液”除去的离子主要是_______ 。若铍的萃取按如下反应式进行: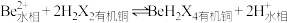 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为_______ 。
(3)“煮沸”时,发生反应的离子方程式为_______ 。
(4)写出高温条件下“转化”的化学方程式:_______ 。
(5)“电解”制铍时,加入与 等物质的量的
等物质的量的 的作用是
的作用是_______ ,不用电解 的方法制金属铍的原因是
的方法制金属铍的原因是_______ 。
 ,还有少量
,还有少量 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。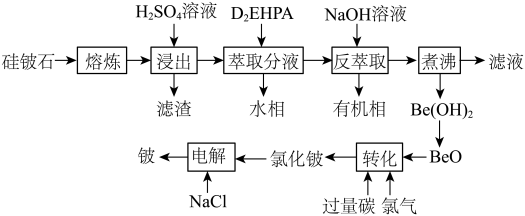
 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以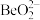 的形式存在;
的形式存在;②氯化铍在熔融态时较难电离;
③
 为离子化合物,熔点为
为离子化合物,熔点为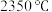 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;④不同金属离子在
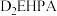 中的溶解性如表所示:
中的溶解性如表所示:金属离子 |
|
|
|
|
| 易溶 | 难溶 | 微溶 | 微溶 |
(1)“滤渣”的主要成分为
(2)“萃取分液”除去的离子主要是
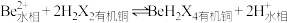 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为(3)“煮沸”时,发生反应的离子方程式为
(4)写出高温条件下“转化”的化学方程式:
(5)“电解”制铍时,加入与
 等物质的量的
等物质的量的 的作用是
的作用是 的方法制金属铍的原因是
的方法制金属铍的原因是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
【推荐3】 可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。
回答下列问题:
(1) 的价层电子排布图
的价层电子排布图_______ ,“酸浸”过程中,滤渣1的主要成分为S、_______ (填化学式)。
(2)“酸浸”过程中 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。_______ 。
②80~100min时, 浓度上升的原因可能是
浓度上升的原因可能是_______ 。
(3)“沉铁”过程中依次加入的试剂X、Y为_______ (填字母)。
A.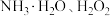 B.
B. C.
C.
(4)“滤液”萃取前调 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,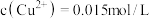 多次萃取后水相中
多次萃取后水相中 为
为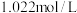 ,则铜的萃取率为
,则铜的萃取率为_______ (结果保留小数点后一位,溶液体积变化忽略不计)。
(5)利用 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:_______ 。
(6)结合图像分析,若要获得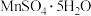 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热_______ 得到_______ ℃饱和溶液,_______ ,过滤酒精洗涤,低温干燥。
 可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。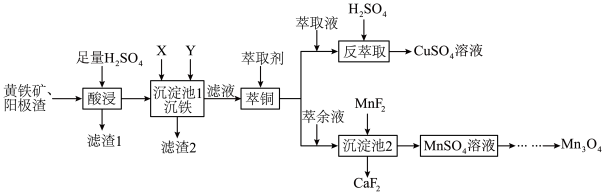
 |  |  |  | |
| 完全沉淀时的pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)
 的价层电子排布图
的价层电子排布图(2)“酸浸”过程中
 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。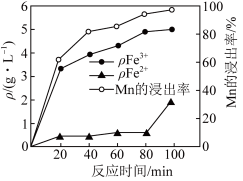
②80~100min时,
 浓度上升的原因可能是
浓度上升的原因可能是(3)“沉铁”过程中依次加入的试剂X、Y为
A.
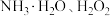 B.
B. C.
C.
(4)“滤液”萃取前调
 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,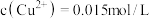 多次萃取后水相中
多次萃取后水相中 为
为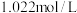 ,则铜的萃取率为
,则铜的萃取率为(5)利用
 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:(6)结合图像分析,若要获得
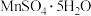 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热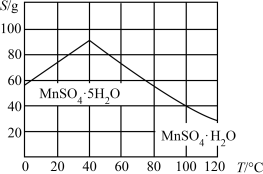
您最近一年使用:0次