盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
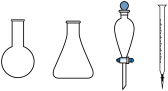
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示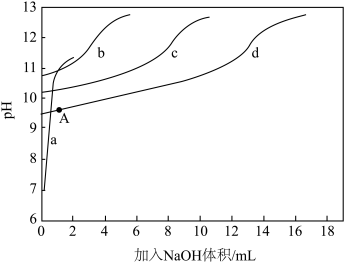
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
更新时间:2024-04-19 20:02:37
|
相似题推荐
填空题
|
困难
(0.15)
解题方法
【推荐1】(I)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
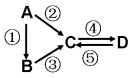
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式___________________________ 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式______________ 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式________________________ 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式________________________ 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式______________________________________________ 。
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。
则:α1+α2=_________________ ,p=________________ mol,b+c="_______________ kJ" 。
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________ 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_________ ,最难结合质子的是____________ 。
(3)完成下列反应的离子方程式HA(过量)+C3-:________________________________ 。
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显______________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________ 。

(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g)
 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是
(3)完成下列反应的离子方程式HA(过量)+C3-:
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显
您最近半年使用:0次
填空题
|
困难
(0.15)
名校
解题方法
【推荐2】完成下列问题
(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加入Na3P04,先生成___________ 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=____________ mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
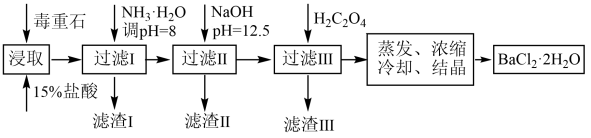
①毒重石用盐酸浸取前需充分研磨,目的是_____________________ 。
②加入NH3·H2O调节PH=8可除去_____________ (填离子符号),滤渣II中含____________ (填化学式)。加入H2C2O4时应避免过量,原因是_________________ 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是

(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加入Na3P04,先生成
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

①毒重石用盐酸浸取前需充分研磨,目的是
②加入NH3·H2O调节PH=8可除去
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是

| A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大 |
您最近半年使用:0次
填空题
|
困难
(0.15)
解题方法
【推荐1】按要求填空:
Ⅰ.醋酸是常见的弱酸。用0.1 mol•L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol•L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。
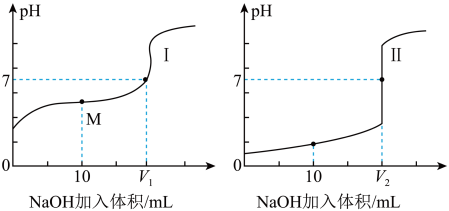
(1)滴定醋酸的曲线是_________ (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是_______________ 。
(3)V1和V2的关系:V1_________ V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是______________ 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(5)通过计算确定C点剩余固体的化学成分为_______ (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式:______________________________ 。
(6)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比_________ 。
Ⅰ.醋酸是常见的弱酸。用0.1 mol•L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol•L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。

(1)滴定醋酸的曲线是
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是
(3)V1和V2的关系:V1
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(5)通过计算确定C点剩余固体的化学成分为
(6)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比
您最近半年使用:0次
填空题
|
困难
(0.15)
【推荐2】25℃时,电离平衡常数:
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,e.Na2C4H4O6;物质的量浓度由大到小的顺序是________________ (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH==__________ (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
(4)写出少量的CO2通入NaClO溶液中的化学方程式____________________________ 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)=________________________ 。(用准确的数值表示)
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,e.Na2C4H4O6;物质的量浓度由大到小的顺序是
(2)常温下,0.1mol/L的CH3COOH溶液的pH==
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
| A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-) |
| B.c(Na+) > c(HCO3-)>c(ClO-) > c(H+) |
| C.c(Na+) ==" c(HClO)" +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-) |
| D.c(Na+) + c(H+)== c(ClO-)+ c(HCO3-) + 2c(CO32-) |
| E.c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-) |
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)=
您最近半年使用:0次
填空题
|
困难
(0.15)
名校
解题方法
【推荐3】未来脑教学云平台*按要求回答下列问题∶
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是___________ (填字母)。
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中 不变
不变
D. 溶液中 将减小
将减小
E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1∶V2=___________ (忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是____________ (填字母)。
A.若混合后溶液呈中性,则c(H+)+c (OH-)=2×10-7h$mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有∶c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c (OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示∶
①写出向NaClO溶液中通入少量CO2的离子方程式___________________ 。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是________ (填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)= ________________ (填准确数值)。
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于_______________ 。
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中
 不变
不变D. 溶液中
 将减小
将减小E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1∶V2=
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是_
A.若混合后溶液呈中性,则c(H+)+c (OH-)=2×10-7h$mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有∶c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c (OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示∶
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)= _
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于
您最近半年使用:0次



