名校
1 . I.请用下列10种物质的序号填空。
①N2 ②NH4Cl ③RbOH ④ ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气
(1)既含离子键又含共价键的是___________ ;只含共价键的的是___________ ;④的电子式为___________ ;⑦的空间构型为:___________ 。
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑭回答下列问题。
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:___________ (填元素符号)。
ii.能作为卤素非金属性递变规律的判断依据的是:___________ 。
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因___________ 。
(3)下列关于②~⑤元素叙述正确的是___________。
(4)③⑧⑩元素最高价氧化物对应的水化物之间可以两两发生反应,其中能体现水化物呈“两性”的离子方程式分别为___________ 、___________ 。
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是___________ (用化学式表示)。
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为___________ (用相应的离子符号排序)。
(7)用电子式表示①和⑦形成化合物的过程___________ ,该化合物与水反应的化学方程式是___________ 。
①N2 ②NH4Cl ③RbOH ④
 ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气(1)既含离子键又含共价键的是
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
| 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ⑨ | ⑪ | |||||
| 3 | ③ | ⑥ | ⑧ | ⑩ | ⑫ | |||
| 4 | ④ | ⑦ | ⑬ | |||||
| 5 | ⑤ | ⑭ |
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:
ii.能作为卤素非金属性递变规律的判断依据的是:
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因
(3)下列关于②~⑤元素叙述正确的是___________。
| A.从上到下②~⑤单质与水反应越来越剧烈 |
| B.②~⑤单质与氧气反应均可生成过氧化物 |
| C.从上到下②~⑤单质熔沸点逐渐升高 |
| D.②~⑤元素的最高价氧化物的水化物碱性增强 |
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为
(7)用电子式表示①和⑦形成化合物的过程
您最近一年使用:0次
2 . 含氮化合物是化工、能源、环保等领域的研究热点。
(1)工业上常用NH3和CO2合成尿素[CO(NH2)2],利用该反应可以在一定程度上减缓温室效应。该反应可分两步进行,其能量变化和反应历程如图所示___________ ;
②合成尿素总反应自发进行的条件是___________ (填“高温”或“低温”)。
(2)一定温度下,将NH3和CO2按2:1的物质的量之比充入一容积恒为10L的密闭容器中发生总反应。15min时达到平衡,各物质的浓度变化曲线如图所示。___________ g min﹣1。
min﹣1。
②下列叙述中能说明该反应达到平衡状态的是___________ (填选项字母)。
A.体系压强不再变化
B.NH3和CO2的浓度之比为2:1
C.气体平均摩尔质量不再变化
D.NH3的消耗速率和CO2的消耗速率之比为2:1
③25min时再向容器中充入2mol的NH3、1molCO2和2molH2O,则此时平衡___________ (填“正向移动”或“逆向移动”),再次平衡时总反应的平衡常数为 ___________ 。
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其化学方程式为2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH<0。当固定比例的NO(g)和H2(g)的混合气体,以相同流速分别通过填充有两种催化剂的反应器,测得NO的转化率与温度的关系如图所示。___________ 。
②M、N、P、Q四点中一定未达到平衡状态的是___________ (填字母)。
(1)工业上常用NH3和CO2合成尿素[CO(NH2)2],利用该反应可以在一定程度上减缓温室效应。该反应可分两步进行,其能量变化和反应历程如图所示

②合成尿素总反应自发进行的条件是
(2)一定温度下,将NH3和CO2按2:1的物质的量之比充入一容积恒为10L的密闭容器中发生总反应。15min时达到平衡,各物质的浓度变化曲线如图所示。

 min﹣1。
min﹣1。②下列叙述中能说明该反应达到平衡状态的是
A.体系压强不再变化
B.NH3和CO2的浓度之比为2:1
C.气体平均摩尔质量不再变化
D.NH3的消耗速率和CO2的消耗速率之比为2:1
③25min时再向容器中充入2mol的NH3、1molCO2和2molH2O,则此时平衡
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量NO。中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其化学方程式为2NO(g)+2H2(g)⇌N2(g)+2H2O(g) ΔH<0。当固定比例的NO(g)和H2(g)的混合气体,以相同流速分别通过填充有两种催化剂的反应器,测得NO的转化率与温度的关系如图所示。
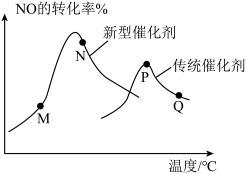
②M、N、P、Q四点中一定未达到平衡状态的是
您最近一年使用:0次
名校
3 . 碘在科研与生活中有重要作用。
Ⅰ.实验室按如下实验流程提取海带中的碘。___________ (从下列图中选择,写出名称)。___________ 。
(3)海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。
Ⅱ.测定反应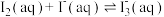 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。
(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
(4)Na2S2O3溶液也可以滴定 的原因是
的原因是___________ (用平衡移动原理回答);滴定终点的实验现象为___________ 。
(5)实验I中,c( )=
)=___________ mol/L(用含c1、c2、c3或c4的式子表示,下同),反应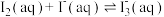 的平衡常数K=
的平衡常数K=___________ 。
(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将___________ (填“偏大”、“偏小”或“无影响”)。
Ⅰ.实验室按如下实验流程提取海带中的碘。


(3)海带灰中含有的其他可溶性无机盐,是在
Ⅱ.测定反应
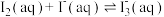 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol
 L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
| 碘量瓶 (实验Ⅰ) | 碘量瓶 (实验Ⅱ) | |
| 药品 | 0.5 g研细的碘,100 mL c2 mol L-1 KI L-1 KI | 0.5 g研细的碘,100 mL H2O |
| I2和I3-的总浓度 | c3 mol L-1 L-1 | c4 mol L-1 L-1 |
 的原因是
的原因是(5)实验I中,c(
 )=
)=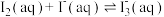 的平衡常数K=
的平衡常数K=(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将
您最近一年使用:0次
名校
4 . X、Y、Z、W、R为原子序数依次增大的短周期主族元素,元素X的原子核内只有1个质子,元素R的原子比元素W的原子多8个电子,由上述元素组成的一种化合物M的结构式如图所示。下列说法错误的是
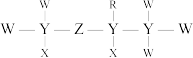
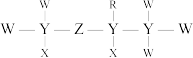
| A.M分子中含有极性共价键和非极性共价键 |
B.化合物 中的原子均满足8电子稳定结构 中的原子均满足8电子稳定结构 |
C.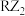 可用于自来水消毒 可用于自来水消毒 |
D. 分子呈正四面体形 分子呈正四面体形 |
您最近一年使用:0次
解题方法
5 . 铅(Pb)元素的主要化合价有+2价和+4价,溶液中铅为+2价(Pb2+或 ,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
(1)Pb3O4 俗名红丹,在涂料工业中用作防锈颜料,Pb3O4中+2价铅和+4价铅的原子个数之比为
(2)Pb、PbO2可用于制造铅蓄电池,铅蓄电池工作时的反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中还原产物为
(3)工业上利用铅渣(主要成分是PbO、Pb,以及少量不溶于硝酸的杂质)生产PbSO4的流程如图:
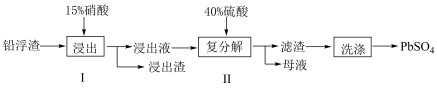
已知步骤1有NO产生,试写出Pb与硝酸反应的化学方程式
(4)血铅是指血液中铅元素的含量。血铅超标会引起机体的神经系统、血液系统、消化系统的一系列异常表现。某人血液中铅的浓度为0.4μg/mL,若转化为物质的量浓度为
您最近一年使用:0次
名校
6 . 钠的一系列化合物在生活与生产中有非常重要的作用,某学习小组开展了相关研究活动:
(1)甲同学欲配制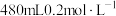 的
的 溶液,需要使用的玻璃仪器有
溶液,需要使用的玻璃仪器有____________ 、烧杯和胶头滴管;下列操作会使所配溶液浓度偏小的是______ 。
a.用托盘天平称量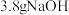 固体进行配制溶液
固体进行配制溶液
b.定容时俯视刻度线
c.未待溶解的 浓溶液冷却即转移至相应容器进行后继操作
浓溶液冷却即转移至相应容器进行后继操作
d.定容摇匀后发现液面低于刻度线,再次加入蒸馏水至刻度线
(2)乙同学欲比较 固体和
固体和 固体的热稳定性,设计实验装置如下图:
固体的热稳定性,设计实验装置如下图:
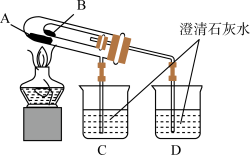
① 烧杯中的现象是
烧杯中的现象是____________
② 处应放置的药品是
处应放置的药品是____________
③热稳定性:
______  (大于、小于)
(大于、小于)
(3)丙同学为探究 的强氧化性,某设计了下图实验装置。
的强氧化性,某设计了下图实验装置。
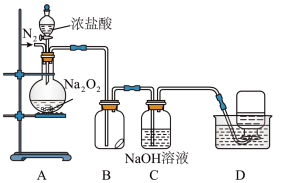
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的 后,封闭
后,封闭 气体通路,将装置
气体通路,将装置 连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,
连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸, 中剧烈反应,有黄绿色气体产生。
中剧烈反应,有黄绿色气体产生。
Ⅱ.待产生连续气泡后,将装置 中的导管末端伸入集气瓶中,收集到无色气体。
中的导管末端伸入集气瓶中,收集到无色气体。
①. 中气体能使带火星的木条复燃,丙同学分析该气体不可能由
中气体能使带火星的木条复燃,丙同学分析该气体不可能由 还原
还原 所得,从氧化还原角度说明理由:
所得,从氧化还原角度说明理由:______ 。
②.资料显示, 也能与干燥
也能与干燥 反应产生
反应产生 ,写出反应的化学方程式
,写出反应的化学方程式______
(1)甲同学欲配制
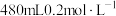 的
的 溶液,需要使用的玻璃仪器有
溶液,需要使用的玻璃仪器有a.用托盘天平称量
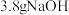 固体进行配制溶液
固体进行配制溶液b.定容时俯视刻度线
c.未待溶解的
 浓溶液冷却即转移至相应容器进行后继操作
浓溶液冷却即转移至相应容器进行后继操作d.定容摇匀后发现液面低于刻度线,再次加入蒸馏水至刻度线
(2)乙同学欲比较
 固体和
固体和 固体的热稳定性,设计实验装置如下图:
固体的热稳定性,设计实验装置如下图:
①
 烧杯中的现象是
烧杯中的现象是②
 处应放置的药品是
处应放置的药品是③热稳定性:

 (大于、小于)
(大于、小于)(3)丙同学为探究
 的强氧化性,某设计了下图实验装置。
的强氧化性,某设计了下图实验装置。
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的
 后,封闭
后,封闭 气体通路,将装置
气体通路,将装置 连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,
连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸, 中剧烈反应,有黄绿色气体产生。
中剧烈反应,有黄绿色气体产生。Ⅱ.待产生连续气泡后,将装置
 中的导管末端伸入集气瓶中,收集到无色气体。
中的导管末端伸入集气瓶中,收集到无色气体。①.
 中气体能使带火星的木条复燃,丙同学分析该气体不可能由
中气体能使带火星的木条复燃,丙同学分析该气体不可能由 还原
还原 所得,从氧化还原角度说明理由:
所得,从氧化还原角度说明理由:②.资料显示,
 也能与干燥
也能与干燥 反应产生
反应产生 ,写出反应的化学方程式
,写出反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 填空题
(一)某同学欲验证 与
与 的金属性强弱,设计实验如下:
的金属性强弱,设计实验如下:
依据上述实验设计,回答下列问题:
(1)铝元素在周期表中的位置为第______ 周期______ 族;
(2)上述实验试管 中的实验现象为
中的实验现象为_________________________ ;
(3)写出试管 中白色沉淀溶解的离子反应方程式
中白色沉淀溶解的离子反应方程式______________________ ;
(4)上述实验现象证明碱性:
______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(二)某同学欲验证 、
、 、
、 的氧化性强弱,实验操作如下:
的氧化性强弱,实验操作如下:
Ⅰ.向盛有 和
和 混合液的试管
混合液的试管 中通入少量氯气,振荡观察;
中通入少量氯气,振荡观察;
Ⅱ.向盛有淀粉 混合液的试管
混合液的试管 中加入少量
中加入少量 溶液,振荡观察;
溶液,振荡观察;
(5) 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为____________
(6)试管 中通入少量氯气后的实验现象是
中通入少量氯气后的实验现象是______________________________
(7)写出试管 中发生的离子反应
中发生的离子反应______________________________
(一)某同学欲验证
 与
与 的金属性强弱,设计实验如下:
的金属性强弱,设计实验如下:实验操作 | 实验现象 | 反应或结论 |
Ⅰ.向试管 | ① |
|
Ⅱ.向试管 | 试管中先出现白色沉淀,后白色沉淀溶解 | ② |
(1)铝元素在周期表中的位置为第
(2)上述实验试管
 中的实验现象为
中的实验现象为(3)写出试管
 中白色沉淀溶解的离子反应方程式
中白色沉淀溶解的离子反应方程式(4)上述实验现象证明碱性:

 (填“>”“<”或“=”)
(填“>”“<”或“=”) (二)某同学欲验证
 、
、 、
、 的氧化性强弱,实验操作如下:
的氧化性强弱,实验操作如下:Ⅰ.向盛有
 和
和 混合液的试管
混合液的试管 中通入少量氯气,振荡观察;
中通入少量氯气,振荡观察;Ⅱ.向盛有淀粉
 混合液的试管
混合液的试管 中加入少量
中加入少量 溶液,振荡观察;
溶液,振荡观察;(5)
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(6)试管
 中通入少量氯气后的实验现象是
中通入少量氯气后的实验现象是(7)写出试管
 中发生的离子反应
中发生的离子反应
您最近一年使用:0次
名校
解题方法
8 . 为应对气候变化,我国提出“二氧化碳排放力争于2030年前达到峰值”庄严的承诺。下列行为无助“碳达峰”的是
| A.火力发电厂的烟气用于联合制碱法 |
| B.干冰用于人工降雨 |
| C.关、停、并、转高耗能企业 |
| D.日常生活中节约用电、用纸、绿色出行 |
您最近一年使用:0次
名校
9 . 化合物ⅸ是一种烯丙胺类抗真菌药物,可用于皮肤浅部真菌感染的治疗,它的一种合成路线如下:
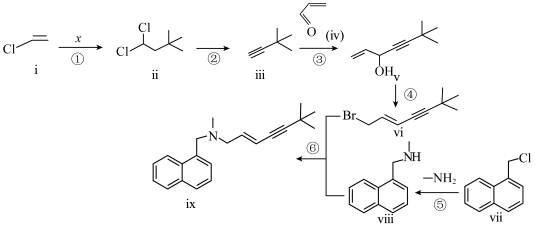
(1)根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表:
(2)反应①中,化合物ⅰ与有机物x反应,生成化合物ⅱ,原子利用率为100%,x为___________ (写结构简式)。
(3)化合物ⅳ中含氧官能团的名称是___________ ,反应③的类型是___________ 。
(4)关于反应⑤的说法中,不正确的有___________。
(5)化合物ⅲ有多种同分异构体,其中含 结构的有
结构的有___________ 种(不考虑立体异构),核磁共振氢谱图上只有两组峰的结构简式为___________ 。
(6)以苯乙烯和乙醛为含碳原料,利用反应③的原理,通过四步反应合成结构简式如下的化合物y,基于你设计的合成路线,回答下列问题:

(a)从苯乙烯出发,第一步反应的化学方程式为___________ 。
(b)合成路线中涉及两步消去反应,最后一步通过消去反应得到产物的化学方程式为___________ (注明反应条件)。

(1)根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表:
| 序号 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
| a | 消去反应 | ||
| b | 取代反应 |
(2)反应①中,化合物ⅰ与有机物x反应,生成化合物ⅱ,原子利用率为100%,x为
(3)化合物ⅳ中含氧官能团的名称是
(4)关于反应⑤的说法中,不正确的有___________。
A.反应过程中,有 键和 键和 键断裂 键断裂 | B.反应过程中,有 键和 键和 键的形成 键的形成 |
| C.反应物ⅶ中,所有原子可能处于同一平面上 | D.生成物ⅷ具有碱性,能与稀盐酸发生反应 |
(5)化合物ⅲ有多种同分异构体,其中含
 结构的有
结构的有(6)以苯乙烯和乙醛为含碳原料,利用反应③的原理,通过四步反应合成结构简式如下的化合物y,基于你设计的合成路线,回答下列问题:

(a)从苯乙烯出发,第一步反应的化学方程式为
(b)合成路线中涉及两步消去反应,最后一步通过消去反应得到产物的化学方程式为
您最近一年使用:0次
10 . 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 液氨常用作制冷剂 | 氨分子间能形成氢键 |
| B | 电解氯化镁溶液可制得金属 |  可在电解池的阴极还原成 可在电解池的阴极还原成 |
| C | 热的 溶液可去除油污 溶液可去除油污 |  能与油污中的羧基反应 能与油污中的羧基反应 |
| D |  的硫酸中 的硫酸中 浓度大于同 浓度大于同 的醋酸 的醋酸 | 硫酸是强酸,醋酸是弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 溶液,再逐滴滴入
溶液,再逐滴滴入 溶液,再逐滴滴入
溶液,再逐滴滴入

