解题方法
1 . 为探究铜的化合物有关性质,现进行如下实验。
回答下列问题:
(1)由 配制实验I中的
配制实验I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是_______ (填仪器名称),定容后还需要进行的操作为_______ 。_______ 。
(3)实验Ⅱ未观察到蓝色絮状沉淀,猜想原因是实验Ⅱ取用的 溶液浓度太低。查阅资料得:
溶液浓度太低。查阅资料得: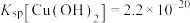 ,通过计算否定该猜想
,通过计算否定该猜想_______ 。
(4)实验Ⅲ生成蓝色絮状沉淀的离子方程式为_______ 。
(5)查阅资料:烯醛类物质易形成亮黄色树脂状化合物,微溶于水。实验Ⅳ中产生烯醛类物质的结构简式为_______ 。
(6)实验Ⅴ的现象为_______ 。
序号 | 实验操作 | 实验现象 |
Ⅰ | 将绿豆大的钠放入装有100mL 0.2  溶液的烧杯中 溶液的烧杯中 | |固体溶解,有气泡冒出,有蓝色絮状沉淀 |
Ⅱ | 取实验I等量的钠放入装有100mL 0.002  溶液的烧杯中 溶液的烧杯中 | 固体溶解,有气泡冒出,无蓝色絮状沉淀,测得溶液pH=9 |
Ⅲ | 取实验Ⅱ反应后的溶液于试管中,逐滴加入0.1 HCl溶液 HCl溶液 | 先出现蓝色絮状沉淀,后沉淀溶解 |
Ⅳ | 取实验Ⅰ反应后的溶液于试管中,振荡,加入0.5mL乙醛溶液,加热 | 试管底部出现砖红色沉淀,上层悬浊液呈现亮黄色 |
Ⅴ | 取实验I反应后的溶液于试管中,振荡,加入0.5mL甲醛溶液,加热 |
(1)由
 配制实验I中的
配制实验I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
(3)实验Ⅱ未观察到蓝色絮状沉淀,猜想原因是实验Ⅱ取用的
 溶液浓度太低。查阅资料得:
溶液浓度太低。查阅资料得: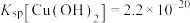 ,通过计算否定该猜想
,通过计算否定该猜想(4)实验Ⅲ生成蓝色絮状沉淀的离子方程式为
(5)查阅资料:烯醛类物质易形成亮黄色树脂状化合物,微溶于水。实验Ⅳ中产生烯醛类物质的结构简式为
(6)实验Ⅴ的现象为
您最近一年使用:0次
7日内更新
|
419次组卷
|
4卷引用:2025届广东省广州市高三上学期8月第一次调研考试化学试卷
2 . 21世纪,我国航天事业取得举世瞩目的科技成果,其中火箭推进剂的研究和发展功不可没。固体推进剂是火箭发动机的动力源。
Ⅰ.黑火药是我国古代“四大发明”之一,曾作为军事火箭的推进剂,距今已有1000年历史。
(1)黑火药爆炸时的反应普遍被认为是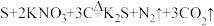 ,则若该反应每产生
,则若该反应每产生 气体,转移电子总数为
气体,转移电子总数为______________ mol。
Ⅱ.高氯酸铵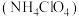 具有较高的燃烧性能,可用作固体火箭推进剂。实验室制备高氯酸铵的过程主要有以下(1)(2)两个关键步骤。
具有较高的燃烧性能,可用作固体火箭推进剂。实验室制备高氯酸铵的过程主要有以下(1)(2)两个关键步骤。
ⅰ.用 溶液吸收
溶液吸收 得到,然后通过两步电解实现
得到,然后通过两步电解实现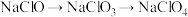 的转化.已知当外接电源的电压大于两极的理论电解电势差时,可实现该两极反应的进行。
的转化.已知当外接电源的电压大于两极的理论电解电势差时,可实现该两极反应的进行。
(2)参考下表相关数据,若通过电解 溶液得到
溶液得到 ,需要控制外接电源的理论电压至少为
,需要控制外接电源的理论电压至少为______________  ,该反应过程的离子方程式为
,该反应过程的离子方程式为______________ 。
(3)根据如图所示溶解度曲线图,向 溶液中通入
溶液中通入 和
和 气体,可析出
气体,可析出 晶体。从混合溶液中获得较多
晶体。从混合溶液中获得较多 晶体的实验操作依次为
晶体的实验操作依次为______________ 、______________ 、过滤、冰水洗涤、干燥。______________ >______________ (填写元素符号)。温度高于 时高氯酸铵完全分解,反应放出大量热,同时得到四种气体(三种单质和一种常见氧化物)。请写出高氯酸铵的热分解化学方程式
时高氯酸铵完全分解,反应放出大量热,同时得到四种气体(三种单质和一种常见氧化物)。请写出高氯酸铵的热分解化学方程式______________ 。
Ⅰ.黑火药是我国古代“四大发明”之一,曾作为军事火箭的推进剂,距今已有1000年历史。
(1)黑火药爆炸时的反应普遍被认为是
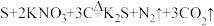 ,则若该反应每产生
,则若该反应每产生 气体,转移电子总数为
气体,转移电子总数为Ⅱ.高氯酸铵
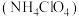 具有较高的燃烧性能,可用作固体火箭推进剂。实验室制备高氯酸铵的过程主要有以下(1)(2)两个关键步骤。
具有较高的燃烧性能,可用作固体火箭推进剂。实验室制备高氯酸铵的过程主要有以下(1)(2)两个关键步骤。ⅰ.用
 溶液吸收
溶液吸收 得到,然后通过两步电解实现
得到,然后通过两步电解实现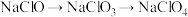 的转化.已知当外接电源的电压大于两极的理论电解电势差时,可实现该两极反应的进行。
的转化.已知当外接电源的电压大于两极的理论电解电势差时,可实现该两极反应的进行。(2)参考下表相关数据,若通过电解
 溶液得到
溶液得到 ,需要控制外接电源的理论电压至少为
,需要控制外接电源的理论电压至少为 ,该反应过程的离子方程式为
,该反应过程的离子方程式为| 电极 | 电极反应 | 理论电解电势 |
| 阴极 |  | -0.83 |
 | -2.71 | |
| 阳极 |  | +0.42 |
 | +0.36 | |
 | +1.00 |
(3)根据如图所示溶解度曲线图,向
 溶液中通入
溶液中通入 和
和 气体,可析出
气体,可析出 晶体。从混合溶液中获得较多
晶体。从混合溶液中获得较多 晶体的实验操作依次为
晶体的实验操作依次为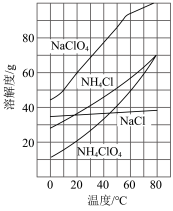
 时高氯酸铵完全分解,反应放出大量热,同时得到四种气体(三种单质和一种常见氧化物)。请写出高氯酸铵的热分解化学方程式
时高氯酸铵完全分解,反应放出大量热,同时得到四种气体(三种单质和一种常见氧化物)。请写出高氯酸铵的热分解化学方程式
您最近一年使用:0次
3 . 21世纪,我国航天事业取得举世瞩目的科技成果,其中火箭推进剂的研究和发展功不可没。火箭液体推进剂主要由燃烧剂和氧化剂混合而成。
Ⅰ.肼 又称联氨,是一种无色高度吸湿性的可燃液体。曾用肼与氧化剂
又称联氨,是一种无色高度吸湿性的可燃液体。曾用肼与氧化剂 混合用作火箭液体推进剂。
混合用作火箭液体推进剂。
已知: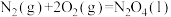 △H1
△H1
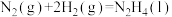 △H2
△H2
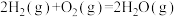 △H3
△H3
 △H4=-1048.9kJ/mol
△H4=-1048.9kJ/mol
(1)上述反应热效应之间的关系式为△H4=______________ (用代数式表示); 和
和 可混合用作火箭推进剂的主要原因为
可混合用作火箭推进剂的主要原因为______________ (至少答出两点)。
(2)氧化剂 与
与 相互转化的反应为
相互转化的反应为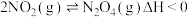 ,若正反应速率v正=k正p2(NO2),逆反应速率v逆=k逆p(N2O4),其中k正、k逆为速率常数,则该反应的平衡常数Kp=
,若正反应速率v正=k正p2(NO2),逆反应速率v逆=k逆p(N2O4),其中k正、k逆为速率常数,则该反应的平衡常数Kp=______________ (用 表示)。
表示)。
(3)已知气体颜色越深,透光率越小。取一支注射器针筒,吸入10mL二氧化氮气体。将针筒前端封闭,连接传感器,测定透光率;然后将针筒活塞迅速推至 处,再将针筒活塞迅速拉回
处,再将针筒活塞迅速拉回 处,测定活塞移动过程中透光率的变化,如图所示,下列说法正确的是_________(填写选项序号)。
处,测定活塞移动过程中透光率的变化,如图所示,下列说法正确的是_________(填写选项序号)。
Ⅱ.“长征五号”大型运载火箭成功发射升空,采用低温液氢、液氧做推进剂,填补了我国大推力无毒无污染液体火箭发动机的空白,实现了绿色环保的研制理念。
ⅰ.利用“一碳化学”技术通过以下两个反应可有效实现工业制氢,为推进剂提供丰富的氢燃料。
a.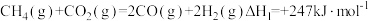
b.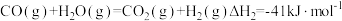
(4) 温度下往恒容密闭容器中通入相同物质的量
温度下往恒容密闭容器中通入相同物质的量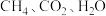 混合气体进行
混合气体进行 反应,初始压强为
反应,初始压强为 ,达到平衡时体系压强为170kPa,T1温度下
,达到平衡时体系压强为170kPa,T1温度下 的平衡转化率为
的平衡转化率为______________ 。
(5)若在某反应体系中 的平衡含量随温度
的平衡含量随温度 的变化如图所示,从化学平衡角度解释
的变化如图所示,从化学平衡角度解释 的平衡含量随温度
的平衡含量随温度 变化的原因
变化的原因______________ 。 )。
)。_______ (填写“X”或“ ”),
”), 电极上的电极反应式为
电极上的电极反应式为______________ 。
Ⅰ.肼
 又称联氨,是一种无色高度吸湿性的可燃液体。曾用肼与氧化剂
又称联氨,是一种无色高度吸湿性的可燃液体。曾用肼与氧化剂 混合用作火箭液体推进剂。
混合用作火箭液体推进剂。已知:
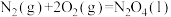 △H1
△H1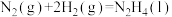 △H2
△H2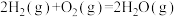 △H3
△H3 △H4=-1048.9kJ/mol
△H4=-1048.9kJ/mol(1)上述反应热效应之间的关系式为△H4=
 和
和 可混合用作火箭推进剂的主要原因为
可混合用作火箭推进剂的主要原因为(2)氧化剂
 与
与 相互转化的反应为
相互转化的反应为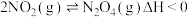 ,若正反应速率v正=k正p2(NO2),逆反应速率v逆=k逆p(N2O4),其中k正、k逆为速率常数,则该反应的平衡常数Kp=
,若正反应速率v正=k正p2(NO2),逆反应速率v逆=k逆p(N2O4),其中k正、k逆为速率常数,则该反应的平衡常数Kp= 表示)。
表示)。(3)已知气体颜色越深,透光率越小。取一支注射器针筒,吸入10mL二氧化氮气体。将针筒前端封闭,连接传感器,测定透光率;然后将针筒活塞迅速推至
 处,再将针筒活塞迅速拉回
处,再将针筒活塞迅速拉回 处,测定活塞移动过程中透光率的变化,如图所示,下列说法正确的是_________(填写选项序号)。
处,测定活塞移动过程中透光率的变化,如图所示,下列说法正确的是_________(填写选项序号)。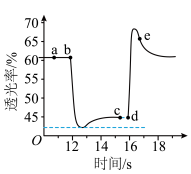
A. 点:v(正)>v(逆) 点:v(正)>v(逆) |
B. 点与 点与 点相比, 点相比,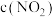 增大, 增大,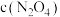 减小 减小 |
C.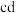 段透光率保持不变,说明反应达到平衡 段透光率保持不变,说明反应达到平衡 |
D.若不忽略体系温度变化,且没有能量损失,则b、 两点的平衡常数 两点的平衡常数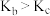 |
Ⅱ.“长征五号”大型运载火箭成功发射升空,采用低温液氢、液氧做推进剂,填补了我国大推力无毒无污染液体火箭发动机的空白,实现了绿色环保的研制理念。
ⅰ.利用“一碳化学”技术通过以下两个反应可有效实现工业制氢,为推进剂提供丰富的氢燃料。
a.
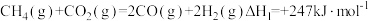
b.
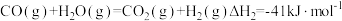
(4)
 温度下往恒容密闭容器中通入相同物质的量
温度下往恒容密闭容器中通入相同物质的量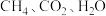 混合气体进行
混合气体进行 反应,初始压强为
反应,初始压强为 ,达到平衡时体系压强为170kPa,T1温度下
,达到平衡时体系压强为170kPa,T1温度下 的平衡转化率为
的平衡转化率为(5)若在某反应体系中
 的平衡含量随温度
的平衡含量随温度 的变化如图所示,从化学平衡角度解释
的变化如图所示,从化学平衡角度解释 的平衡含量随温度
的平衡含量随温度 变化的原因
变化的原因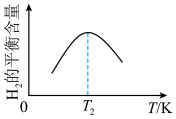
 )。
)。
 ”),
”), 电极上的电极反应式为
电极上的电极反应式为
您最近一年使用:0次
解题方法
4 . 物质的转化在生活、生产领域应用广泛。
已知 时
时
回答下列问题:
Ⅰ.碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中形成悬浊液,测得其 。
。
(1)静置后上层清液中,
______________ 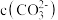 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)向悬浊液体系中通入 气体,溶液中
气体,溶液中
______________ (填“增大”“减小”或“保持不变”)。
Ⅱ.锅炉水垢严重影响锅炉使用寿命。为了除去水垢中的 ,可先用
,可先用 溶液处理,使
溶液处理,使 转化为疏松、易溶于酸的
转化为疏松、易溶于酸的 ,然后用酸除去。已知
,然后用酸除去。已知
(3)用过量 溶液浸泡数日(忽略浸泡后
溶液浸泡数日(忽略浸泡后 溶液的浓度变化),水垢中的
溶液的浓度变化),水垢中的 能否全部转化为
能否全部转化为 ?结合计算说明
?结合计算说明______________ (已知当溶液中剩余的离子浓度小于 时,认为转化反应进行完全)。
时,认为转化反应进行完全)。
(4)某同学以 溶液为例,探究不同浓度
溶液为例,探究不同浓度 与其水解程度之间的关系,利用计算机辅助作图如图,通过图示可知
与其水解程度之间的关系,利用计算机辅助作图如图,通过图示可知______________ 。 ,利用白云石制备碳酸钙和氧化镁的部分流程如下:
,利用白云石制备碳酸钙和氧化镁的部分流程如下:______________ 。
(6)“沉钙”反应的离子方程式为______________ 。
(7)该流程中可循环利用的物质有______________ (填写物质的化学式)。
已知
 时
时| 物质 |  |  |  |  |  |
 | 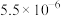 |  |  | 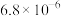 | 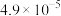 |
Ⅰ.碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中形成悬浊液,测得其
 。
。(1)静置后上层清液中,

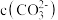 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)向悬浊液体系中通入
 气体,溶液中
气体,溶液中
Ⅱ.锅炉水垢严重影响锅炉使用寿命。为了除去水垢中的
 ,可先用
,可先用 溶液处理,使
溶液处理,使 转化为疏松、易溶于酸的
转化为疏松、易溶于酸的 ,然后用酸除去。已知
,然后用酸除去。已知(3)用过量
 溶液浸泡数日(忽略浸泡后
溶液浸泡数日(忽略浸泡后 溶液的浓度变化),水垢中的
溶液的浓度变化),水垢中的 能否全部转化为
能否全部转化为 ?结合计算说明
?结合计算说明 时,认为转化反应进行完全)。
时,认为转化反应进行完全)。(4)某同学以
 溶液为例,探究不同浓度
溶液为例,探究不同浓度 与其水解程度之间的关系,利用计算机辅助作图如图,通过图示可知
与其水解程度之间的关系,利用计算机辅助作图如图,通过图示可知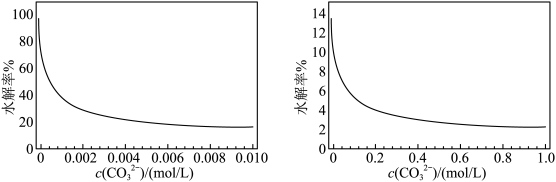
 ,利用白云石制备碳酸钙和氧化镁的部分流程如下:
,利用白云石制备碳酸钙和氧化镁的部分流程如下: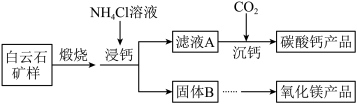
(6)“沉钙”反应的离子方程式为
(7)该流程中可循环利用的物质有
您最近一年使用:0次
解题方法
5 . 由一种含氟废酸(pH=2,主要离子有F-、 、Fe3+、Zn2+)生产冰晶石
、Fe3+、Zn2+)生产冰晶石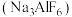 的工艺流程如下图所示:
的工艺流程如下图所示: 下:
下: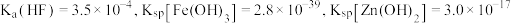 ,下列相关说法不正确的是
,下列相关说法不正确的是
 、Fe3+、Zn2+)生产冰晶石
、Fe3+、Zn2+)生产冰晶石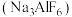 的工艺流程如下图所示:
的工艺流程如下图所示: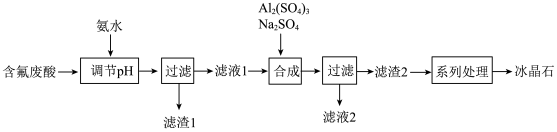
 下:
下: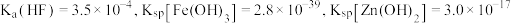 ,下列相关说法不正确的是
,下列相关说法不正确的是A.含氟废酸中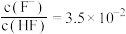 |
B.“调节 ”约为8时,“滤渣1”的主要成分为 ”约为8时,“滤渣1”的主要成分为 和 和 |
| C.“合成”过程中,溶液应保持强碱性 |
D.“滤液2”含有的主要溶质是 |
您最近一年使用:0次
解题方法
6 . 甲醇是一种重要的化工原料和燃料。利用 和
和 生成甲醇的反应如下:
生成甲醇的反应如下:
反应Ⅰ:

反应Ⅱ:
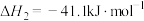
已知:几种化学键的键能数据如下表所示。
(1)结合上表数据,
_______  。反应Ⅱ能自发进行的条件是
。反应Ⅱ能自发进行的条件是_______ (填“低温”“高温”或“任意温度”)。
(2)在120℃,体积恒定的密闭容器中发生反应Ⅰ和Ⅱ。
①若达到平衡后,增大体系的压强,则CO的物质的量_______ (填“增大”“减小”或“不变”),原因是_______ 。
②若通入1mol 和2.5mol
和2.5mol  混合气体,起始压强为0.35MPa,发生反应Ⅰ和Ⅱ.平衡时,总压为0.25MPa,
混合气体,起始压强为0.35MPa,发生反应Ⅰ和Ⅱ.平衡时,总压为0.25MPa, 的转化率为60%,则反应Ⅱ的压强平衡常数
的转化率为60%,则反应Ⅱ的压强平衡常数
_______ 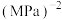 (分压=总压×物质的量分数,列出计算式即可)。
(分压=总压×物质的量分数,列出计算式即可)。
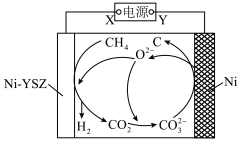
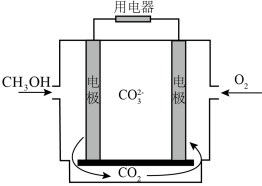
(3)某研究小组自制熔融碳酸盐甲醇燃料电池,工作原理如图所示:_______ 。
②该电池以恒定电流I A工作t min,测得化学能转化为电能的转化率为 ,则消耗甲醇
,则消耗甲醇_______ kg(已知:一个电子的电量为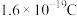 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
 和
和 生成甲醇的反应如下:
生成甲醇的反应如下:反应Ⅰ:


反应Ⅱ:

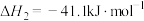
已知:几种化学键的键能数据如下表所示。
化学键 |
|
|
|
|
键能/ | 436 | 803 | 1071 | 463 |
(1)结合上表数据,

 。反应Ⅱ能自发进行的条件是
。反应Ⅱ能自发进行的条件是(2)在120℃,体积恒定的密闭容器中发生反应Ⅰ和Ⅱ。
①若达到平衡后,增大体系的压强,则CO的物质的量
②若通入1mol
 和2.5mol
和2.5mol  混合气体,起始压强为0.35MPa,发生反应Ⅰ和Ⅱ.平衡时,总压为0.25MPa,
混合气体,起始压强为0.35MPa,发生反应Ⅰ和Ⅱ.平衡时,总压为0.25MPa, 的转化率为60%,则反应Ⅱ的压强平衡常数
的转化率为60%,则反应Ⅱ的压强平衡常数
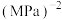 (分压=总压×物质的量分数,列出计算式即可)。
(分压=总压×物质的量分数,列出计算式即可)。(3)某研究小组自制熔融碳酸盐甲醇燃料电池,工作原理如图所示:
②该电池以恒定电流I A工作t min,测得化学能转化为电能的转化率为
 ,则消耗甲醇
,则消耗甲醇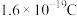 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
7日内更新
|
529次组卷
|
4卷引用:2025届广东省广州市高三上学期8月第一次调研考试化学试卷
7 . 硫酸铁铵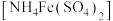 是一种重要的铁盐,可用如下流程制备:
是一种重要的铁盐,可用如下流程制备:
(1)硫酸铁铵含有的阳离子是___________ (填离子符号),其中氮元素显___________ 价。
(2)步骤②中得到 的反应的离子方程式为
的反应的离子方程式为___________ 。实验室中常用___________ (填化学式)检验溶液中的 ,实验现象为
,实验现象为___________ 。
(3)若溶液Ⅰ中含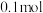 硫酸铁,为保证转化完全,步骤③中至少需加入
硫酸铁,为保证转化完全,步骤③中至少需加入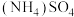
___________ g。
(4)步骤④的主要操作是先加热浓缩、冷却结晶,再___________ (填实验操作),可得到硫酸铁铵晶体。
(5)取适量酸性 溶液于试管中,滴入溶液Ⅰ,观察到溶液褪色且有气泡产生,该反应的离子方程式为
溶液于试管中,滴入溶液Ⅰ,观察到溶液褪色且有气泡产生,该反应的离子方程式为___________ 。
(6)请以硫酸铁溶液为原料,设计制备铁红的实验方案:___________ 。(示例: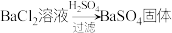 )
)
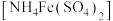 是一种重要的铁盐,可用如下流程制备:
是一种重要的铁盐,可用如下流程制备: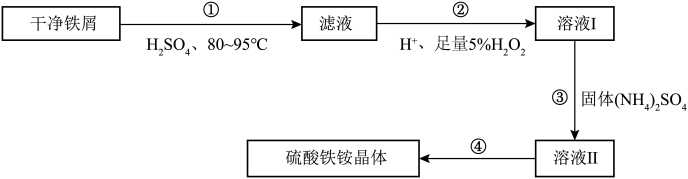
(1)硫酸铁铵含有的阳离子是
(2)步骤②中得到
 的反应的离子方程式为
的反应的离子方程式为 ,实验现象为
,实验现象为(3)若溶液Ⅰ中含
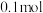 硫酸铁,为保证转化完全,步骤③中至少需加入
硫酸铁,为保证转化完全,步骤③中至少需加入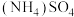
(4)步骤④的主要操作是先加热浓缩、冷却结晶,再
(5)取适量酸性
 溶液于试管中,滴入溶液Ⅰ,观察到溶液褪色且有气泡产生,该反应的离子方程式为
溶液于试管中,滴入溶液Ⅰ,观察到溶液褪色且有气泡产生,该反应的离子方程式为(6)请以硫酸铁溶液为原料,设计制备铁红的实验方案:
 )
)
您最近一年使用:0次
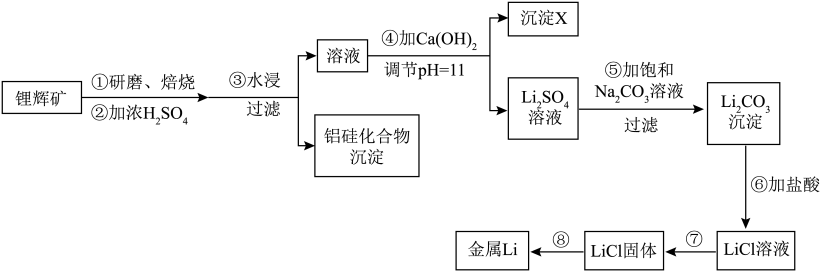
8 . 工业上用浓硫酸与锂辉矿(主要含Li、Al、Si元素,还含有少量Mg元素)为原料制得储氢材料Li.工艺流程如下:___________ 。
(2)已知锂辉矿与浓硫酸焙烧会得到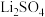 、
、 和铝硅化合物,则沉淀X的主要成分为
和铝硅化合物,则沉淀X的主要成分为___________ (填化学式)。
(3)流程第⑤步生成 的离子方程式是
的离子方程式是___________ 。
(4) 的电子式为
的电子式为___________ 。流程第⑧步电解熔融 制金属Li时,需确保反应环境无水无氧,请用化学方程式解释原因:
制金属Li时,需确保反应环境无水无氧,请用化学方程式解释原因:___________ 。
(5)金属Li通过与氢气化合成 来储氢。
来储氢。 会与水反应放出氢气,该反应的化学方程式是
会与水反应放出氢气,该反应的化学方程式是___________ ;若生成标准状况下44.8L氢气,则该反应转移电子的数目约为___________ (用 表示)。
表示)。
(2)已知锂辉矿与浓硫酸焙烧会得到
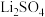 、
、 和铝硅化合物,则沉淀X的主要成分为
和铝硅化合物,则沉淀X的主要成分为(3)流程第⑤步生成
 的离子方程式是
的离子方程式是(4)
 的电子式为
的电子式为 制金属Li时,需确保反应环境无水无氧,请用化学方程式解释原因:
制金属Li时,需确保反应环境无水无氧,请用化学方程式解释原因:(5)金属Li通过与氢气化合成
 来储氢。
来储氢。 会与水反应放出氢气,该反应的化学方程式是
会与水反应放出氢气,该反应的化学方程式是 表示)。
表示)。
您最近一年使用:0次
9 . 某小组利用下图装置制备 和
和 ,并探究其氧化还原性质。已知氯气与碱液在温度高时反应生成
,并探究其氧化还原性质。已知氯气与碱液在温度高时反应生成 ,低温时生成
,低温时生成 。
。 的物质名称是
的物质名称是___________ 。
(2)实验室配制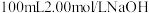 溶液所需的仪器有天平、药匙、烧杯、玻璃棒、量筒、
溶液所需的仪器有天平、药匙、烧杯、玻璃棒、量筒、___________ 和100mL容量瓶。定容时若俯视容量瓶上的刻度线,会导致所配溶液的浓度___________ (填“偏大”“偏小”或“不变”)。
(3)实验开始后,装置a中反应的化学方程式是___________ ;装置b中制备反应的离子方程式是___________ ;装置c试管内的溶液中,逐渐增多的阴离子是___________ (填离子符号)。
(4)各取少量 和
和 溶液,分别置于1号和2号试管中,均滴入足量
溶液,分别置于1号和2号试管中,均滴入足量 溶液,振荡后滴加足量稀盐酸,再滴入少量
溶液,振荡后滴加足量稀盐酸,再滴入少量 溶液,观察到1号试管中无沉淀,2号试管中有白色沉淀。
溶液,观察到1号试管中无沉淀,2号试管中有白色沉淀。
①请用离子方程式依次表示2号试管中生成沉淀的有关反应:___________ 。
②该条件下的氧化能力:
___________  。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
 和
和 ,并探究其氧化还原性质。已知氯气与碱液在温度高时反应生成
,并探究其氧化还原性质。已知氯气与碱液在温度高时反应生成 ,低温时生成
,低温时生成 。
。
 的物质名称是
的物质名称是(2)实验室配制
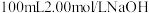 溶液所需的仪器有天平、药匙、烧杯、玻璃棒、量筒、
溶液所需的仪器有天平、药匙、烧杯、玻璃棒、量筒、(3)实验开始后,装置a中反应的化学方程式是
(4)各取少量
 和
和 溶液,分别置于1号和2号试管中,均滴入足量
溶液,分别置于1号和2号试管中,均滴入足量 溶液,振荡后滴加足量稀盐酸,再滴入少量
溶液,振荡后滴加足量稀盐酸,再滴入少量 溶液,观察到1号试管中无沉淀,2号试管中有白色沉淀。
溶液,观察到1号试管中无沉淀,2号试管中有白色沉淀。①请用离子方程式依次表示2号试管中生成沉淀的有关反应:
②该条件下的氧化能力:

 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
您最近一年使用:0次
10 . “天舟六号”为中国空间站送去推进剂Xe气,下列有关说法正确的是
| A.Xe气属于电解质 | B.Xe是IA族元素 |
C. 和 和 互为同位素 互为同位素 | D.Xe气的化学性质很活泼 |
您最近一年使用:0次







