解题方法
1 .  是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。
是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。
已知:i.25℃时, 的
的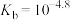 。
。
ii.氯化铵的抗碱容量是指用 溶液滴定
溶液滴定 溶液至
溶液至 时,单位质量的
时,单位质量的 所消耗
所消耗 的物质的量,即
的物质的量,即 。
。
(1) 的电子式
的电子式___________ 。
(2) 溶液呈
溶液呈___________ 性(填“酸”或“碱”),现有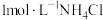 溶液,则该溶液在25℃时的pH为
溶液,则该溶液在25℃时的pH为___________ 。
(3)某化学小组测定 固体抗碱容量
固体抗碱容量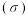 ,实验步骤如下:
,实验步骤如下:
a.配置 溶液。
溶液。
b.称取 固体,溶于
固体,溶于 水中,用上述
水中,用上述 溶液滴定至
溶液滴定至 。
。
①步骤a需要称量 固体为
固体为___________ g。
②步骤b需要用到下图所示仪器中的___________ (填名称)。 的体积为y mL,则
的体积为y mL,则
___________ 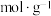 。
。
(4)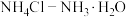 混合溶液具有抗碱能力。向该溶液中加入少量
混合溶液具有抗碱能力。向该溶液中加入少量 ,溶液的pH变化不大。现有
,溶液的pH变化不大。现有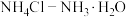 混合溶液(物质的量之比为
混合溶液(物质的量之比为 ),对于该混合溶液的下列叙述中正确的是___________。
),对于该混合溶液的下列叙述中正确的是___________。
 是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。
是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。已知:i.25℃时,
 的
的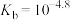 。
。ii.氯化铵的抗碱容量是指用
 溶液滴定
溶液滴定 溶液至
溶液至 时,单位质量的
时,单位质量的 所消耗
所消耗 的物质的量,即
的物质的量,即 。
。(1)
 的电子式
的电子式(2)
 溶液呈
溶液呈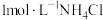 溶液,则该溶液在25℃时的pH为
溶液,则该溶液在25℃时的pH为(3)某化学小组测定
 固体抗碱容量
固体抗碱容量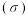 ,实验步骤如下:
,实验步骤如下:a.配置
 溶液。
溶液。b.称取
 固体,溶于
固体,溶于 水中,用上述
水中,用上述 溶液滴定至
溶液滴定至 。
。①步骤a需要称量
 固体为
固体为②步骤b需要用到下图所示仪器中的
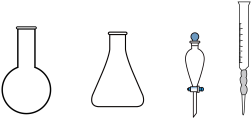
 的体积为y mL,则
的体积为y mL,则
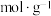 。
。(4)
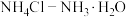 混合溶液具有抗碱能力。向该溶液中加入少量
混合溶液具有抗碱能力。向该溶液中加入少量 ,溶液的pH变化不大。现有
,溶液的pH变化不大。现有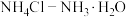 混合溶液(物质的量之比为
混合溶液(物质的量之比为 ),对于该混合溶液的下列叙述中正确的是___________。
),对于该混合溶液的下列叙述中正确的是___________。| A.常温下,该混合溶液呈酸性 |
B.溶液中离子浓度大小关系为: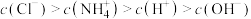 |
C.溶液中离子浓度存在恒等式: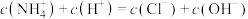 |
D.溶液中微粒间满足: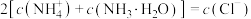 |
您最近一年使用:0次
2 . 硫化钴铜矿主要成分有CoS、CuS、 、
、 ,还含有少量Mg、Ca等元素。一种热活化一硫酸没出工艺实现了钴和铜的高效回收利用,并较好解决了培炼过程中二氧化硫的逸出问题、工艺流程如图所示:
,还含有少量Mg、Ca等元素。一种热活化一硫酸没出工艺实现了钴和铜的高效回收利用,并较好解决了培炼过程中二氧化硫的逸出问题、工艺流程如图所示:_______ 。(任写一条)
(2)“酸浸”过程中Co和Cu的浸出率受焙烧温度和时间的影响如下图所示。由图可知,“焙烧”过程中的最佳实验条件为_______ 。(根据下图选择最佳的温度和时间) 溶液获取Cu后的屯解质溶液可返回
溶液获取Cu后的屯解质溶液可返回_______ 工序循环使用。
(4)“沉钴”操作中发生的离子方程式是_______ 。
(5)“氧化除铁”中将溶液pH调至4.0,并加热煮沸的目的是_______ 。
(6)滤渣3的成分是_______ 。若“除镁钙”时溶液中 mol⋅L-1,当
mol⋅L-1,当 恰好完全沉淀时,列式计算判断
恰好完全沉淀时,列式计算判断 是否开始沉淀:
是否开始沉淀:_______ (已知:室温下,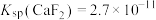 ,
,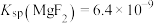 ;当溶液中离子浓度
;当溶液中离子浓度 mol⋅L-1时,可认为该离子沉淀完全。)
mol⋅L-1时,可认为该离子沉淀完全。)
 、
、 ,还含有少量Mg、Ca等元素。一种热活化一硫酸没出工艺实现了钴和铜的高效回收利用,并较好解决了培炼过程中二氧化硫的逸出问题、工艺流程如图所示:
,还含有少量Mg、Ca等元素。一种热活化一硫酸没出工艺实现了钴和铜的高效回收利用,并较好解决了培炼过程中二氧化硫的逸出问题、工艺流程如图所示: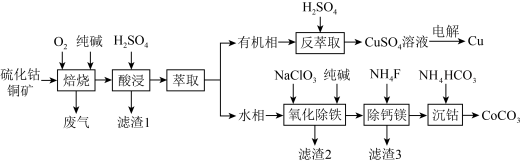
(2)“酸浸”过程中Co和Cu的浸出率受焙烧温度和时间的影响如下图所示。由图可知,“焙烧”过程中的最佳实验条件为
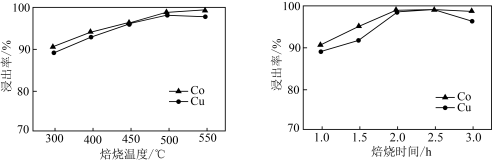
 溶液获取Cu后的屯解质溶液可返回
溶液获取Cu后的屯解质溶液可返回(4)“沉钴”操作中发生的离子方程式是
(5)“氧化除铁”中将溶液pH调至4.0,并加热煮沸的目的是
(6)滤渣3的成分是
 mol⋅L-1,当
mol⋅L-1,当 恰好完全沉淀时,列式计算判断
恰好完全沉淀时,列式计算判断 是否开始沉淀:
是否开始沉淀: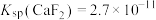 ,
,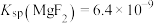 ;当溶液中离子浓度
;当溶液中离子浓度 mol⋅L-1时,可认为该离子沉淀完全。)
mol⋅L-1时,可认为该离子沉淀完全。)
您最近一年使用:0次
2024-09-07更新
|
56次组卷
|
2卷引用:广东省惠州市博罗县2023-2024学年高二上学期1月期末化学试题
3 .  溶液是常见的强碱弱酸盐,可由醋酸和NaOH溶液反应得到。
溶液是常见的强碱弱酸盐,可由醋酸和NaOH溶液反应得到。
(1) 水溶液呈
水溶液呈_______ 性。(填“酸”或“碱”)
(2)用0.1000 mol⋅L-1NaOH标准液滴定25.00 mL未知浓度的 溶液,回答下列问题:
溶液,回答下列问题:_______ (填甲或乙)滴定管中。滴定过程中选择的指示剂是_______ 判断滴定达到终点的现象为_______ 。
②滴定过程中,当滴加25.00 mL NaOH溶液时 恰好完全反应,此时溶液中各离子浓度由大到小的顺序是
恰好完全反应,此时溶液中各离子浓度由大到小的顺序是_______ 。
③下列操作会导致实验结果偏低的是_______ (填字母)
a.达到滴定终点时,仰视读数
b.碱式滴定管在装液前未用标准溶液润洗
c.滴定过程中,锥形瓶中有液体溅出
d.装标准液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现有气泡
(3)电离平衡常数是衡量弱电解质电离程度大小的物理量。已知:
①若把HClO、 、
、 、
、 都看作是酸,其中酸性最弱的是
都看作是酸,其中酸性最弱的是_______ 。向NaClO溶液中通入少量的 ,发生反应的化学方程式
,发生反应的化学方程式_______ ;
②25°C,,等浓度的a.NaClO溶液、b. 溶液和c.
溶液和c. 溶液,三种溶液的pH由小到大的顺序为
溶液,三种溶液的pH由小到大的顺序为_______ 。(用abc符号表示)
 溶液是常见的强碱弱酸盐,可由醋酸和NaOH溶液反应得到。
溶液是常见的强碱弱酸盐,可由醋酸和NaOH溶液反应得到。(1)
 水溶液呈
水溶液呈(2)用0.1000 mol⋅L-1NaOH标准液滴定25.00 mL未知浓度的
 溶液,回答下列问题:
溶液,回答下列问题: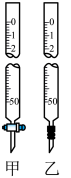
②滴定过程中,当滴加25.00 mL NaOH溶液时
 恰好完全反应,此时溶液中各离子浓度由大到小的顺序是
恰好完全反应,此时溶液中各离子浓度由大到小的顺序是③下列操作会导致实验结果偏低的是
a.达到滴定终点时,仰视读数
b.碱式滴定管在装液前未用标准溶液润洗
c.滴定过程中,锥形瓶中有液体溅出
d.装标准液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现有气泡
(3)电离平衡常数是衡量弱电解质电离程度大小的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HClO | 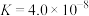 |
 |  |
 | 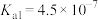 、 、 |
 、
、 、
、 都看作是酸,其中酸性最弱的是
都看作是酸,其中酸性最弱的是 ,发生反应的化学方程式
,发生反应的化学方程式②25°C,,等浓度的a.NaClO溶液、b.
 溶液和c.
溶液和c. 溶液,三种溶液的pH由小到大的顺序为
溶液,三种溶液的pH由小到大的顺序为
您最近一年使用:0次
2024-09-07更新
|
64次组卷
|
2卷引用:广东省惠州市博罗县2023-2024学年高二上学期1月期末化学试题
解题方法
4 . 桂皮中的肉桂醛(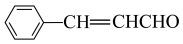 )是一种食用香料,一种合成路线如图:
)是一种食用香料,一种合成路线如图:
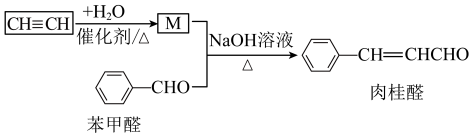
(2)苯甲醛与M反应生成肉桂醛经历了两步,请写出对应的化学方程式:
苯甲醛的制备的流程如图所示:
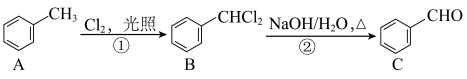
(3)A的名称为
(4)反应②的化学方程式为
(5)请写出苯甲醛与下列物质反应的化学方程式:
与银氨溶液反应
与氰化氢(HCN)反应
您最近一年使用:0次
解题方法
5 . 某化学课外兴趣小组为探究 的性质,设计了如下实验。
的性质,设计了如下实验。
(1)实验仪器a的名称______ 。
(2)写出装置A中发生反应的化学方程式______ 。
(3)酒精灯加热开始反应后,有关说法正确的是______。
(4)某化学兴趣小组在装置B中加入硝酸钡溶液,观察到白色沉淀产生。为进一步探究白色沉淀产生的原因,进行如下探究实验:
①猜想
假设一:是因为在酸性环境中, 可将
可将 氧化成
氧化成 而产生
而产生 沉淀。
沉淀。
假设二:是因为没有隔绝空气, 可将
可将 氧化成
氧化成 而产生
而产生 沉淀。
沉淀。
假设三:______ 。
②进行实验探究,设计实验装置如下图:______ 。(填化学式)
③打开活塞K通入一段时间SO2后,观察到实验Ⅰ依然澄清,实验Ⅱ、Ⅲ、Ⅳ均出现沉淀。写出实验Ⅲ装置A中反应生成沉淀的离子方程式______ 。
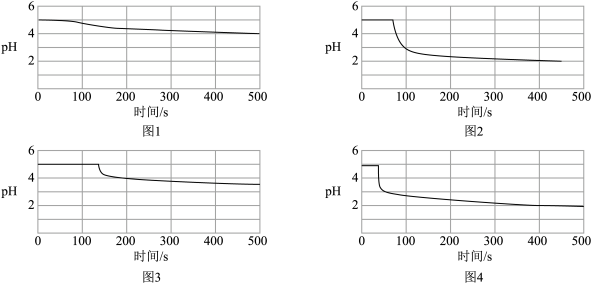
④图1~4依次为Ⅰ~Ⅳ号实验所测pH随时间变化曲线。______ 。
 的性质,设计了如下实验。
的性质,设计了如下实验。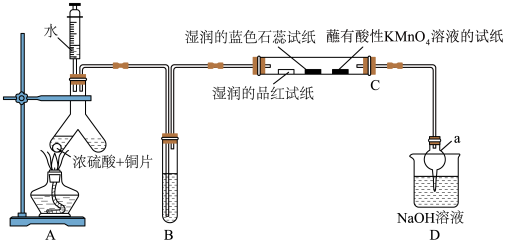
(1)实验仪器a的名称
(2)写出装置A中发生反应的化学方程式
(3)酒精灯加热开始反应后,有关说法正确的是______。
A.湿润的品红试纸褪色,说明 具有漂白性 具有漂白性 |
B.蓝色石蕊试纸先变红后褪色,说明 具有酸性和漂白性 具有酸性和漂白性 |
C.酸性高锰酸钾颜色变浅直至褪色,说明 具有漂白性 具有漂白性 |
D.若装置B中装有 饱和溶液,则可以观察到浅黄色沉淀 饱和溶液,则可以观察到浅黄色沉淀 |
(4)某化学兴趣小组在装置B中加入硝酸钡溶液,观察到白色沉淀产生。为进一步探究白色沉淀产生的原因,进行如下探究实验:
①猜想
假设一:是因为在酸性环境中,
 可将
可将 氧化成
氧化成 而产生
而产生 沉淀。
沉淀。假设二:是因为没有隔绝空气,
 可将
可将 氧化成
氧化成 而产生
而产生 沉淀。
沉淀。假设三:
②进行实验探究,设计实验装置如下图:
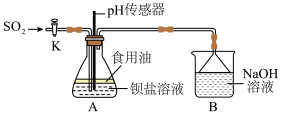
| 编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 试剂 | 煮沸过的 溶液 溶液 | 未煮沸过的 溶液 溶液 | 煮沸过的b溶液 | 未煮沸过的b溶液 |
④图1~4依次为Ⅰ~Ⅳ号实验所测pH随时间变化曲线。
您最近一年使用:0次
解题方法
6 . 空间站的生命保障系统功能之一是实现氧循环,下图是空间站利用Sabatier反应再生氧气的大体流程。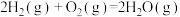
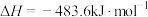
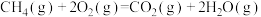

则Sabatier反应 的
的
___________ 。
(2)一定条件下,进行上述Sabatier反应的 :
:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是___________ 。
a. b.混合气体的密度不再改变
b.混合气体的密度不再改变
c.混合气体平均摩尔质量不再改变 d.混合气体的总质量不再改变
②在温度为T、压强恒定为 的条件下,按
的条件下,按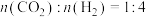 投料进行反应,平衡时
投料进行反应,平衡时 的转化率为50%,
的转化率为50%,
___________ (用 表示)。(已知
表示)。(已知 是以分压表示的平衡常数,分压=总压×物质的量分数。)
是以分压表示的平衡常数,分压=总压×物质的量分数。)
③科学家研究在催化剂表面上 与
与 的反应,前三步历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中正确的是
的反应,前三步历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中正确的是___________ (填字母)。
B. 转化为
转化为 和
和 的反应
的反应
C.第一步历程中只发生了非极性共价键的断裂
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
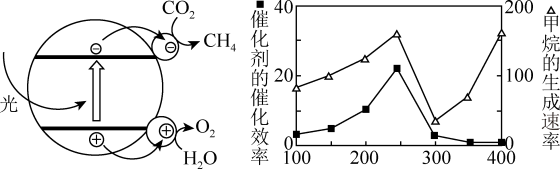
(3)氧再生反应可以通过酸性条件下半导体光催化转化实现,反应如图甲所示: 转化为
转化为 的阴极的电极反应式为
的阴极的电极反应式为___________ ,理论上每生成1mol ,阳极生成氧气的质量为
,阳极生成氧气的质量为___________ g。
②催化剂的催化效率和 的生成速率随温度的变化关系如图乙所示。300℃到400℃之间,
的生成速率随温度的变化关系如图乙所示。300℃到400℃之间, 生成速率加快的原因是
生成速率加快的原因是___________ 。
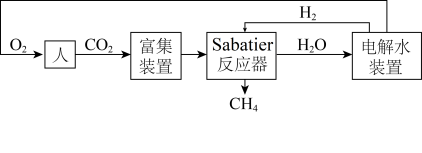
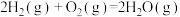
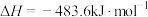
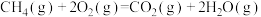

则Sabatier反应
 的
的
(2)一定条件下,进行上述Sabatier反应的
 :
:①在恒温恒压装置中,下列能说明反应达到平衡状态的是
a.
 b.混合气体的密度不再改变
b.混合气体的密度不再改变c.混合气体平均摩尔质量不再改变 d.混合气体的总质量不再改变
②在温度为T、压强恒定为
 的条件下,按
的条件下,按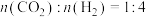 投料进行反应,平衡时
投料进行反应,平衡时 的转化率为50%,
的转化率为50%,
 表示)。(已知
表示)。(已知 是以分压表示的平衡常数,分压=总压×物质的量分数。)
是以分压表示的平衡常数,分压=总压×物质的量分数。)③科学家研究在催化剂表面上
 与
与 的反应,前三步历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中正确的是
的反应,前三步历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中正确的是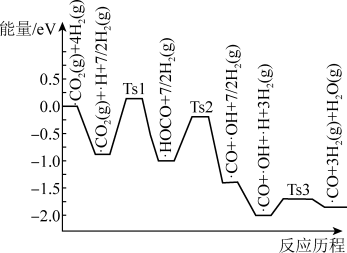
B.
 转化为
转化为 和
和 的反应
的反应
C.第一步历程中只发生了非极性共价键的断裂
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
(3)氧再生反应可以通过酸性条件下半导体光催化转化实现,反应如图甲所示:
 转化为
转化为 的阴极的电极反应式为
的阴极的电极反应式为 ,阳极生成氧气的质量为
,阳极生成氧气的质量为②催化剂的催化效率和
 的生成速率随温度的变化关系如图乙所示。300℃到400℃之间,
的生成速率随温度的变化关系如图乙所示。300℃到400℃之间, 生成速率加快的原因是
生成速率加快的原因是
您最近一年使用:0次
解题方法
7 . 硝酸铁和硫酸铁为重要的铁盐。某化学兴趣小组展开如下探究:
(1)配制硝酸铁溶液
①实验室配制250ml0.2
 溶液,需要称取
溶液,需要称取 晶体
晶体___________ g。需要用到的玻璃仪器有玻璃棒、烧杯、量筒、___________ (填字母)。 晶体溶于水后,再加入适量稀硝酸,充分振荡。加入稀硝酸的目的是
晶体溶于水后,再加入适量稀硝酸,充分振荡。加入稀硝酸的目的是___________ 。
(2)探究用铁盐溶液溶解银镜实验后的银:
①实验ⅰ:甲同学向有银镜的试管中逐滴加入过量0.2
 溶液(pH=2),银镜消失,溶液变为澄清,得出
溶液(pH=2),银镜消失,溶液变为澄清,得出 能与Ag反应的结论。乙同学认为该实验不够严谨,原因是
能与Ag反应的结论。乙同学认为该实验不够严谨,原因是___________ (用离子方程式表示)。
②实验ⅱ:乙同学改进实验,向另一支含有等量银镜的试管中逐滴加入过量0.1 的
的 溶液(pH=2),充分振荡,银镜逐渐消失,溶液黄色明显变浅,产生较多白色沉淀。取少量上层清液,加入下列
溶液(pH=2),充分振荡,银镜逐渐消失,溶液黄色明显变浅,产生较多白色沉淀。取少量上层清液,加入下列___________ 溶液(填字母),若出现___________ 现象,则充分说明 能与Ag反应。
能与Ag反应。
A.KSCN B. C.
C.
(3)丙同学查阅资料发现, 、
、 的氧化性差异不大,一定条件下,Ag和
的氧化性差异不大,一定条件下,Ag和 反应是可逆反应,设计如下电化学装置进行验证。
反应是可逆反应,设计如下电化学装置进行验证。___________ 溶液,产生的现象为___________ ,则说明Ag和 的反应为可逆反应。
的反应为可逆反应。
(1)配制硝酸铁溶液
①实验室配制250ml0.2

 溶液,需要称取
溶液,需要称取 晶体
晶体
 晶体溶于水后,再加入适量稀硝酸,充分振荡。加入稀硝酸的目的是
晶体溶于水后,再加入适量稀硝酸,充分振荡。加入稀硝酸的目的是(2)探究用铁盐溶液溶解银镜实验后的银:
①实验ⅰ:甲同学向有银镜的试管中逐滴加入过量0.2

 溶液(pH=2),银镜消失,溶液变为澄清,得出
溶液(pH=2),银镜消失,溶液变为澄清,得出 能与Ag反应的结论。乙同学认为该实验不够严谨,原因是
能与Ag反应的结论。乙同学认为该实验不够严谨,原因是②实验ⅱ:乙同学改进实验,向另一支含有等量银镜的试管中逐滴加入过量0.1
 的
的 溶液(pH=2),充分振荡,银镜逐渐消失,溶液黄色明显变浅,产生较多白色沉淀。取少量上层清液,加入下列
溶液(pH=2),充分振荡,银镜逐渐消失,溶液黄色明显变浅,产生较多白色沉淀。取少量上层清液,加入下列 能与Ag反应。
能与Ag反应。A.KSCN B.
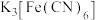 C.
C.
(3)丙同学查阅资料发现,
 、
、 的氧化性差异不大,一定条件下,Ag和
的氧化性差异不大,一定条件下,Ag和 反应是可逆反应,设计如下电化学装置进行验证。
反应是可逆反应,设计如下电化学装置进行验证。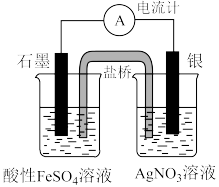
 的反应为可逆反应。
的反应为可逆反应。
您最近一年使用:0次
解题方法
8 . 化学促进科技进步和社会发展,下列说法不正确的是
A.月壤中的“嫦娥石 ”其成分属于无机盐 ”其成分属于无机盐 |
| B.“运-20”机身采用钨碳合金比纯金属钨具有更高的强度和韧性 |
C.T-碳(T-Carbon)是中科院预言的一种三维碳结构晶体,其与 互为同位素 互为同位素 |
| D.2023年诺贝尔化学奖授予量子点研究,直径为2~20nm硅量子点可用于制备胶体 |
您最近一年使用:0次
9 . 优化的 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示:
的流程如图所示:
(1)“研磨”的目的是_______ 。
(2)“灼烧”时大量尾气直接排放会引起的主要环境问题为_______ (任写一种)。
(3)常温下,“酸浸”时加入过量硫酸的目的为_______ (任写一条)。
(4)“浸渣1”的主要成分是_______ (填化学式)。
(5)“还原”时 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
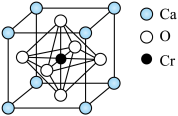
(6)铬与铁为同周期元素,铬的价电子排布式为____ ,某含铬化合物立方晶胞如图所示。晶胞参数为a nm,设 为阿伏加德常数的值,则该晶体的密度为
为阿伏加德常数的值,则该晶体的密度为____ (用含a、 的代数式表示)
的代数式表示) 。
。
 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示:
的流程如图所示: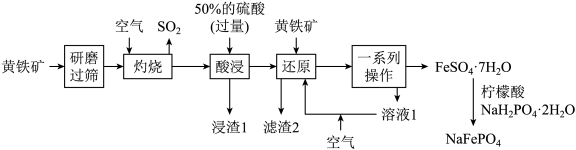
(1)“研磨”的目的是
(2)“灼烧”时大量尾气直接排放会引起的主要环境问题为
(3)常温下,“酸浸”时加入过量硫酸的目的为
(4)“浸渣1”的主要成分是
(5)“还原”时
 与
与 反应的离子方程式为
反应的离子方程式为(6)铬与铁为同周期元素,铬的价电子排布式为
 为阿伏加德常数的值,则该晶体的密度为
为阿伏加德常数的值,则该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
名校
10 . Ⅰ.用如图所示的装置测定中和反应的反应热。____ ,其能否用铜质材料替代?____ (填“能”或“不能”)。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:
 的
的
_______ (保留一位小数)。
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
根据表中数据计算可得该NaOH溶液的物质的量浓度为_______ (保留四位有效数字) 。
。
(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。
(6)写出滴定的离子方程式:_______ 。
(7)用酸性 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在_______ (填“酸式”或“碱式”)滴定管中,滴定终点的现象是_______ 。

(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:| 反应物 | 起始温度 /℃ /℃ | 最高温度 /℃ /℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
 的
的
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 硫酸的体积/mL 硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 。
。(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始时仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的
 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。(6)写出滴定的离子方程式:
(7)用酸性
 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在
您最近一年使用:0次



