1 . 如图为铜或镁元素的部分价类二维图,下列叙述不正确的是
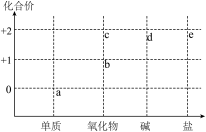
| A.可能存在a→d→e的直接转化 |
| B.d可能溶于过量的氨水 |
| C.若新制的d能用于检验醛基,则此时生成b |
| D.蒸干e的水溶液均能得到原溶质 |
您最近一年使用:0次
2 . 银及其化合物在多种化学反应中都有重要作用。
(1)工业上常用Ag为催化剂氧化乙烯制备环氧乙烷( ,简称EO);反应方程式为
,简称EO);反应方程式为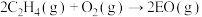 (反应a)
(反应a)
①银和铜位于同一族相邻周期,基态Ag原子的价层电子排布式为:_______ 。
_______ 。
③关于反应a,下列说法正确的是_______ 。
A.加入银单质能降低该反应的活化能和焓变
B.因氧气并不直接与乙烯反应,故改变氧气浓度对反应无影响
C.移出部分EO可使平衡正向移动,从而提高产率
D.恒温恒容容器中,通入一定量的He气可增大压强,但乙烯的平衡转化率不变
(2)我国科学家报道了一种高效O―to―C的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。一种脱氧/环加成串联反应机理如图,其中的催化剂为_______ (填图中字母),反应物A和C消耗的物质的量之比为_______ 。(已知Ph―代表苯基)
a.已知: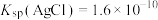 ;
;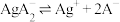

b.向NaA溶液中加入足量AgCl固体,发生反应: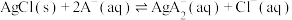 。测得平衡时
。测得平衡时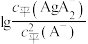 随pCl的变化曲线如图{
随pCl的变化曲线如图{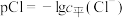 ,不考虑Ag的其它存在形式}。
,不考虑Ag的其它存在形式}。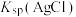
_______ 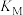 ,
,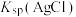
_______ 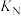 。(填“>”、“<”、“=”)
。(填“>”、“<”、“=”)
②计算AgCl在 NaM溶液中的溶解度
NaM溶液中的溶解度_______ (用物质的量浓度表示,写出计算过程,结果保留两位有效数字)。
(1)工业上常用Ag为催化剂氧化乙烯制备环氧乙烷(
 ,简称EO);反应方程式为
,简称EO);反应方程式为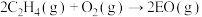 (反应a)
(反应a)①银和铜位于同一族相邻周期,基态Ag原子的价层电子排布式为:
②已知: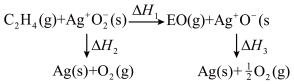

③关于反应a,下列说法正确的是
A.加入银单质能降低该反应的活化能和焓变
B.因氧气并不直接与乙烯反应,故改变氧气浓度对反应无影响
C.移出部分EO可使平衡正向移动,从而提高产率
D.恒温恒容容器中,通入一定量的He气可增大压强,但乙烯的平衡转化率不变
(2)我国科学家报道了一种高效O―to―C的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。一种脱氧/环加成串联反应机理如图,其中的催化剂为
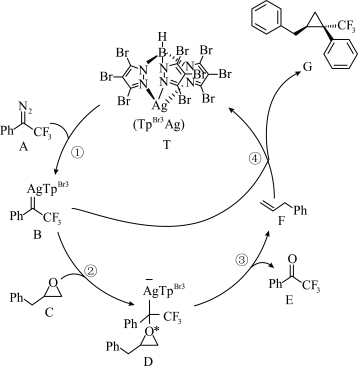
a.已知:
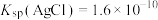 ;
;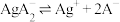

b.向NaA溶液中加入足量AgCl固体,发生反应:
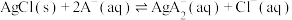 。测得平衡时
。测得平衡时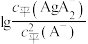 随pCl的变化曲线如图{
随pCl的变化曲线如图{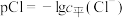 ,不考虑Ag的其它存在形式}。
,不考虑Ag的其它存在形式}。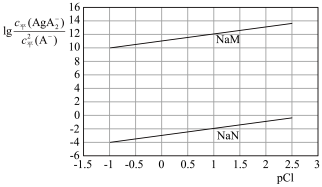
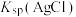
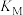 ,
,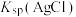
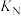 。(填“>”、“<”、“=”)
。(填“>”、“<”、“=”)②计算AgCl在
 NaM溶液中的溶解度
NaM溶液中的溶解度
您最近一年使用:0次
解题方法
3 . 某兴趣小组同学探究 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。
)溶液反应速率的影响因素。
【配制溶液】配制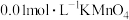 溶液、
溶液、 草酸溶液。
草酸溶液。
(1)配制250mL 0.01mol/L的高锰酸钾溶液一定不需要用到下列仪器中的_______ (填字母)。还缺_______ 仪器。_______ (填字母)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.定容加水时超过刻度线后,立即吸出多余的水
d.溶液从烧杯转移到容量瓶中后,没有洗涤烧杯
【设计实验】将配制的 溶液与草酸溶液按如下比例混合,分别测量褪色时间。
溶液与草酸溶液按如下比例混合,分别测量褪色时间。
(3)计算实验①的平均反应速率
_______ (结果用含 的式子表示)。
的式子表示)。
(4)得出结论:其它条件不变时,提高反应物浓度,升高温度,可以提高反应速度,则 ,
, ,
, 需满足的条件为:
需满足的条件为:_______ 。
实验过程中,甲同学发现,草酸溶液与酸性 溶液反应时,溶液紫色并未直接褪去,而是分成两个阶段:第一阶段紫色溶液变为青色溶液,第二阶段青色溶液褪为无色溶液。且三组实验褪色都是先慢后快。
溶液反应时,溶液紫色并未直接褪去,而是分成两个阶段:第一阶段紫色溶液变为青色溶液,第二阶段青色溶液褪为无色溶液。且三组实验褪色都是先慢后快。
【实验推理】甲同学为深入研究溶液褪色先慢后快的原因,查阅资料:
(5)第二阶段为青色溶液和 反应生成无色溶液,且有
反应生成无色溶液,且有 气体产生,该反应的离子方程式为
气体产生,该反应的离子方程式为_______ 。
(6)实验褪色先慢后快,甲同学推测原因可能是:_______ 。
【实验验证】为了验证甲同学推理的合理性,乙同学对比实验②进行了如下实验:
(7)表格中试剂为_______ 。若甲同学的推测原因正确,则乙同学观察到的现象是:_______ 。
实验结论:其它条件相同时,增大反应物浓度,升高温度,催化剂可提高化学反应速率。
 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。
)溶液反应速率的影响因素。【配制溶液】配制
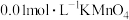 溶液、
溶液、 草酸溶液。
草酸溶液。(1)配制250mL 0.01mol/L的高锰酸钾溶液一定不需要用到下列仪器中的
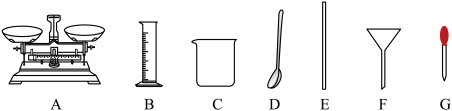
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.定容加水时超过刻度线后,立即吸出多余的水
d.溶液从烧杯转移到容量瓶中后,没有洗涤烧杯
【设计实验】将配制的
 溶液与草酸溶液按如下比例混合,分别测量褪色时间。
溶液与草酸溶液按如下比例混合,分别测量褪色时间。| 序号 | 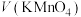 /mL /mL | V(草酸)/mL |  /mL /mL | 反应温度/℃ | 褪色时间/s |
| ① | 2.0 | 2.0 | 0 | 20 |  |
| ② | 2.0 | 1.0 | 1.0 | 20 |  |
| ③ | 2.0 | 2.0 | 0 | 50 |  |
(3)计算实验①的平均反应速率

 的式子表示)。
的式子表示)。(4)得出结论:其它条件不变时,提高反应物浓度,升高温度,可以提高反应速度,则
 ,
, ,
, 需满足的条件为:
需满足的条件为:实验过程中,甲同学发现,草酸溶液与酸性
 溶液反应时,溶液紫色并未直接褪去,而是分成两个阶段:第一阶段紫色溶液变为青色溶液,第二阶段青色溶液褪为无色溶液。且三组实验褪色都是先慢后快。
溶液反应时,溶液紫色并未直接褪去,而是分成两个阶段:第一阶段紫色溶液变为青色溶液,第二阶段青色溶液褪为无色溶液。且三组实验褪色都是先慢后快。【实验推理】甲同学为深入研究溶液褪色先慢后快的原因,查阅资料:
资料i: 呈绿色,酸性条件下迅速分解: 呈绿色,酸性条件下迅速分解: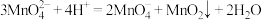 资料ii:  能与 能与 络合: 络合: (无色) (无色)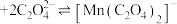 (青色)。 (青色)。资料iii:  在溶液中无色,在草酸中不能形成配合物。 在溶液中无色,在草酸中不能形成配合物。 |
(5)第二阶段为青色溶液和
 反应生成无色溶液,且有
反应生成无色溶液,且有 气体产生,该反应的离子方程式为
气体产生,该反应的离子方程式为(6)实验褪色先慢后快,甲同学推测原因可能是:
【实验验证】为了验证甲同学推理的合理性,乙同学对比实验②进行了如下实验:
| 序号 |  /mL /mL | V(草酸)/mL | 试剂 | 反应温度/℃ | 褪色时间/s |
| ④ | 2.0 | 1.0 | 0.1mol/L | 20 |  |
(7)表格中试剂为
实验结论:其它条件相同时,增大反应物浓度,升高温度,催化剂可提高化学反应速率。
您最近一年使用:0次
昨日更新
|
34次组卷
|
2卷引用:广东省珠海市2025届高三上学期第一次摸底考试 化学试题
解题方法
4 .  是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。
是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。
已知:i.25℃时, 的
的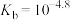 。
。
ii.氯化铵的抗碱容量是指用 溶液滴定
溶液滴定 溶液至
溶液至 时,单位质量的
时,单位质量的 所消耗
所消耗 的物质的量,即
的物质的量,即 。
。
(1) 的电子式
的电子式___________ 。
(2) 溶液呈
溶液呈___________ 性(填“酸”或“碱”),现有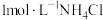 溶液,则该溶液在25℃时的pH为
溶液,则该溶液在25℃时的pH为___________ 。
(3)某化学小组测定 固体抗碱容量
固体抗碱容量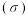 ,实验步骤如下:
,实验步骤如下:
a.配置 溶液。
溶液。
b.称取 固体,溶于
固体,溶于 水中,用上述
水中,用上述 溶液滴定至
溶液滴定至 。
。
①步骤a需要称量 固体为
固体为___________ g。
②步骤b需要用到下图所示仪器中的___________ (填名称)。 的体积为y mL,则
的体积为y mL,则
___________ 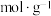 。
。
(4)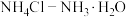 混合溶液具有抗碱能力。向该溶液中加入少量
混合溶液具有抗碱能力。向该溶液中加入少量 ,溶液的pH变化不大。现有
,溶液的pH变化不大。现有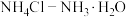 混合溶液(物质的量之比为
混合溶液(物质的量之比为 ),对于该混合溶液的下列叙述中正确的是___________。
),对于该混合溶液的下列叙述中正确的是___________。
 是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。
是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。已知:i.25℃时,
 的
的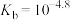 。
。ii.氯化铵的抗碱容量是指用
 溶液滴定
溶液滴定 溶液至
溶液至 时,单位质量的
时,单位质量的 所消耗
所消耗 的物质的量,即
的物质的量,即 。
。(1)
 的电子式
的电子式(2)
 溶液呈
溶液呈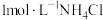 溶液,则该溶液在25℃时的pH为
溶液,则该溶液在25℃时的pH为(3)某化学小组测定
 固体抗碱容量
固体抗碱容量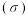 ,实验步骤如下:
,实验步骤如下:a.配置
 溶液。
溶液。b.称取
 固体,溶于
固体,溶于 水中,用上述
水中,用上述 溶液滴定至
溶液滴定至 。
。①步骤a需要称量
 固体为
固体为②步骤b需要用到下图所示仪器中的
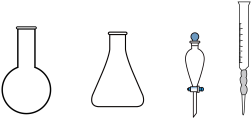
 的体积为y mL,则
的体积为y mL,则
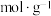 。
。(4)
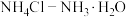 混合溶液具有抗碱能力。向该溶液中加入少量
混合溶液具有抗碱能力。向该溶液中加入少量 ,溶液的pH变化不大。现有
,溶液的pH变化不大。现有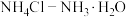 混合溶液(物质的量之比为
混合溶液(物质的量之比为 ),对于该混合溶液的下列叙述中正确的是___________。
),对于该混合溶液的下列叙述中正确的是___________。| A.常温下,该混合溶液呈酸性 |
B.溶液中离子浓度大小关系为: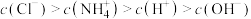 |
C.溶液中离子浓度存在恒等式: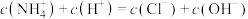 |
D.溶液中微粒间满足: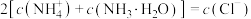 |
您最近一年使用:0次
5 . 广府文化是颇有广东特色的地域文化。下列物品的主要成分不属于 有机高分子材料的是
A.粤绣《岭南红荔》 | B.榄雕橄榄核舟 |
C.斗门菉猗堂的蚝壳墙 | D.广式红木家具 |
您最近一年使用:0次
昨日更新
|
22次组卷
|
2卷引用:广东省珠海市2025届高三上学期第一次摸底考试 化学试题
6 . 金属锶(Sr)可用于制造合金、光电管和照明灯等。一种从锌冶炼阳极泥(主要成分为 、
、 、
、 和ZnO)中回收金属元素的工艺如下:
和ZnO)中回收金属元素的工艺如下: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
②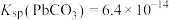 ,
, 。
。
③ 的熔点874℃,其水溶液显弱酸性。
的熔点874℃,其水溶液显弱酸性。
(1)滤液1的主要成分为_______ 。
(2)“还原酸浸”中,反应的离子方程式为_______ 。
(3)“焙烧”时,除生成硫化锶,还生成了一种还原性气体,该反应的化学方程式为_______ 。
(4)从滤液2中获得 晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是
晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是_______ 。
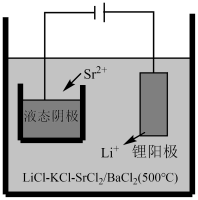
(5)“结晶”得到的是六水合氯化锶晶体,电解前需要转化为无水氯化锶,相应的操作为_______ ,相比传统惰性电极电解熔融氯化锶制备金属锶,本电解工艺优点为_______ 。(任写一条)
(6)利用锶制备得到的钛酸锶可用于光催化还原 实现“碳中和”,原理如图所示。铂电极的电极反应式为
实现“碳中和”,原理如图所示。铂电极的电极反应式为_______ , 的迁移方向为
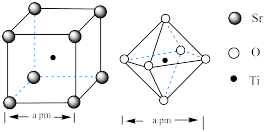
的迁移方向为_______ 。(填“从左到右”或“从右到左”)_______ ,其晶胞中一个O周围和它最近且距离相等的O有_______ 个。
 、
、 、
、 和ZnO)中回收金属元素的工艺如下:
和ZnO)中回收金属元素的工艺如下: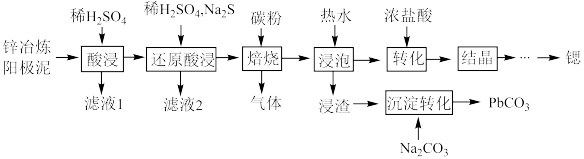
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。②
 ,
, 。
。③
 的熔点874℃,其水溶液显弱酸性。
的熔点874℃,其水溶液显弱酸性。(1)滤液1的主要成分为
(2)“还原酸浸”中,反应的离子方程式为
(3)“焙烧”时,除生成硫化锶,还生成了一种还原性气体,该反应的化学方程式为
(4)从滤液2中获得
 晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是
晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是(5)“结晶”得到的是六水合氯化锶晶体,电解前需要转化为无水氯化锶,相应的操作为
(6)利用锶制备得到的钛酸锶可用于光催化还原
 实现“碳中和”,原理如图所示。铂电极的电极反应式为
实现“碳中和”,原理如图所示。铂电极的电极反应式为 的迁移方向为
的迁移方向为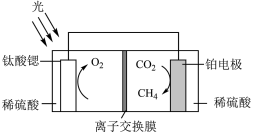
您最近一年使用:0次
昨日更新
|
32次组卷
|
2卷引用:广东省珠海市2025届高三上学期第一次摸底考试 化学试题
7 . 某学生按图示方法进行实验,一段时间后,锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止。下列相应的推理不合理 的是
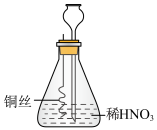
| A.开始阶段铜丝表面气泡释放速度缓慢,可能是铜表面有氧化膜 |
B.锥形瓶内气体颜色先变深后变浅,说明铜与稀 反应先生成 反应先生成 |
| C.锥形瓶中液面下降,最终铜丝与液面脱离接触,说明体系压强增大 |
D.常温下 能自发进行,说明该反应 能自发进行,说明该反应 |
您最近一年使用:0次
昨日更新
|
38次组卷
|
2卷引用:广东省珠海市2025届高三上学期第一次摸底考试 化学试题
8 . 已知有如下两个反应:① ,②
,②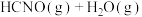
 。在一恒温恒容密闭容器中充入一定量的CO(NH2)2(g)和H2O(g),测得不同温度下HCNO浓度随时间的变化如图所示。已知350℃时曲线上两点坐标分别是(0.31,230)和(0.41,251.5)。下列说法错误的是
。在一恒温恒容密闭容器中充入一定量的CO(NH2)2(g)和H2O(g),测得不同温度下HCNO浓度随时间的变化如图所示。已知350℃时曲线上两点坐标分别是(0.31,230)和(0.41,251.5)。下列说法错误的是
 ,②
,②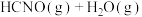
 。在一恒温恒容密闭容器中充入一定量的CO(NH2)2(g)和H2O(g),测得不同温度下HCNO浓度随时间的变化如图所示。已知350℃时曲线上两点坐标分别是(0.31,230)和(0.41,251.5)。下列说法错误的是
。在一恒温恒容密闭容器中充入一定量的CO(NH2)2(g)和H2O(g),测得不同温度下HCNO浓度随时间的变化如图所示。已知350℃时曲线上两点坐标分别是(0.31,230)和(0.41,251.5)。下列说法错误的是
| A.低温时主要发生反应①,高温时主要发生反应② |
| B.两步反应中均有极性键的断裂和形成 |
C.350℃下,0.31s~0.41s内尿素分解速率为 |
| D.及时分离出CO2有助于提高氨气的产率 |
您最近一年使用:0次
7日内更新
|
49次组卷
|
2卷引用:广东省部分名校2023-2024学年高二上学期期末教学质量检测化学试题
解题方法
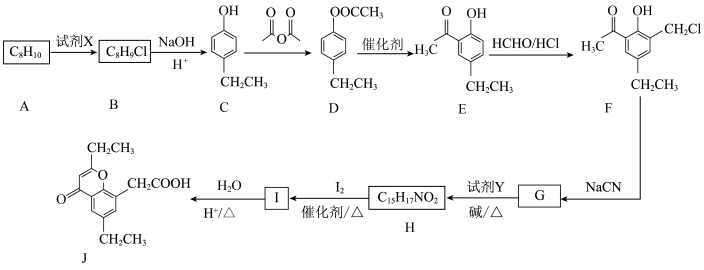
9 . 具有抗菌、消炎作用的药物有机物J的合成路线如下:
②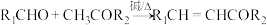
(1)有机物A的名称为___________ 。
(2)C到D的反应类型为___________ ,I的结构简式为___________ 。
(3)请写出G和试剂Y反应生成H的化学方程式:___________ 。
(4)根据有机物D的结构特征,分析预测其可能的化学性质,完成下表。
(5)同时满足下列条件的D的同分异构体共___________ 种。(不考虑立体异构)
①能发生银镜反应;
②能发生水解反应;
③属于芳香族化合物;
④苯环上含2个取代基。
(6)结合图中信息,写出以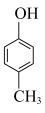 、
、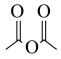 和
和 为原料设计路线合成
为原料设计路线合成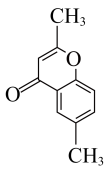 (模仿已知②③)的简单流程
(模仿已知②③)的简单流程__________ 。

②
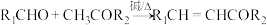
③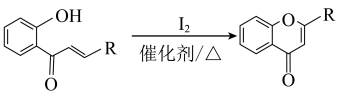
(1)有机物A的名称为
(2)C到D的反应类型为
(3)请写出G和试剂Y反应生成H的化学方程式:
(4)根据有机物D的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂及条件 | 反应形成的新结构 | 反应类型 |
| ① | 加成反应 | ||
| ② | 水解反应 |
(5)同时满足下列条件的D的同分异构体共
①能发生银镜反应;
②能发生水解反应;
③属于芳香族化合物;
④苯环上含2个取代基。
(6)结合图中信息,写出以
 、
、 和
和 为原料设计路线合成
为原料设计路线合成 (模仿已知②③)的简单流程
(模仿已知②③)的简单流程
您最近一年使用:0次
10 . 氯化铁(FeCl3)在工农业生产中有着广泛的应用,某化学小组在实验室进行有关FeCl3的实验探究。
(1)配制100 mL浓度约为0.1mol/L FeCl3 溶液,先将1.7 g固体FeCl3溶解在盛有适量浓盐酸的烧杯中,再加水到100 mL,盐酸的作用是___________ 。
(2)用试管取2mL 0.1mol/LFeCl3溶液,加入少量0.1mol/L KI溶液,该反应的离子方程式为:2Fe3+ + 2I- = 2Fe2+ + I2,要验证反应已发生的方法和现象是___________ 。
(3)同学甲查阅资料发现上述反应是可逆反应,于是设计了如下实验:用试管另取2 mL 0.1mol/L FeCl3溶液,加入V mL 0.1mol/L KI溶液充分振荡反应,再加入W溶液,溶液呈红色,则可证明上述反应是可逆反应,则V 的取值范围为___________ ,物质W的化学式为___________ 。
(4)根据上述结论,同学乙设计了如下原电池(电极为石墨):___________ 。
②反应达到平衡时,外电路导线中___________ (填“有”或“无”)电流通过。
③平衡后向FeCl3溶液中加入少量FeCl2固体,当固体全部溶解后,则此时电极A变为___________ (填“正”或“负”)极。
(1)配制100 mL浓度约为0.1mol/L FeCl3 溶液,先将1.7 g固体FeCl3溶解在盛有适量浓盐酸的烧杯中,再加水到100 mL,盐酸的作用是
(2)用试管取2mL 0.1mol/LFeCl3溶液,加入少量0.1mol/L KI溶液,该反应的离子方程式为:2Fe3+ + 2I- = 2Fe2+ + I2,要验证反应已发生的方法和现象是
(3)同学甲查阅资料发现上述反应是可逆反应,于是设计了如下实验:用试管另取2 mL 0.1mol/L FeCl3溶液,加入V mL 0.1mol/L KI溶液充分振荡反应,再加入W溶液,溶液呈红色,则可证明上述反应是可逆反应,则V 的取值范围为
(4)根据上述结论,同学乙设计了如下原电池(电极为石墨):
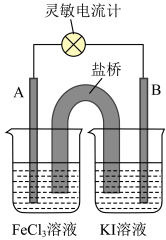
②反应达到平衡时,外电路导线中
③平衡后向FeCl3溶液中加入少量FeCl2固体,当固体全部溶解后,则此时电极A变为
您最近一年使用:0次



