名校
解题方法
1 . 化学知识助力乡村振兴。下列说法正确的是
| A.粮食酿酒增加农民收入;酒精的结构式为C2H5OH |
| B.聚氯乙烯难降解,易造成白色污染;聚氯乙烯易与Br2发生加成反应 |
| C.梅州金柚果肉清甜爽口,成熟时会释放乙烯;乙烯分子中所有原子在同一平面上 |
| D.桑基鱼塘经济效益高;桑树吸收鱼粪便中的N元素的过程属于固氮过程 |
您最近一年使用:0次
名校
解题方法
2 . 科学家采用一种“机械化学”的新方法,在 和常压条件下,使
和常压条件下,使 和
和 反应生成
反应生成 。下列说法不正确的是
。下列说法不正确的是
 和常压条件下,使
和常压条件下,使 和
和 反应生成
反应生成 。下列说法不正确的是
。下列说法不正确的是| A.该方法属于人工固氮 | B.该反应是一个可逆反应 |
| C.该反应的气体分子总数增加 | D.原料 可由分离液化空气获得 可由分离液化空气获得 |
您最近一年使用:0次
3 . 碳及其化合物广泛存在于自然界中。回答下列问题:
(1)光催化还原CO2制备CH4的反应中,带状纳米Zn2GeO4是该反应的良好催化剂:
①C、H、O的第一电离能由大至小的顺序是________ 。
②Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因为________ 。
(2)在金刚石晶体(晶胞结构如图所示)中:________ 个六元环,六元环中最多有________ 个C原子在同一平面。
②已知金刚石晶体的密度为ρg∙cm-3,NA代表阿伏加德罗常数的值,该晶胞中a与b之间的距离为________ (用含ρ、NA的代数式表示)nm。
③Q原子的参数坐标为________ 。
(3)碳化硅(SiC)晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因为________ 。
(4)HSCN通常有 和
和 两种结构,比较二者沸点的高低并分析原因:
两种结构,比较二者沸点的高低并分析原因:________ 。
(1)光催化还原CO2制备CH4的反应中,带状纳米Zn2GeO4是该反应的良好催化剂:
①C、H、O的第一电离能由大至小的顺序是
②Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因为
(2)在金刚石晶体(晶胞结构如图所示)中:
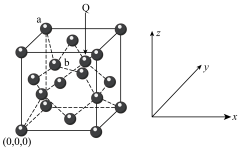
②已知金刚石晶体的密度为ρg∙cm-3,NA代表阿伏加德罗常数的值,该晶胞中a与b之间的距离为
③Q原子的参数坐标为
(3)碳化硅(SiC)晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,但是碳化硅的熔点低于金刚石,原因为
(4)HSCN通常有
 和
和 两种结构,比较二者沸点的高低并分析原因:
两种结构,比较二者沸点的高低并分析原因:
您最近一年使用:0次
2024-06-15更新
|
88次组卷
|
3卷引用:广东省部分学校2023-2024学年高二下学期期中联考化学试题
广东省部分学校2023-2024学年高二下学期期中联考化学试题广东省梅州市部分学校2023-2024学年高二下学期4月期中联考化学试题(已下线)期末押题卷02 -备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
4 . 硫的氧化物、氮的氧化物、硅的氧化物都是重要的化工原料。将其合理利用,既能减少污染,又能充分利用资源,创造价值。
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英的成分是_______ (填化学式),该物质的类别属于_______ 氧化物(填“碱性”、 “酸性”或“两性”),实验室中不能用带玻璃塞的试剂瓶盛放NaOH溶液,原因是_______________ (用离子方程式表示)。
(2)玻璃是常用的硅酸盐材料,生产普通玻璃的主要材料有________ 、_______ 、_______ ,工艺师常用_________ (填物质名称)来雕刻玻璃,其作用过程产生________ 气体。
(3)石英坩埚可以用来灼烧下面哪种物质_______。(填字母)
(4)SiO2在自然界中广泛存在,它是制备现代通讯材料_________ (写该材料名称)的主要原料
(5)在一定量的浓硫酸中加入过量铜片,加热使之反应,反应结束后。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为_________________ 。
(6)硝酸是一种重要的工业原料。在实验室中通常保存在棕色试剂瓶中,则原因是_______________ (用化学方程式表示)。硝酸是一种易挥发性的酸,用蘸浓硝酸和蘸浓氨水的玻璃棒靠近会产生大量白烟,白烟的成分是__________ 。
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英的成分是
(2)玻璃是常用的硅酸盐材料,生产普通玻璃的主要材料有
(3)石英坩埚可以用来灼烧下面哪种物质_______。(填字母)
| A.碳酸钠 | B.氢氧化钠 | C.氢氧化钾 | D.氯化钠 |
(5)在一定量的浓硫酸中加入过量铜片,加热使之反应,反应结束后。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(6)硝酸是一种重要的工业原料。在实验室中通常保存在棕色试剂瓶中,则原因是
您最近一年使用:0次
5 . 为了探究化学反应中的能量变化,某同学设计了如图所示的两个实验(图中为大小 、形状完全相同的纯 Zn片,稀硫酸浓度与体积也相同) 。 下列说法错误的是
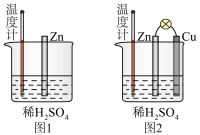
| A.能量转化形式不同 |
| B.产生气体的速率不同 |
| C.总反应的离子方程式相同 |
| D.图 1和图 2中温度计的示数相等,且均高于室温 |
您最近一年使用:0次
2024-06-14更新
|
61次组卷
|
2卷引用:广东省河源市部分学校2023-2024学年高一下学期5月期中联考化学试题
名校
解题方法
6 . 下列叙述正确的是
A.聚丙烯的结构简式: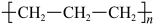 |
| B.利用密度不同,可以用水直接鉴别苯和己烷 |
| C.丙烯分子中所有原子处于同一平面 |
| D.有机物C3H8和C6H14是同系物 |
您最近一年使用:0次
名校
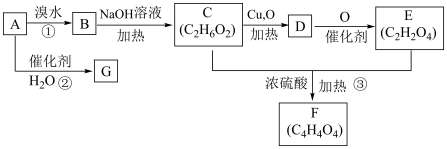
7 . 烃A是一种基础化工原料,其产量可用来衡量一个国家的石油化学工业的发展水平。已知有关物质转化关系如图: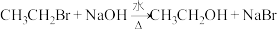 。
。
(1)请写出G的结构简式___________ ,其官能团名称为___________ 。
(2)反应③属于___________ 反应。
(3)下列说法正确的是___________ 。
A.反应①和反应②的基本反应类型相同
B.物质A可在一定条件下发生氧化反应、加聚反应
C.物质C是G的同系物
D.物质F中所有C原子可能在同一平面上
E.若乙烷气体中混有少量气体A,可用酸性 溶液除去
溶液除去
(4)请写出C生成D的化学方程式:___________ 。
(5)物质F是一种六元环结构,它的结构简式为___________ ,E与足量的金属Na和 溶液充分反应,分别生成的气体的体积比为
溶液充分反应,分别生成的气体的体积比为___________ 。
(6)H的分子式为 ,它有多种同分异构体,属于E的同系物有
,它有多种同分异构体,属于E的同系物有___________ 种,其中只有3种不同化学环境的氢原子的结构简式为___________ 。
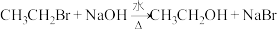 。
。(1)请写出G的结构简式
(2)反应③属于
(3)下列说法正确的是
A.反应①和反应②的基本反应类型相同
B.物质A可在一定条件下发生氧化反应、加聚反应
C.物质C是G的同系物
D.物质F中所有C原子可能在同一平面上
E.若乙烷气体中混有少量气体A,可用酸性
 溶液除去
溶液除去(4)请写出C生成D的化学方程式:
(5)物质F是一种六元环结构,它的结构简式为
 溶液充分反应,分别生成的气体的体积比为
溶液充分反应,分别生成的气体的体积比为(6)H的分子式为
 ,它有多种同分异构体,属于E的同系物有
,它有多种同分异构体,属于E的同系物有
您最近一年使用:0次
名校
8 . 氨气是重要的化工原料,其制备与热力学研究在化工生产中十分重要。
(1)实验室用熟石灰和氯化铵为原料制备氨气,其化学方程式为___________ 。
(2)从制备到干燥、收集 并处理尾气所需装置的接口连接顺序是
并处理尾气所需装置的接口连接顺序是___________ 。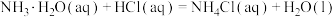 的焓变
的焓变 。
。
查阅资料:反应焓变可通过量热计对反应前后温度的变化测定,利用热量变化数值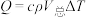 的原理,经换算得到反应的焓变,溶液中的反应可以近似认为
的原理,经换算得到反应的焓变,溶液中的反应可以近似认为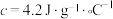 、
、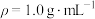 。
。
反应热的测定:取25.0℃下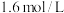 的氨水与
的氨水与 盐酸各
盐酸各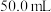 ,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
①根据测定数据计算反应I的
___________  。
。
②参考上述流程用氢氧化钠与盐酸进行实验,测得反应II: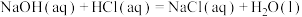 的焓变
的焓变 与
与 有一定差异,其原因是
有一定差异,其原因是___________ (从平衡移动角度作答)。
(4)甲同学欲借鉴(3)的方法测得反应III: 的焓变
的焓变 ,但发现气态反应过程中
,但发现气态反应过程中 、
、 变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
①补全b的待测过程___________ 。
②计算反应III的
___________ (列式表示)。
(5)丙同学查阅资料发现,气态反应可通过测定不同温度下的平衡常数,利用以下原理换算得到焓变: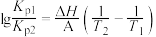
式中A为常数(已知),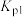 、
、 表示在
表示在 或
或 温度下反应的压强平衡常数。
温度下反应的压强平衡常数。
丙同学根据该原理设计了相关方案,测得了反应III的焓变,该方案是___________ (要求:方案中须写明待测的物理量,可选用仪器、药品:气压计、恒温反应器、温度计、 )。
)。
(1)实验室用熟石灰和氯化铵为原料制备氨气,其化学方程式为
(2)从制备到干燥、收集
 并处理尾气所需装置的接口连接顺序是
并处理尾气所需装置的接口连接顺序是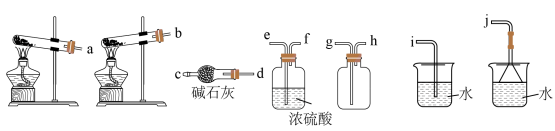
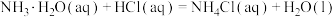 的焓变
的焓变 。
。查阅资料:反应焓变可通过量热计对反应前后温度的变化测定,利用热量变化数值
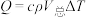 的原理,经换算得到反应的焓变,溶液中的反应可以近似认为
的原理,经换算得到反应的焓变,溶液中的反应可以近似认为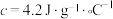 、
、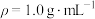 。
。反应热的测定:取25.0℃下
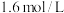 的氨水与
的氨水与 盐酸各
盐酸各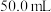 ,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。①根据测定数据计算反应I的

 。
。②参考上述流程用氢氧化钠与盐酸进行实验,测得反应II:
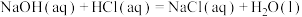 的焓变
的焓变 与
与 有一定差异,其原因是
有一定差异,其原因是(4)甲同学欲借鉴(3)的方法测得反应III:
 的焓变
的焓变 ,但发现气态反应过程中
,但发现气态反应过程中 、
、 变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:| 实验序号 | 待测过程 | 焓变 |
| a | 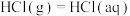 | 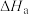 |
| b | 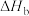 | |
| c |  | 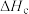 |
②计算反应III的

(5)丙同学查阅资料发现,气态反应可通过测定不同温度下的平衡常数,利用以下原理换算得到焓变:
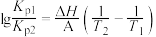
式中A为常数(已知),
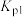 、
、 表示在
表示在 或
或 温度下反应的压强平衡常数。
温度下反应的压强平衡常数。丙同学根据该原理设计了相关方案,测得了反应III的焓变,该方案是
 )。
)。
您最近一年使用:0次
9 . 有机酸广泛存在于自然界,且在生产和生活中都发挥着重要作用。
(1) 紫色配离子可由含
紫色配离子可由含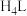 (有机酸)的
(有机酸)的 溶液与硝酸反应生成。
溶液与硝酸反应生成。
①基态 的价电子轨道表示式为
的价电子轨道表示式为___________ 。
②完成反应的离子方程式:___________ 。
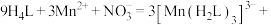 ___________+___________
___________+___________
(2) 是一种二元弱酸。常温下,向一定体积的
是一种二元弱酸。常温下,向一定体积的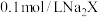 溶液中通入
溶液中通入 气体(假设过程中溶液体积不变),溶液中主要存在以下过程:
气体(假设过程中溶液体积不变),溶液中主要存在以下过程:
(a)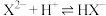

(b)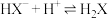

①关于 溶液,下列说法正确的有
溶液,下列说法正确的有___________ 。
A.加水稀释,平衡时溶液中离子总数减小
B.升高温度,平衡时溶液中 增大
增大
C.溶液中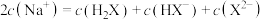
D.随着 的通入,溶液中
的通入,溶液中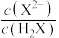 逐渐减小
逐渐减小
② 通入过程中,溶液内
通入过程中,溶液内 [
[ 表示
表示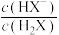 或
或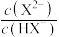 ]随
]随 的变化关系如图所示:
的变化关系如图所示:
___________ 。
(ii) 时,溶液中
时,溶液中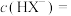
___________  ,
,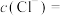
___________  。
。
(3)HR是含磷的一元有机弱酸。研究组配制了HR起始浓度 相同、
相同、 不同的系列溶液,平衡后测定其核磁共振磷谱。HR与
不同的系列溶液,平衡后测定其核磁共振磷谱。HR与 的某个特征P原子在核磁共振谱图上存在不同的化学位移。在水溶液中,实际测得的化学位移
的某个特征P原子在核磁共振谱图上存在不同的化学位移。在水溶液中,实际测得的化学位移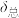 是HR与
是HR与 各自化学位移的加权平均值:
各自化学位移的加权平均值: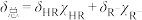 。其中
。其中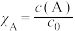 ,A表示
,A表示 或
或 。下图给出了含磷弱酸
。下图给出了含磷弱酸 在不同
在不同 下总化学位移的变化。
下总化学位移的变化。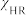 随
随 减小而
减小而___________ (填“增大”、“减小”或“不变”),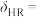
___________  。
。
②当 时,对应图中点
时,对应图中点___________ (填“A”、“B”、“C”或“D”)。
(1)
 紫色配离子可由含
紫色配离子可由含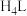 (有机酸)的
(有机酸)的 溶液与硝酸反应生成。
溶液与硝酸反应生成。①基态
 的价电子轨道表示式为
的价电子轨道表示式为②完成反应的离子方程式:
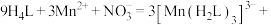 ___________+___________
___________+___________
(2)
 是一种二元弱酸。常温下,向一定体积的
是一种二元弱酸。常温下,向一定体积的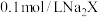 溶液中通入
溶液中通入 气体(假设过程中溶液体积不变),溶液中主要存在以下过程:
气体(假设过程中溶液体积不变),溶液中主要存在以下过程:(a)
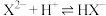

(b)
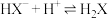

①关于
 溶液,下列说法正确的有
溶液,下列说法正确的有A.加水稀释,平衡时溶液中离子总数减小
B.升高温度,平衡时溶液中
 增大
增大C.溶液中
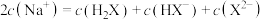
D.随着
 的通入,溶液中
的通入,溶液中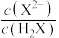 逐渐减小
逐渐减小②
 通入过程中,溶液内
通入过程中,溶液内 [
[ 表示
表示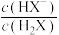 或
或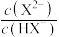 ]随
]随 的变化关系如图所示:
的变化关系如图所示: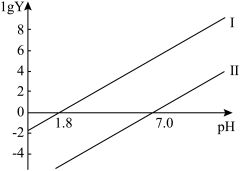

(ii)
 时,溶液中
时,溶液中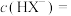
 ,
,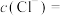
 。
。(3)HR是含磷的一元有机弱酸。研究组配制了HR起始浓度
 相同、
相同、 不同的系列溶液,平衡后测定其核磁共振磷谱。HR与
不同的系列溶液,平衡后测定其核磁共振磷谱。HR与 的某个特征P原子在核磁共振谱图上存在不同的化学位移。在水溶液中,实际测得的化学位移
的某个特征P原子在核磁共振谱图上存在不同的化学位移。在水溶液中,实际测得的化学位移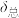 是HR与
是HR与 各自化学位移的加权平均值:
各自化学位移的加权平均值: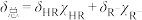 。其中
。其中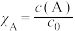 ,A表示
,A表示 或
或 。下图给出了含磷弱酸
。下图给出了含磷弱酸 在不同
在不同 下总化学位移的变化。
下总化学位移的变化。
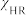 随
随 减小而
减小而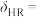
 。
。②当
 时,对应图中点
时,对应图中点
您最近一年使用:0次
10 . Mo和Ni为重要战略性金属,从废钼催化剂(主要成分为 、
、 少量NiS、NiO、
少量NiS、NiO、 等)中回收有价金属的工艺流程如图所示:
等)中回收有价金属的工艺流程如图所示:
①“沉钼”前钼元素主要以 形式存在。
形式存在。
②常温下,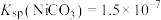 ,
,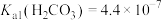 ,
,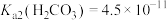 ,
,
③
④金属离子开始沉淀和完全沉淀时pH范围:
请回答
(1)“焙烧”过程中采用多层逆流(空气从炉底进入,固体粉末从炉顶投入),该操作的优点为___________ 。写出在“焙烧”过程中 被氧化的化学方程式:
被氧化的化学方程式:___________ 。
(2)“除铁”时调节溶液pH范围是___________ ;已知“沉镍”所得滤液的 ,则滤液中
,则滤液中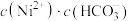 约为
约为___________ 
(3)写出“沉钼”时的离子方程式:___________ 。
(4) 与丁二酮(
与丁二酮( )反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验
)反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验 ,丁二酮肟中的碳氮双键是由
,丁二酮肟中的碳氮双键是由___________ 轨道重叠而成的(填字母)。
A. 和
和 B.sp和
B.sp和 C.sp和2p D.2p和2p E.
C.sp和2p D.2p和2p E. 和2p
和2p
(5)氮化钼量子点可应用于电池及催化领域,其晶胞结构如图所示,氮化钼的化学式为___________ 。若晶胞密度为 ,则晶胞参数a=
,则晶胞参数a=___________ nm。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 、
、 少量NiS、NiO、
少量NiS、NiO、 等)中回收有价金属的工艺流程如图所示:
等)中回收有价金属的工艺流程如图所示: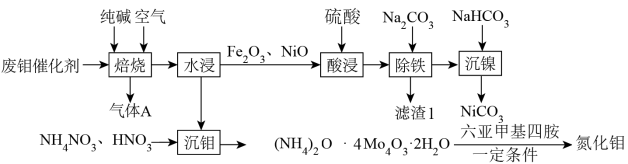
①“沉钼”前钼元素主要以
 形式存在。
形式存在。②常温下,
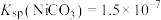 ,
,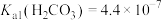 ,
,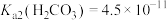 ,
,③

④金属离子开始沉淀和完全沉淀时pH范围:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 2.7 | 3.7 |
 | 7.1 | 9.2 |
(1)“焙烧”过程中采用多层逆流(空气从炉底进入,固体粉末从炉顶投入),该操作的优点为
 被氧化的化学方程式:
被氧化的化学方程式:(2)“除铁”时调节溶液pH范围是
 ,则滤液中
,则滤液中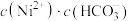 约为
约为
(3)写出“沉钼”时的离子方程式:
(4)
 与丁二酮(
与丁二酮( )反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验
)反应会生成鲜红色的丁二酮肟镍沉淀,该反应可用于检验 ,丁二酮肟中的碳氮双键是由
,丁二酮肟中的碳氮双键是由A.
 和
和 B.sp和
B.sp和 C.sp和2p D.2p和2p E.
C.sp和2p D.2p和2p E. 和2p
和2p(5)氮化钼量子点可应用于电池及催化领域,其晶胞结构如图所示,氮化钼的化学式为
 ,则晶胞参数a=
,则晶胞参数a= 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次



