名校
解题方法
1 . 为改变生橡胶受热发粘遇冷变硬的不良性能,工业上常将橡胶硫化来改善橡胶的性能, 和
和 均为改善橡胶性能的重要化工产品。
均为改善橡胶性能的重要化工产品。
Ⅰ.已知反应: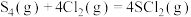 。下列为部分化学键的键能及
。下列为部分化学键的键能及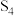 的结构式(键能是指化学键形成时放出的能量或化学键断裂时吸收的能量):
的结构式(键能是指化学键形成时放出的能量或化学键断裂时吸收的能量):
(1)则该反应是一个__________ (填“吸热”或“放热”)反应。
Ⅱ. 通常是一种金黄色液体,沸点为138 ℃,遇水反应生成S、
通常是一种金黄色液体,沸点为138 ℃,遇水反应生成S、 和HCl,热稳定性较差。实验室采用如下装置(加热和夹持仪器已略去)将氯气通入熔融硫黄(熔点为113 ℃)模拟工业生产
和HCl,热稳定性较差。实验室采用如下装置(加热和夹持仪器已略去)将氯气通入熔融硫黄(熔点为113 ℃)模拟工业生产 ,已知装置B的加热温度控制在140 ℃,回答下列问题:
,已知装置B的加热温度控制在140 ℃,回答下列问题:__________ ,A中发生的化学反应方程式为______________________________ 。
(3)装置接口从左到右的顺序为:a→__________ (填小写字母)。
(4)证明实验中有 生成的现象是
生成的现象是____________________ 。装置C中所装碱石灰的作用是____________________ 。
(5)实验结束时,装置B中烧瓶底部有少量硫附着,可用热的NaOH浓溶液洗涤,该反应的离子方程式为____________________ (产物为 和
和 )。
)。
(6)同学们联想到铁与硫单质也能反应。在空气中加热硫粉和铁粉的混合物,可观察到下列现象:
①有淡蓝色火焰,且生成刺激性气味的气体;
②混合物变红,放出热量,最后变成黑色固体;
③不时有火星从混合物中射出。
请写出产生现象②发生反应的化学方程式:________________________________ 。
 和
和 均为改善橡胶性能的重要化工产品。
均为改善橡胶性能的重要化工产品。Ⅰ.已知反应:
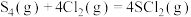 。下列为部分化学键的键能及
。下列为部分化学键的键能及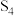 的结构式(键能是指化学键形成时放出的能量或化学键断裂时吸收的能量):
的结构式(键能是指化学键形成时放出的能量或化学键断裂时吸收的能量):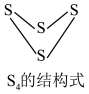
化学键 | S-S | S-Cl | Cl-Cl |
键能/(kJ/mol) | 266 | 255 | 243 |
(1)则该反应是一个
Ⅱ.
 通常是一种金黄色液体,沸点为138 ℃,遇水反应生成S、
通常是一种金黄色液体,沸点为138 ℃,遇水反应生成S、 和HCl,热稳定性较差。实验室采用如下装置(加热和夹持仪器已略去)将氯气通入熔融硫黄(熔点为113 ℃)模拟工业生产
和HCl,热稳定性较差。实验室采用如下装置(加热和夹持仪器已略去)将氯气通入熔融硫黄(熔点为113 ℃)模拟工业生产 ,已知装置B的加热温度控制在140 ℃,回答下列问题:
,已知装置B的加热温度控制在140 ℃,回答下列问题: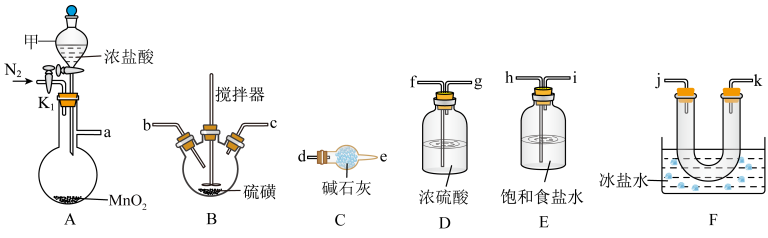
(3)装置接口从左到右的顺序为:a→
(4)证明实验中有
 生成的现象是
生成的现象是(5)实验结束时,装置B中烧瓶底部有少量硫附着,可用热的NaOH浓溶液洗涤,该反应的离子方程式为
 和
和 )。
)。(6)同学们联想到铁与硫单质也能反应。在空气中加热硫粉和铁粉的混合物,可观察到下列现象:
①有淡蓝色火焰,且生成刺激性气味的气体;
②混合物变红,放出热量,最后变成黑色固体;
③不时有火星从混合物中射出。
请写出产生现象②发生反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 烯烃的加氢甲酰化反应是醛合成中重要的均相催化工业反应之一。我国科学家利用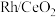 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: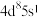 ,位于周期表第五周期第
,位于周期表第五周期第_____ 族,位于_____ 区。
(2)基态O原子核外电子有_____ 种不同的空间运动状态。
(3)乙中C原子的杂化类型是_____ 。
(4)丙分子中所含元素电负性由大到小顺序为_____ 。丙分子有_____ 个手性碳原子。
(5)已知: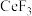 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是_____ 。
(6) 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。_____ 。该晶体密度为_____  。
。
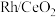 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: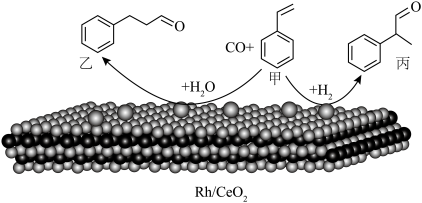
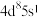 ,位于周期表第五周期第
,位于周期表第五周期第(2)基态O原子核外电子有
(3)乙中C原子的杂化类型是
(4)丙分子中所含元素电负性由大到小顺序为
(5)已知:
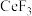 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是(6)
 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。
 。
。
您最近一年使用:0次
3 . 有机物M是新型苯二氮卓类镇静剂,其合成路线如下:
(1)G中所含官能团名称为___________ 。
(2)已知B的分子式为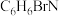 ,写出B的结构简式:
,写出B的结构简式:___________ ,其化学名称为___________ 。
(3)K的结构简式为___________ ,J→K的反应类型为___________ 。
(4)F+G→H分两步进行,第1步为加成反应,第2步为消去反应。写出第1步反应的化学方程式:___________ 。
(5)E的芳香族同分异构体中,符合下列条件的有种(不考虑立体异构体,不考虑 环状化合物)。
环状化合物)。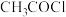 )、苯和甲胺(
)、苯和甲胺( )为原料,设计制备
)为原料,设计制备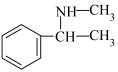 的合成路线:
的合成路线:___________ (其他无机试剂任选)。

(1)G中所含官能团名称为
(2)已知B的分子式为
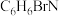 ,写出B的结构简式:
,写出B的结构简式:(3)K的结构简式为
(4)F+G→H分两步进行,第1步为加成反应,第2步为消去反应。写出第1步反应的化学方程式:
(5)E的芳香族同分异构体中,符合下列条件的有种(不考虑立体异构体,不考虑
 环状化合物)。
环状化合物)。①分子中含有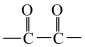 ;②核磁共振氢谱有四组峰。
;②核磁共振氢谱有四组峰。
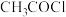 )、苯和甲胺(
)、苯和甲胺( )为原料,设计制备
)为原料,设计制备 的合成路线:
的合成路线:
您最近一年使用:0次
4 . “碳达峰·碳中和”是我国社会发展重大战略之一,以 、
、 为原料合成
为原料合成 是有效途径之一,涉及的主要反应如下:
是有效途径之一,涉及的主要反应如下:
I.
 kJ⋅mol-1
kJ⋅mol-1 
II.
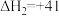 kJ⋅mol-1
kJ⋅mol-1 
(1)有利于提高平衡时 生成
生成 的选择性条件是
的选择性条件是_______ 。
A.低温低压 B.低温高压 C.高温低压 D.高温高压
增大压强反应II平衡移动的方向是_______ (填正向、逆向、不移动,无法判断)。
(2)反应I中正活化能E(正I)_______ (填大于,小于,等于)逆活化能E(逆I),已知反应II的正活化能E(正II)远大于E(正I),升高温度反应I和II正反应速率变化较大的是_______ (填I或II)。
(3)反应III. 的
的
_______ kJ⋅mol ,
,
_______ (用 ,
, 表示)。
表示)。
(4)向体积为1L的恒温恒容密闭容器中通入1mol 和3mol
和3mol ,在一定条件下发生I、II、III三个反应,达到平衡时测定,
,在一定条件下发生I、II、III三个反应,达到平衡时测定,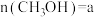 mol,
mol,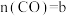 mol此时
mol此时
_______ mol(用含a、b的代数式表示,下同),反应III的平衡常数为_______ 。
(5)以 、
、 为原料合成
为原料合成 时,使用a、b、c三种催化剂,反应I(图1)和反应II(图2)的反应历程和能量变化的影响如下图所示:
时,使用a、b、c三种催化剂,反应I(图1)和反应II(图2)的反应历程和能量变化的影响如下图所示: 、
、 为原料合成
为原料合成 的催化活性由强到弱的顺序为
的催化活性由强到弱的顺序为_______ (用字母a、b、c排序)。
 、
、 为原料合成
为原料合成 是有效途径之一,涉及的主要反应如下:
是有效途径之一,涉及的主要反应如下:I.

 kJ⋅mol-1
kJ⋅mol-1 
II.

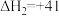 kJ⋅mol-1
kJ⋅mol-1 
(1)有利于提高平衡时
 生成
生成 的选择性条件是
的选择性条件是A.低温低压 B.低温高压 C.高温低压 D.高温高压
增大压强反应II平衡移动的方向是
(2)反应I中正活化能E(正I)
(3)反应III.
 的
的
 ,
,
 ,
, 表示)。
表示)。(4)向体积为1L的恒温恒容密闭容器中通入1mol
 和3mol
和3mol ,在一定条件下发生I、II、III三个反应,达到平衡时测定,
,在一定条件下发生I、II、III三个反应,达到平衡时测定,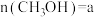 mol,
mol,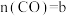 mol此时
mol此时
(5)以
 、
、 为原料合成
为原料合成 时,使用a、b、c三种催化剂,反应I(图1)和反应II(图2)的反应历程和能量变化的影响如下图所示:
时,使用a、b、c三种催化剂,反应I(图1)和反应II(图2)的反应历程和能量变化的影响如下图所示: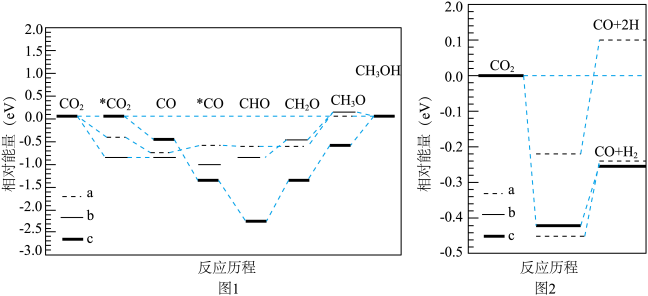
 、
、 为原料合成
为原料合成 的催化活性由强到弱的顺序为
的催化活性由强到弱的顺序为
您最近一年使用:0次
解题方法
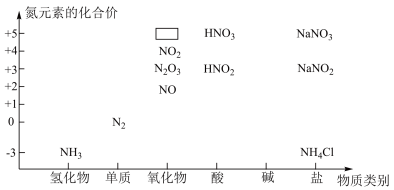
5 . 下图是氮的化合物的“价类二维图”。______ ,该物质的电子式_____ 。
(2)写出实验室制取氨气的化学方程式:______ 。
(3)实验室中硝酸通常保存在棕色瓶中,硝酸保存在棕色瓶中的原因:____ (请用方程式解释。)
(4)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。铜与浓硝酸反应的化学方程式为_____ ;以上反应中酸性与氧化性硝酸的物质的量之比_____ 。
(5)工业生产中为了盛装大量浓硝酸,可选择_____ 作为罐体材料。
a.铜 b.铝 c.铂 d.镁
(2)写出实验室制取氨气的化学方程式:
(3)实验室中硝酸通常保存在棕色瓶中,硝酸保存在棕色瓶中的原因:
(4)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。铜与浓硝酸反应的化学方程式为
(5)工业生产中为了盛装大量浓硝酸,可选择
a.铜 b.铝 c.铂 d.镁
您最近一年使用:0次
解题方法
6 . 中国高铁对实现“一带一路”的倡议有重要的作用。
(1)高铁上的信息传输系统使用了光导纤维,其主要成分是______ ;乘务员使用的无线通话机的芯片材料是______ 。
(2)SiO2是一种酸性氧化物,能与强碱溶液反应。例如,SiO2与NaOH反应可生成 。
。 的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可以用作黏合剂和防火剂。请写出相关反应的化学方程式
的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可以用作黏合剂和防火剂。请写出相关反应的化学方程式______ 。
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为______ 。
(4)氮化硅(Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备: 。
。
①以及以上反应中的氧化剂______ ,还原剂 ______ 。
②若该反应生成67.2L一氧化碳(标准状况),则生成氮化硅的质量_______ g。
(1)高铁上的信息传输系统使用了光导纤维,其主要成分是
(2)SiO2是一种酸性氧化物,能与强碱溶液反应。例如,SiO2与NaOH反应可生成
 。
。 的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可以用作黏合剂和防火剂。请写出相关反应的化学方程式
的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可以用作黏合剂和防火剂。请写出相关反应的化学方程式(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为
(4)氮化硅(Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备:
 。
。①以及以上反应中的氧化剂
②若该反应生成67.2L一氧化碳(标准状况),则生成氮化硅的质量
您最近一年使用:0次
名校
解题方法
7 .  是一种对环境友好的新型能源,可直接作内燃机燃料,也可以作燃料电池的直接能量来源。基于
是一种对环境友好的新型能源,可直接作内燃机燃料,也可以作燃料电池的直接能量来源。基于 载氮体的碳基化学链合成氨过程如下:
载氮体的碳基化学链合成氨过程如下:
吸氮反应: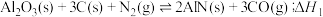
释氮反应: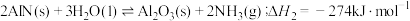
(1)已知总反应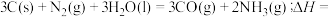
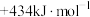 ,该反应能自发进行的条件为
,该反应能自发进行的条件为___________ (填“高温”“低温”或“任意温度”),吸氮反应正反应的活化能___________ (填“>”“<”或“=”)逆反应的活化能。
(2)与传统工业合成氨相比,该工艺的优点是___________ 。
(3)不同碳源的吸氮反应的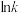 (
( 为速率常数)随温度倒数的关系如图所示。已知
为速率常数)随温度倒数的关系如图所示。已知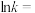
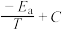 ,其中
,其中 为活化能,C为常数。
为活化能,C为常数。___________ ,原因是___________ 。
(4)T℃下,将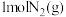 和足量的
和足量的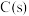 、
、 放入一容积可变的密闭容器内,在催化剂作用下仅发生反应
放入一容积可变的密闭容器内,在催化剂作用下仅发生反应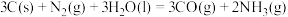 ,实验测得平衡体系中气体组分的物质的量分数随压强的变化如图。
,实验测得平衡体系中气体组分的物质的量分数随压强的变化如图。 的物质的量分数随压强变化的曲线为
的物质的量分数随压强变化的曲线为___________ (填“ ”“
”“ ”或“
”或“ ”),理由是
”),理由是___________ 。
②该反应在b点对应条件下的压强平衡常数
___________  (
( 为用分压表示的平衡常数,分压=总压
为用分压表示的平衡常数,分压=总压 物质的量分数,用含
物质的量分数,用含 的式子表示,列出计算式即可);达到平衡点b后,保持其他条件不变,再向容器中充入
的式子表示,列出计算式即可);达到平衡点b后,保持其他条件不变,再向容器中充入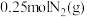 和
和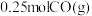 ,此时
,此时
___________ (填“>”“<”或“=”) 。
。
 是一种对环境友好的新型能源,可直接作内燃机燃料,也可以作燃料电池的直接能量来源。基于
是一种对环境友好的新型能源,可直接作内燃机燃料,也可以作燃料电池的直接能量来源。基于 载氮体的碳基化学链合成氨过程如下:
载氮体的碳基化学链合成氨过程如下:吸氮反应:
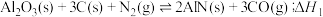
释氮反应:
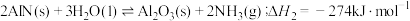
(1)已知总反应
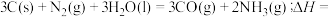
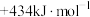 ,该反应能自发进行的条件为
,该反应能自发进行的条件为(2)与传统工业合成氨相比,该工艺的优点是
(3)不同碳源的吸氮反应的
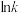 (
( 为速率常数)随温度倒数的关系如图所示。已知
为速率常数)随温度倒数的关系如图所示。已知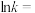
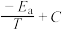 ,其中
,其中 为活化能,C为常数。
为活化能,C为常数。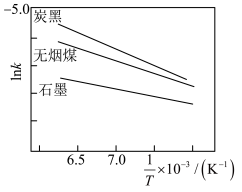
(4)T℃下,将
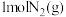 和足量的
和足量的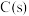 、
、 放入一容积可变的密闭容器内,在催化剂作用下仅发生反应
放入一容积可变的密闭容器内,在催化剂作用下仅发生反应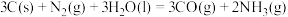 ,实验测得平衡体系中气体组分的物质的量分数随压强的变化如图。
,实验测得平衡体系中气体组分的物质的量分数随压强的变化如图。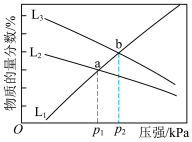
 的物质的量分数随压强变化的曲线为
的物质的量分数随压强变化的曲线为 ”“
”“ ”或“
”或“ ”),理由是
”),理由是②该反应在b点对应条件下的压强平衡常数

 (
( 为用分压表示的平衡常数,分压=总压
为用分压表示的平衡常数,分压=总压 物质的量分数,用含
物质的量分数,用含 的式子表示,列出计算式即可);达到平衡点b后,保持其他条件不变,再向容器中充入
的式子表示,列出计算式即可);达到平衡点b后,保持其他条件不变,再向容器中充入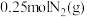 和
和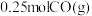 ,此时
,此时
 。
。
您最近一年使用:0次
2024-05-12更新
|
103次组卷
|
2卷引用:2024届陕西省商洛市高三下学期第五次模拟检测理综试题-高中化学
解题方法
8 . 向一定浓度硝酸银溶液中加入 溶液,产生
溶液,产生 沉淀,若加入过量
沉淀,若加入过量 溶液,沉淀会逐渐溶解,同时溶液中产生
溶液,沉淀会逐渐溶解,同时溶液中产生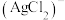 。溶液中含
。溶液中含 离子[
离子[ 和
和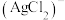 ]和
]和 的浓度关系如图所示[已知
的浓度关系如图所示[已知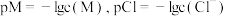 ],下列说法错误的是
],下列说法错误的是
 溶液,产生
溶液,产生 沉淀,若加入过量
沉淀,若加入过量 溶液,沉淀会逐渐溶解,同时溶液中产生
溶液,沉淀会逐渐溶解,同时溶液中产生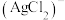 。溶液中含
。溶液中含 离子[
离子[ 和
和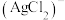 ]和
]和 的浓度关系如图所示[已知
的浓度关系如图所示[已知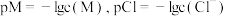 ],下列说法错误的是
],下列说法错误的是
A.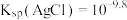 |
B.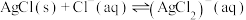 的 的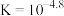 |
C.随着 溶液的加入, 溶液的加入, 先升高后降低 先升高后降低 |
D. 点时溶液中存在: 点时溶液中存在: |
您最近一年使用:0次
解题方法
9 . 电化学原理在污染治理方面有着重要的作用。回答下列问题:
I.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:
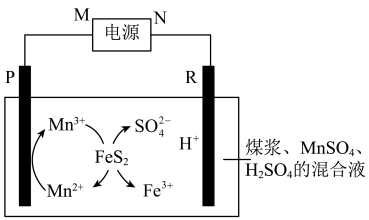
已知:两电极为完全相同的惰性电极。
(1)M为电源的___________ 极。
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式___________ 。
(3)电解池工作时,混合液中 的物质的量
的物质的量___________ (填“变大”、“变小”或“不变”)。
(4)电解过程中,混合溶液中的pH将___________ (填“变大”、“变小”或“不变”),理由是___________ 。
II.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:
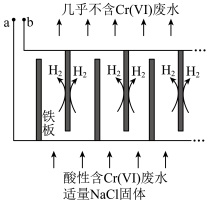
(5)酸性废水中的 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为___________ 。
(6)为了使 和
和 转化为
转化为 和
和 沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中
沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中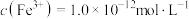 ,则溶液中
,则溶液中
___________  。{已知
。{已知 ,
,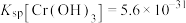 }
}
(7)随着电解的进行,阳极铁板会发生钝化,表面形成 的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失,结合有关反应,解释钝化膜消失的原因:
的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失,结合有关反应,解释钝化膜消失的原因:___________ 。
I.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:

已知:两电极为完全相同的惰性电极。
(1)M为电源的
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式
(3)电解池工作时,混合液中
 的物质的量
的物质的量(4)电解过程中,混合溶液中的pH将
II.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:

(5)酸性废水中的
 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为(6)为了使
 和
和 转化为
转化为 和
和 沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中
沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中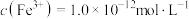 ,则溶液中
,则溶液中
 。{已知
。{已知 ,
,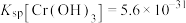 }
}(7)随着电解的进行,阳极铁板会发生钝化,表面形成
 的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失,结合有关反应,解释钝化膜消失的原因:
的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失,结合有关反应,解释钝化膜消失的原因:
您最近一年使用:0次
10 . 合金是重要的金属材料。回答下列问题:
I.2023年5月,由中国自主研发的C919大型客机开启常态化商业运行。飞机上广泛应用了各种铝合金材料。
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是___________ (填字母)。
A.密度小、强度好 B.密度大、硬度大 C.熔点低、硬度小
(2)铝的金属活动性比铁强,空气中铝却比铁具有更好的抗腐蚀性,原因是___________ 。
(3)起落架可用铝镁合金制造。合金焊接前需用碱洗,写出该过程发生的离子反应方程式___________ 。
II.某工厂合金废料的主要成分为 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该废料制取氯化铝、绿矾晶体(
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该废料制取氯化铝、绿矾晶体( )和胆矾晶体。
)和胆矾晶体。
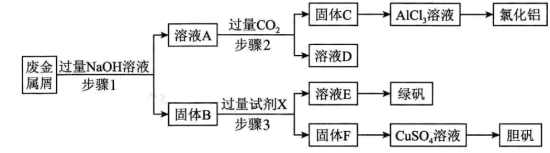
(4)试剂X是___________ ;固体F是___________ 。
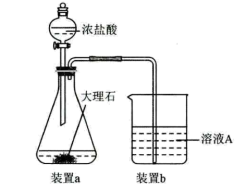
(5)在步骤2时,用如图装置制取 并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在装置a和b间加一个盛有饱和
并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在装置a和b间加一个盛有饱和___________ (填化学式)溶液的洗气瓶。
(6)溶液E中含有 ,生成该物质的原因是
,生成该物质的原因是___________ (用离子方程式表示)。
I.2023年5月,由中国自主研发的C919大型客机开启常态化商业运行。飞机上广泛应用了各种铝合金材料。
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是
A.密度小、强度好 B.密度大、硬度大 C.熔点低、硬度小
(2)铝的金属活动性比铁强,空气中铝却比铁具有更好的抗腐蚀性,原因是
(3)起落架可用铝镁合金制造。合金焊接前需用碱洗,写出该过程发生的离子反应方程式
II.某工厂合金废料的主要成分为
 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该废料制取氯化铝、绿矾晶体(
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该废料制取氯化铝、绿矾晶体( )和胆矾晶体。
)和胆矾晶体。
(4)试剂X是
(5)在步骤2时,用如图装置制取
 并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在装置a和b间加一个盛有饱和
并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在装置a和b间加一个盛有饱和
(6)溶液E中含有
 ,生成该物质的原因是
,生成该物质的原因是
您最近一年使用:0次



