名校
解题方法
1 . 天然气净化厂和石油化工厂均需要处理过程气中的 、
、 ,以实现硫资源的高效回收和含硫污染物的减排。
,以实现硫资源的高效回收和含硫污染物的减排。
(1)一般采用选择性加氢催化剂处理 ,将其转化为单质硫,主要发生以下反应:
,将其转化为单质硫,主要发生以下反应:
反应Ⅰ:

反应Ⅱ: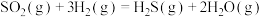
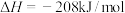
则反应 的
的
_____ 。
理论上分析,处理 时,下列措施中能提高
时,下列措施中能提高 的平衡转化率,同时加快反应速率的是
的平衡转化率,同时加快反应速率的是_____ 。
A.升高温度 B.降低温度 C.增大压强 D.增大 的浓度
的浓度
(2)下图表示反应温度对选择性加氢催化剂活性的影响判断 加氢转化为
加氢转化为 的最佳温度为
的最佳温度为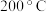 ,理由是
,理由是______ 。在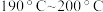 阶段
阶段 总转化率增幅较大,试推测其主要原因
总转化率增幅较大,试推测其主要原因_____ 。 可采用高温热分解法:
可采用高温热分解法: 。已知:组分的平衡分压
。已知:组分的平衡分压 组分的物质的量分数
组分的物质的量分数 总压。
总压。
①保持总压不变时,在 热分解反应器中通入
热分解反应器中通入 ,可提高
,可提高 平衡转化率,其原因是
平衡转化率,其原因是_____ 。在一定反应条件下,将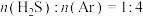 的混合气进行
的混合气进行 热分解反应,平衡时混合气中
热分解反应,平衡时混合气中 分压是
分压是 的2倍,则
的2倍,则 平衡转化率为
平衡转化率为_____ 。
②若 的压力转化率表示为
的压力转化率表示为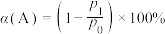 (
( 为
为 的初始压力,
的初始压力, 为某时刻
为某时刻 的分压),维持温度和压强不变,一定量的
的分压),维持温度和压强不变,一定量的 分解达到平衡时,用各组分的平衡分压表示的平衡常数
分解达到平衡时,用各组分的平衡分压表示的平衡常数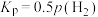 ,则平衡时
,则平衡时 的压力转化率
的压力转化率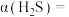
_____ 。
 、
、 ,以实现硫资源的高效回收和含硫污染物的减排。
,以实现硫资源的高效回收和含硫污染物的减排。(1)一般采用选择性加氢催化剂处理
 ,将其转化为单质硫,主要发生以下反应:
,将其转化为单质硫,主要发生以下反应:反应Ⅰ:


反应Ⅱ:
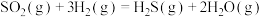
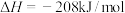
则反应
 的
的
理论上分析,处理
 时,下列措施中能提高
时,下列措施中能提高 的平衡转化率,同时加快反应速率的是
的平衡转化率,同时加快反应速率的是A.升高温度 B.降低温度 C.增大压强 D.增大
 的浓度
的浓度(2)下图表示反应温度对选择性加氢催化剂活性的影响判断
 加氢转化为
加氢转化为 的最佳温度为
的最佳温度为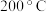 ,理由是
,理由是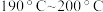 阶段
阶段 总转化率增幅较大,试推测其主要原因
总转化率增幅较大,试推测其主要原因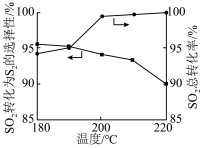
 可采用高温热分解法:
可采用高温热分解法: 。已知:组分的平衡分压
。已知:组分的平衡分压 组分的物质的量分数
组分的物质的量分数 总压。
总压。①保持总压不变时,在
 热分解反应器中通入
热分解反应器中通入 ,可提高
,可提高 平衡转化率,其原因是
平衡转化率,其原因是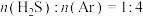 的混合气进行
的混合气进行 热分解反应,平衡时混合气中
热分解反应,平衡时混合气中 分压是
分压是 的2倍,则
的2倍,则 平衡转化率为
平衡转化率为②若
 的压力转化率表示为
的压力转化率表示为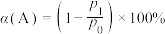 (
( 为
为 的初始压力,
的初始压力, 为某时刻
为某时刻 的分压),维持温度和压强不变,一定量的
的分压),维持温度和压强不变,一定量的 分解达到平衡时,用各组分的平衡分压表示的平衡常数
分解达到平衡时,用各组分的平衡分压表示的平衡常数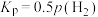 ,则平衡时
,则平衡时 的压力转化率
的压力转化率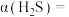
您最近一年使用:0次
2024-06-10更新
|
25次组卷
|
2卷引用:陕西省西安中学2023-2024学年高三下学期模拟预测(五)理综试题-高中化学
名校
2 . 低品质能源利用是指对热值较低、含杂物较高等特点的一类能源的利用。如图所示装置,可同时利用低温废热和含铜废液,并达到对含铜废液富集和产生电能的目的。起始时电极均为泡沫铜且质量相等,含铜废液的浓度为0.1 ,以2.5
,以2.5
 溶液作为电解质溶液,向M极区液体中加入2
溶液作为电解质溶液,向M极区液体中加入2 氨水开始反应。下列说法正确的是
氨水开始反应。下列说法正确的是
 ,以2.5
,以2.5
 溶液作为电解质溶液,向M极区液体中加入2
溶液作为电解质溶液,向M极区液体中加入2 氨水开始反应。下列说法正确的是
氨水开始反应。下列说法正确的是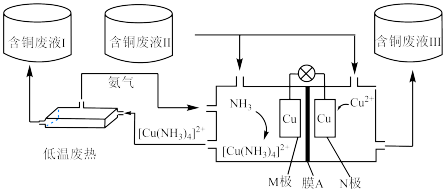
| A.向M极区液体中加入氨水可使M极电势高于N极电势 |
B.含铜废液Ⅰ、Ⅲ中的 均高于含铜废液Ⅱ中的 均高于含铜废液Ⅱ中的 |
| C.电子由M极经导线移向N极 |
| D.电极质量差为6.4g时,电路中通过0.2mol电子 |
您最近一年使用:0次
2024-06-09更新
|
299次组卷
|
5卷引用:2024届陕西省安康市高新中学、安康中学高新分校高三下学期模拟预测(三)理综试题-高中化学
解题方法
3 .  常用作有机合成中的还原剂,其合成反应为
常用作有机合成中的还原剂,其合成反应为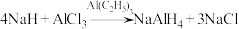 。回答下列问题:
。回答下列问题:
(1)基态氧原子中价层电子排布图为___________ ,O、H、Al电负性由大到小的顺序为___________ ,钠的焰色是黄色,产生此焰色时属于___________ (填“发射”或“吸收”)光谱。
(2)已知 熔点为194℃、NaCl熔点为801℃,其原因是
熔点为194℃、NaCl熔点为801℃,其原因是___________ ,又知铝的第一电离能比镁的第一电离能小,原因是___________ 。
(3)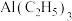 中碳原子的杂化方式为
中碳原子的杂化方式为___________ , 的空间构型为
的空间构型为___________ , 中不存在的化学键是
中不存在的化学键是___________ (填字母)。
A.σ键 B.配位键 C.离子键 D.非极性键
(4) 晶体密度为
晶体密度为 ,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为___________ ,阿伏加德罗常数
___________  。
。
 常用作有机合成中的还原剂,其合成反应为
常用作有机合成中的还原剂,其合成反应为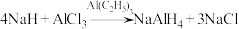 。回答下列问题:
。回答下列问题:(1)基态氧原子中价层电子排布图为
(2)已知
 熔点为194℃、NaCl熔点为801℃,其原因是
熔点为194℃、NaCl熔点为801℃,其原因是(3)
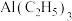 中碳原子的杂化方式为
中碳原子的杂化方式为 的空间构型为
的空间构型为 中不存在的化学键是
中不存在的化学键是A.σ键 B.配位键 C.离子键 D.非极性键
(4)
 晶体密度为
晶体密度为 ,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
 。
。
您最近一年使用:0次
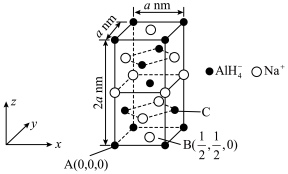
4 . 铁—铬液流电池储能技术被称为储能时间最长、最安全的电化学储能技术之一,其工作原理如图所示。下列说法错误的是
| A.放电时,M为正极 |
B.充电时,阴极反应式为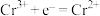 |
C.若用该电池电解饱和食盐水,当有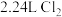 生成时,则有 生成时,则有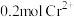 被氧化 被氧化 |
D.充电时,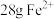 被氧化时,则有 被氧化时,则有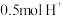 由左向右通过质子交换膜 由左向右通过质子交换膜 |
您最近一年使用:0次
5 .  是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈_______ 色,原因是_______ 。
(2) 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。_______ (填“ ”或“
”或“ ”)。
”)。
(3)充电时,每个 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为_______ (用含 的代数式作答)。当
的代数式作答)。当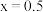 时,
时,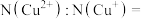
_______ 。 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是_______ 。
(4) 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: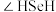
_______ (填“>”或“<”)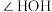 ,说明原因:
,说明原因:_______ 。
(5)立方 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为_______  (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价
是一种钠离子电池正极材料,充、放电过程中正极材料立方晶胞示意图的组成变化如图所示,晶胞内未标出因放电产生的0价 。
。
 呈黄色,
呈黄色, 呈绿色,
呈绿色, 呈蓝色等;预测
呈蓝色等;预测 呈
呈(2)
 可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。
可以形成多种配合物,其中的甘氨酸铜对于预防和治疗贫血、骨质疏松等疾病具有一定的作用,它有顺式和反式两种同分异构体,结构如图。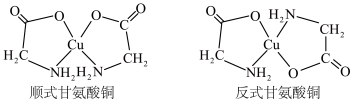
 ”或“
”或“ ”)。
”)。(3)充电时,每个
 晶胞完全转化为
晶胞完全转化为 晶胞。每个
晶胞。每个 晶胞中
晶胞中 个数为
个数为 的代数式作答)。当
的代数式作答)。当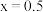 时,
时,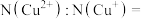
 晶胞中互不相邻的
晶胞中互不相邻的 围成的空间结构是
围成的空间结构是(4)
 可以与稀硫酸反应生成
可以与稀硫酸反应生成 ,比较
,比较 和
和 键角的大小:
键角的大小: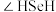
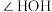 ,说明原因:
,说明原因:(5)立方
 晶胞的晶胞参数为
晶胞的晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为 (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
6 . 某兴趣小组在实验室模拟侯氏制碱法制备 ,部分实验装置如图所示,下列说法正确的是
,部分实验装置如图所示,下列说法正确的是
 ,部分实验装置如图所示,下列说法正确的是
,部分实验装置如图所示,下列说法正确的是
| A.实验过程中向启普发生器中添加液体时,可以取下Ⅰ处胶塞加入 |
B.所用试剂有稀硫酸、浓硫酸、 、饱和食盐水、 、饱和食盐水、 、 、 、蒸馏水 、蒸馏水 |
| C.开始实验时,应先打开活塞Ⅱ,再打开活塞Ⅲ |
D.试剂d为冰水,以降低 的溶解度,促进晶体的析出 的溶解度,促进晶体的析出 |
您最近一年使用:0次
2024-06-08更新
|
116次组卷
|
2卷引用:2024届陕西省安康市高新中学、安康中学高新分校高三下学期模拟预测(三)理综试题-高中化学
7 . Ⅰ.请根据题意选择下列物质,并用其字母代号填空:
A.明矾[KAl(SO4)2] B.Ca(OH)2 C.NaHCO3 D.水玻璃
(1)要使焙制的糕点,松软可以添加________ 。
(2)要使含泥沙的水变澄清,可使用________ 。
(3)要中和钢铁厂,电镀厂产生的酸性废水可使用__________ 。
(4)可用作防火材料的是________ 。
Ⅱ.以化合价为纵坐标,物质类别为横坐标的图像称为“价—类”二维图。如图是氯元素的部分“价—类”二维图。
(5)工业上干燥的Cl2贮存在________ 中。
(6)Y的化学式为________ 。
(7)Cl2转化成Z和HCl的离子方程式为________________ 。
(8)将Cl2与SO2按1∶1通入紫色石蕊溶液中,现象为_________________ 。
A.明矾[KAl(SO4)2] B.Ca(OH)2 C.NaHCO3 D.水玻璃
(1)要使焙制的糕点,松软可以添加
(2)要使含泥沙的水变澄清,可使用
(3)要中和钢铁厂,电镀厂产生的酸性废水可使用
(4)可用作防火材料的是
Ⅱ.以化合价为纵坐标,物质类别为横坐标的图像称为“价—类”二维图。如图是氯元素的部分“价—类”二维图。
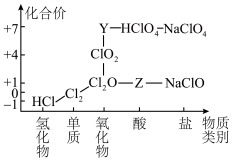
(5)工业上干燥的Cl2贮存在
(6)Y的化学式为
(7)Cl2转化成Z和HCl的离子方程式为
(8)将Cl2与SO2按1∶1通入紫色石蕊溶液中,现象为
您最近一年使用:0次
解题方法
8 . 学习小组在实验室中利用下图装置制备SO2并进行相关性质的探究。
(1)仪器Q的名称为_________ 。
(2)装置B是为了观察气体的流速,则试剂M为_________(填字母)。
(3)装置C中出现的现象说明SO2具有_________ 性。
(4)装置E中__________________ (填现象)可说明SO2具有还原性,发生反应的离子方程式为__________________ 。
(5)装置F的作用是_________ 。
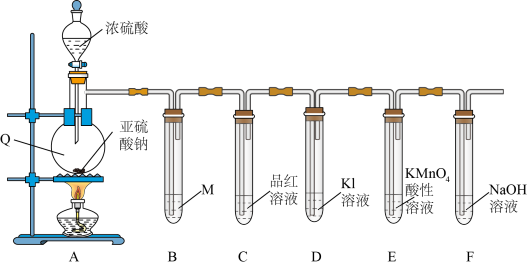
(1)仪器Q的名称为
(2)装置B是为了观察气体的流速,则试剂M为_________(填字母)。
| A.NaOH溶液 | B.饱和NaHSO3溶液 | C.Na2S溶液 | D.Na2SO3溶液 |
(3)装置C中出现的现象说明SO2具有
(4)装置E中
(5)装置F的作用是
您最近一年使用:0次
解题方法
9 . 铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。某厂以硅铍石(主要含有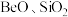 ,还有少量
,还有少量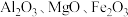 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以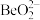 的形式存在;
的形式存在;
②氯化铍在熔融态时较难电离;
③ 为离子化合物,熔点为
为离子化合物,熔点为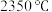 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;
④不同金属离子在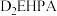 中的溶解性如表所示:
中的溶解性如表所示:
(1)“滤渣”的主要成分为_______ (填化学式)。
(2)“萃取分液”除去的离子主要是_______ 。若铍的萃取按如下反应式进行: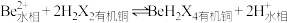 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为_______ 。
(3)“煮沸”时,发生反应的离子方程式为_______ 。
(4)写出高温条件下“转化”的化学方程式:_______ 。
(5)“电解”制铍时,加入与 等物质的量的
等物质的量的 的作用是
的作用是_______ ,不用电解 的方法制金属铍的原因是
的方法制金属铍的原因是_______ 。
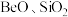 ,还有少量
,还有少量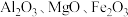 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。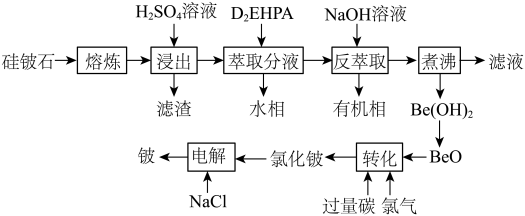
 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以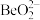 的形式存在;
的形式存在;②氯化铍在熔融态时较难电离;
③
 为离子化合物,熔点为
为离子化合物,熔点为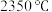 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;④不同金属离子在
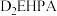 中的溶解性如表所示:
中的溶解性如表所示:金属离子 |
|
|
|
|
| 易溶 | 难溶 | 微溶 | 微溶 |
(1)“滤渣”的主要成分为
(2)“萃取分液”除去的离子主要是
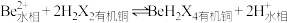 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为(3)“煮沸”时,发生反应的离子方程式为
(4)写出高温条件下“转化”的化学方程式:
(5)“电解”制铍时,加入与
 等物质的量的
等物质的量的 的作用是
的作用是 的方法制金属铍的原因是
的方法制金属铍的原因是
您最近一年使用:0次
名校
解题方法
10 . 为实现“碳中和”“碳达峰”,碳的循环利用是重要措施。利用氢气和CO反应生成甲烷,涉及的反应如下:
i.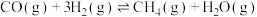

ii.

iii.

回答下列问题:
(1)在25℃和101kPa下, 转变为
转变为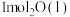 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
________  。
。
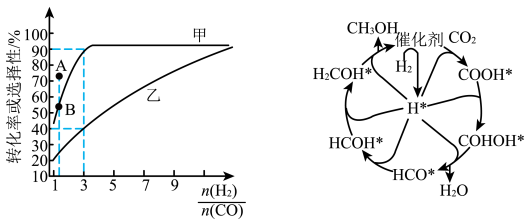
(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。 选择性变化的曲线是
选择性变化的曲线是________ (填“甲”或“乙”),保持 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为________ 。
②相同温度下,向恒容容器内加入 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为________ mol,反应ii的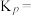
________ (保留小数点后一位)。
(3) 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共________ 种, 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为________ 。
i.
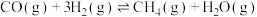

ii.


iii.


回答下列问题:
(1)在25℃和101kPa下,
 转变为
转变为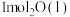 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
 。
。(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及
 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。
 选择性变化的曲线是
选择性变化的曲线是 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为②相同温度下,向恒容容器内加入
 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为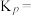
(3)
 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为
您最近一年使用:0次
2024-06-08更新
|
225次组卷
|
7卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学






