1 . 有机物M是新型苯二氮卓类镇静剂,其合成路线如下:
(1)G中所含官能团名称为___________ 。
(2)已知B的分子式为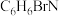 ,写出B的结构简式:
,写出B的结构简式:___________ ,其化学名称为___________ 。
(3)K的结构简式为___________ ,J→K的反应类型为___________ 。
(4)F+G→H分两步进行,第1步为加成反应,第2步为消去反应。写出第1步反应的化学方程式:___________ 。
(5)E的芳香族同分异构体中,符合下列条件的有种(不考虑立体异构体,不考虑 环状化合物)。
环状化合物)。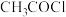 )、苯和甲胺(
)、苯和甲胺( )为原料,设计制备
)为原料,设计制备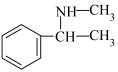 的合成路线:
的合成路线:___________ (其他无机试剂任选)。

(1)G中所含官能团名称为
(2)已知B的分子式为
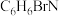 ,写出B的结构简式:
,写出B的结构简式:(3)K的结构简式为
(4)F+G→H分两步进行,第1步为加成反应,第2步为消去反应。写出第1步反应的化学方程式:
(5)E的芳香族同分异构体中,符合下列条件的有种(不考虑立体异构体,不考虑
 环状化合物)。
环状化合物)。①分子中含有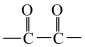 ;②核磁共振氢谱有四组峰。
;②核磁共振氢谱有四组峰。
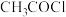 )、苯和甲胺(
)、苯和甲胺( )为原料,设计制备
)为原料,设计制备 的合成路线:
的合成路线:
您最近一年使用:0次
2 . 铬酸铅[常温下,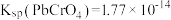 ]又称铬黄,常用于染料或颜料,某同学在实验室以
]又称铬黄,常用于染料或颜料,某同学在实验室以 为原料制备
为原料制备 ,实验步骤如下:
,实验步骤如下:
步骤1:称取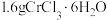 于
于 的烧杯中,加入
的烧杯中,加入 蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的
蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的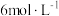 的
的 溶液;
溶液;
步骤2:向上述溶液中逐滴滴入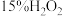 溶液,溶液由绿色变为黄色。加热煮沸
溶液,溶液由绿色变为黄色。加热煮沸 ,将多余的
,将多余的 赶尽,此时溶液变为亮黄色。再逐滴滴入
赶尽,此时溶液变为亮黄色。再逐滴滴入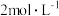 的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的
的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的 为4.6;
为4.6;
步骤3:在煮沸条件下逐滴滴入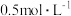 的
的 溶液,加入第一滴后先搅拌
溶液,加入第一滴后先搅拌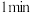 再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入
再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入 溶液。继续煮沸
溶液。继续煮沸 ,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬( )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、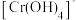 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体。回答下列问题:
为难溶于水的灰蓝色固体。回答下列问题:
(1)实验室在配制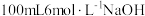 溶液时,下列仪器一定不需要的是___________(填字母)。
溶液时,下列仪器一定不需要的是___________(填字母)。
(2)步骤1中加入稍微过量的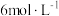 的
的 溶液过程中的现象是
溶液过程中的现象是___________ , 溶液不能过量太多,其原因是
溶液不能过量太多,其原因是___________ 。
(3)步骤2溶液中逐滴滴入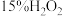 溶液,溶液由绿色变为黄色。发生反应的离子方程式为
溶液,溶液由绿色变为黄色。发生反应的离子方程式为___________ 。
(4)步骤2用硝酸调节 ,存在如下平衡:
,存在如下平衡: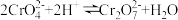 。已知
。已知 随
随 的变化如图所示。
的变化如图所示。 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。
②升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
___________ (填“>”或“<”)0。
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
(6)对于步骤3,甲同学提出可用 代替
代替 作为原料,乙同学认为
作为原料,乙同学认为 难溶于水
难溶于水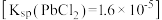 ,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是___________ 。
 ]又称铬黄,常用于染料或颜料,某同学在实验室以
]又称铬黄,常用于染料或颜料,某同学在实验室以 为原料制备
为原料制备 ,实验步骤如下:
,实验步骤如下:步骤1:称取
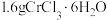 于
于 的烧杯中,加入
的烧杯中,加入 蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的
蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的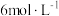 的
的 溶液;
溶液;步骤2:向上述溶液中逐滴滴入
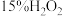 溶液,溶液由绿色变为黄色。加热煮沸
溶液,溶液由绿色变为黄色。加热煮沸 ,将多余的
,将多余的 赶尽,此时溶液变为亮黄色。再逐滴滴入
赶尽,此时溶液变为亮黄色。再逐滴滴入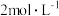 的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的
的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的 为4.6;
为4.6;步骤3:在煮沸条件下逐滴滴入
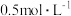 的
的 溶液,加入第一滴后先搅拌
溶液,加入第一滴后先搅拌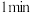 再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入
再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入 溶液。继续煮沸
溶液。继续煮沸 ,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬(
 )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、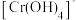 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体。回答下列问题:
为难溶于水的灰蓝色固体。回答下列问题:(1)实验室在配制
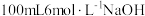 溶液时,下列仪器一定不需要的是___________(填字母)。
溶液时,下列仪器一定不需要的是___________(填字母)。A. | B. | C. | D. |
(2)步骤1中加入稍微过量的
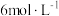 的
的 溶液过程中的现象是
溶液过程中的现象是 溶液不能过量太多,其原因是
溶液不能过量太多,其原因是(3)步骤2溶液中逐滴滴入
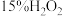 溶液,溶液由绿色变为黄色。发生反应的离子方程式为
溶液,溶液由绿色变为黄色。发生反应的离子方程式为(4)步骤2用硝酸调节
 ,存在如下平衡:
,存在如下平衡: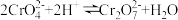 。已知
。已知 随
随 的变化如图所示。
的变化如图所示。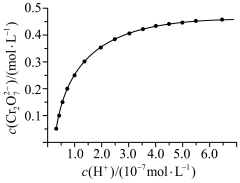
 的平衡转化率
的平衡转化率②升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
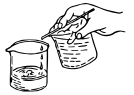
| A.该方法适用于过滤胶状沉淀或颗粒较小的沉淀 |
| B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤 |
| C.这种过滤方法可以避免沉淀堵塞滤纸小孔而影响过滤速度 |
| D.该操作中玻璃棒的作用为引流 |
(6)对于步骤3,甲同学提出可用
 代替
代替 作为原料,乙同学认为
作为原料,乙同学认为 难溶于水
难溶于水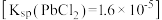 ,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
您最近一年使用:0次
3 . 铁及其化合物在化工生产中发挥着重要作用。回答下列问题:
(1)一定温度下,在某密闭无氧环境中热分解 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为___________ 。反应达平衡后,缩小容器体积,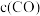
___________ (填“增大”“减小”或“不变”)。
(2)将 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: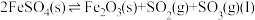 。平衡时
。平衡时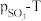 的关系如图所示。
的关系如图所示。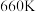 时,该反应的平衡总压
时,该反应的平衡总压
___________  ,压强平衡常数
,压强平衡常数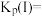
___________ 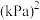 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。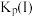 随反应温度升高而
随反应温度升高而___________ (填“增大”“减小”或“不变”)。 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:___________ 。
②“再生”时若 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是___________ 。
(1)一定温度下,在某密闭无氧环境中热分解
 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为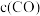
(2)将
 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: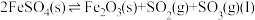 。平衡时
。平衡时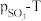 的关系如图所示。
的关系如图所示。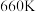 时,该反应的平衡总压
时,该反应的平衡总压
 ,压强平衡常数
,压强平衡常数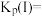
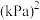 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。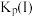 随反应温度升高而
随反应温度升高而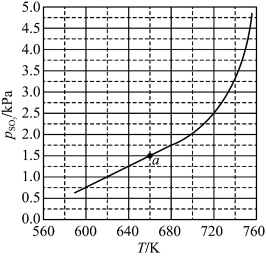
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。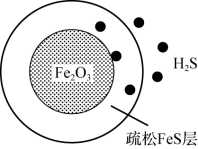
 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:②“再生”时若
 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
您最近一年使用:0次
解题方法
4 . BeO广泛用于电子、半导体和光学领域。工业上以绿柱石(主要成分为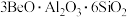 ,还含有少量铁元素)和方解石(主要成分为
,还含有少量铁元素)和方解石(主要成分为 )为原料制备BeO的流程如图所示:
)为原料制备BeO的流程如图所示: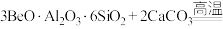
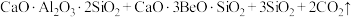 ;
;
②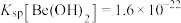 。
。
(1)“滤渣1”的主要成分为___________ (填化学式)。
(2)被浸物料和浸出试剂的流动方向相同时称为“顺流浸出”,相反则为“逆流浸出”,该流程采用“逆流浸出”的优点是___________ 。
(3)“结晶”过程中,铝会以铝铵矾[ ]的形式析出,写出该反应的离子方程式:
]的形式析出,写出该反应的离子方程式:___________ 。
(4)“转化”时加入 的作用是
的作用是___________ 。
(5)“调pH”除铁,利用平衡移动原理解释“调pH”过程中加入 可得到“滤渣2”的原因:
可得到“滤渣2”的原因:___________ 。
(6)“滤液”的主要成分为___________ (填化学式),可以返回___________ 工序循环使用。
(7)常温下,“沉淀”过程中加入 调节pH=5,溶液中的铍离子是否沉淀完全
调节pH=5,溶液中的铍离子是否沉淀完全___________ [列式计算,溶液中c(Mn+)≤1×10-5mol/L时,可认为该离子沉淀完全]。
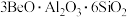 ,还含有少量铁元素)和方解石(主要成分为
,还含有少量铁元素)和方解石(主要成分为 )为原料制备BeO的流程如图所示:
)为原料制备BeO的流程如图所示:
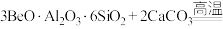
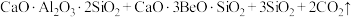 ;
;②
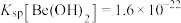 。
。(1)“滤渣1”的主要成分为
(2)被浸物料和浸出试剂的流动方向相同时称为“顺流浸出”,相反则为“逆流浸出”,该流程采用“逆流浸出”的优点是
(3)“结晶”过程中,铝会以铝铵矾[
 ]的形式析出,写出该反应的离子方程式:
]的形式析出,写出该反应的离子方程式:(4)“转化”时加入
 的作用是
的作用是(5)“调pH”除铁,利用平衡移动原理解释“调pH”过程中加入
 可得到“滤渣2”的原因:
可得到“滤渣2”的原因:(6)“滤液”的主要成分为
(7)常温下,“沉淀”过程中加入
 调节pH=5,溶液中的铍离子是否沉淀完全
调节pH=5,溶液中的铍离子是否沉淀完全
您最近一年使用:0次
解题方法
5 . 将 转化为
转化为 等燃料有助于降低大气中
等燃料有助于降低大气中 浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。
浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。
(1)已知下列反应的热化学方程式:
Ⅰ.2CO2(g)+2H2O(g)⇌2C2H4(g)+3O2(g) K1 ΔH1=+1323kJ/mol
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) K2 ΔH2=+41kJ/mol
Ⅲ.C2H4(g)+H2O(g)⇌C2H5OH(g) K3 ΔH3=-45.5kJ/mol
反应2CO(g)+5H2O(g)⇌2C2H5OH(g)+3O2(g)+2H2(g)的
___________ ,平衡常数K=___________ (用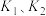 和
和 表示)。
表示)。
(2)将5mol 和20mol
和20mol 通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。
通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是___________ (填“低”或“高”,后同)温___________ 压。
②800K时,反应Ⅱ的平衡常数
___________ (用平衡分压代替物质的量浓度计算,保留两位有效数字)。
③500K时,若只发生反应Ⅳ,下列说法能判断反应达到平衡状态的是___________ (填标号)。
A.消耗1mol 的同时生成2mol
的同时生成2mol
B.混合气体的平均相对分子质量保持不变
C. 的体积分数不再变化
的体积分数不再变化
D.体系的温度不再发生变化
(3)我国科学家提出了一种用双催化剂协同催化 合成
合成 的路径。先利用催化剂将
的路径。先利用催化剂将 转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成
转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成 ,该过程能量与反应进程的关系如图2所示。
,该过程能量与反应进程的关系如图2所示。___________ (用“→”表示含碳物质间的转化)。
②游离态CO的自由能___________ (填“大于”或“小于”) *CO的自由能。
 转化为
转化为 等燃料有助于降低大气中
等燃料有助于降低大气中 浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。
浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。(1)已知下列反应的热化学方程式:
Ⅰ.2CO2(g)+2H2O(g)⇌2C2H4(g)+3O2(g) K1 ΔH1=+1323kJ/mol
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) K2 ΔH2=+41kJ/mol
Ⅲ.C2H4(g)+H2O(g)⇌C2H5OH(g) K3 ΔH3=-45.5kJ/mol
反应2CO(g)+5H2O(g)⇌2C2H5OH(g)+3O2(g)+2H2(g)的

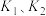 和
和 表示)。
表示)。(2)将5mol
 和20mol
和20mol 通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。
通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。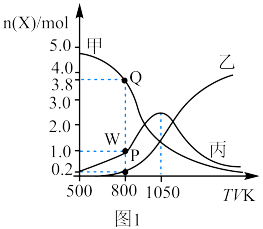
 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是②800K时,反应Ⅱ的平衡常数

③500K时,若只发生反应Ⅳ,下列说法能判断反应达到平衡状态的是
A.消耗1mol
 的同时生成2mol
的同时生成2mol
B.混合气体的平均相对分子质量保持不变
C.
 的体积分数不再变化
的体积分数不再变化D.体系的温度不再发生变化
(3)我国科学家提出了一种用双催化剂协同催化
 合成
合成 的路径。先利用催化剂将
的路径。先利用催化剂将 转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成
转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成 ,该过程能量与反应进程的关系如图2所示。
,该过程能量与反应进程的关系如图2所示。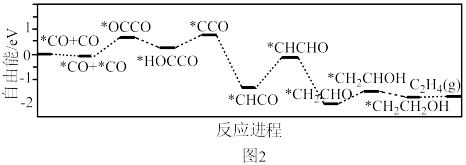
②游离态CO的自由能
您最近一年使用:0次
6 . 水系光电化学(PEC)电池利用光子打破稳定的化学键,是人工光合作用的重要途径。以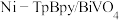 光电极作阳极,可提高电池效率和“光子经济性”,其工作原理如图所示。下列说法正确的是
光电极作阳极,可提高电池效率和“光子经济性”,其工作原理如图所示。下列说法正确的是
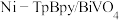 光电极作阳极,可提高电池效率和“光子经济性”,其工作原理如图所示。下列说法正确的是
光电极作阳极,可提高电池效率和“光子经济性”,其工作原理如图所示。下列说法正确的是
| A.电子流向:负极→阴极→阳极→正极 |
| B.光电极与铅蓄电池的Pb电极相连 |
C.阳极区总反应式为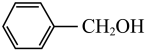 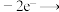   |
D.生成11.2L (标准状况下)的同时消耗108g苯甲醇 (标准状况下)的同时消耗108g苯甲醇 |
您最近一年使用:0次
7 . 生活中处处有化学。下列说法正确的是
| A.淀粉水解生成乙醇,可用于酿酒 |
| B.75%的酒精使蛋白质盐析,可用于杀菌消毒 |
C.植物油与 发生加成反应,可用于制人造黄油 发生加成反应,可用于制人造黄油 |
| D.纤维素在人体内水解成葡萄糖,可为人体供能 |
您最近一年使用:0次
2024-06-03更新
|
448次组卷
|
3卷引用:陕西省洛南中学2023-2024学年高三下学期第十次模拟考试理综试题-高中化学
解题方法
8 .  -呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下:
-呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下: -呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。
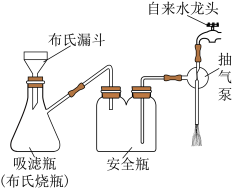
-呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。___________ 。
(2)与酒精灯加热相比,使用油浴加热的优点是___________ 。
(3)三颈烧瓶中反应已完成的标志是___________ 。
(4)分离出晶体时需减压抽滤,装置如图所示,抽滤的优点是___________ 。
称取mg -呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为
-呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为 的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。
的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②产品的纯度是___________ (以质量分数表示)。
③下列操作会使测定结果偏大的是___________ (填标号)。
A.称量样品时,将样品放在托盘天平的右盘
B.加热回流阶段,油浴时没有搅拌,出现焦化现象
C.滴定过程中,读数时,滴定前仰视,滴定后俯视
D.滴定前,尖嘴管有气泡,滴定后无气泡
 -呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下:
-呋喃丙烯酸是一种重要的有机酸,其实验室制备原理如下: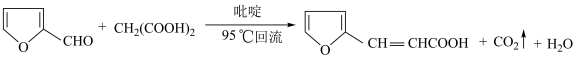
 -呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。
-呋喃丙烯酸的步骤如下:向三颈烧瓶中依次加入丙二酸、糠醛和吡啶,在95℃下回流2小时,停止反应;将混合物倒入装有100mL蒸馏水的烧杯中,加入固体碳酸钠中和至弱碱性,加入活性炭后煮沸5~10min脱色,趁热过滤;滤液在冰水浴中边搅拌边滴加浓盐酸至不再有沉淀生成,抽滤,用冷水洗涤2~3次,得到粗产品。实验装置如图所示。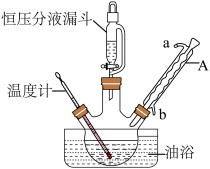
(2)与酒精灯加热相比,使用油浴加热的优点是
(3)三颈烧瓶中反应已完成的标志是
(4)分离出晶体时需减压抽滤,装置如图所示,抽滤的优点是
称取mg
 -呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为
-呋喃丙烯酸样品,加入1∶1的乙醇水溶液中,滴入2~3滴酚酞作指示剂,用浓度为 的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。
的氢氧化钠标准溶液滴定至终点,做3组平行实验,所消耗NaOH溶液的平均体积为VmL。①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②产品的纯度是
③下列操作会使测定结果偏大的是
A.称量样品时,将样品放在托盘天平的右盘
B.加热回流阶段,油浴时没有搅拌,出现焦化现象
C.滴定过程中,读数时,滴定前仰视,滴定后俯视
D.滴定前,尖嘴管有气泡,滴定后无气泡
您最近一年使用:0次
2024-06-01更新
|
148次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第五次模拟检测理综试题-高中化学
解题方法
9 . Ga与B、Al处于同一主族,氮化镓是制造LED的重要材料,被誉为第三代半导体材料。回答下列问题:
(1)基态Ga原子的价电子排布式为___________ 。
(2)Be、B、C的电负性由小到大的顺序为___________ ,第一电离能由小到大的顺序为___________ 。
(3)①乙硼烷( )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是___________ 。 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子___________ 。 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因___________ 。
③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是___________ 。
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为___________ ,晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Ga原子的价电子排布式为
(2)Be、B、C的电负性由小到大的顺序为
(3)①乙硼烷(
 )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子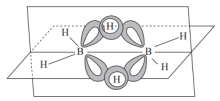
 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为
 (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。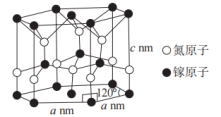
您最近一年使用:0次
10 . “推进文化自信自强,铸就社会主义文化新辉煌。”化学与文化传承密不可分,下列说法正确的是
| A.沏茶和煎制中药均利用了过滤、分液的原理 |
| B.“以火烧之,紫青烟起,乃真硝石也”涉及焰色试验,属于化学变化 |
| C.“新竹高于旧竹枝”中“竹”可用于制备乙醇 |
| D.古代绘制壁画使用的铁红可由铁与水在高温下反应制得 |
您最近一年使用:0次



