 和
和 共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:Ⅰ.
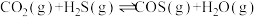
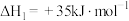
Ⅱ.
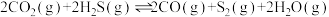
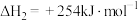
Ⅲ.
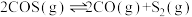

回答下列问题:
(1)反应Ⅲ的反应热

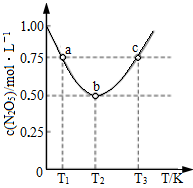
(2)向某密闭容器中投入等物质的量的
 和
和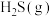 ,发生上述反应.其中
,发生上述反应.其中 的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;
的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;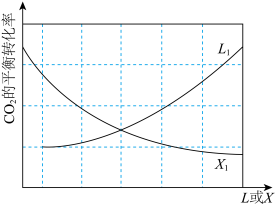
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是
A.
 和
和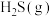 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时B.
 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3)
 下,向起始压强为
下,向起始压强为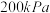 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 和
和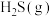 混合气体,发生上述反应,
混合气体,发生上述反应,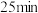 时达到平衡状态,测得此时体系总压强为
时达到平衡状态,测得此时体系总压强为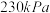 ,
, ;
;①平衡时
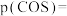
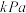 ;
;②
 的平均生成速率为
的平均生成速率为 ;
;③
 下反应Ⅲ的压力平衡常数
下反应Ⅲ的压力平衡常数
 ;
;
更新时间:2024-05-23 18:59:25
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲醇、乙醇是重要的化工原料,可以用多种方法合成。
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l)△H=-37.3kJ/mol,则CO2与H2反应生成甲醇蒸气和液态水的热化学方程式为___ 。
(2)若在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)下列能说明该反应达到平衡状态的是
CH3OH(g)+H2O(g)下列能说明该反应达到平衡状态的是___ 。
A.混合气体平均相对分子质量不变
B.混合气体密度不变
C.容器内压强恒定不变
D.反应速率满足以下关系:v正(CO2)=3v逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH—H键的同时形成2molH—O键
(3)下表所列数据是CO和H2形成CH3OH的反应在不同温度下的化学平衡常数(K)。
由表中数据判断该反应的△H___ 0(填“>”、“=”或“<”)
(4)甲醇也可由CO和H2合成,发生CO(g)+2H2(g) CH3OH(g)反应,T1℃时,在一个体积为1L的恒容容器中充入1molCO、3molH2,经过5min达到平衡,CO的转化率为80%,则5min内用H2表示的反应速率为v(H2)=
CH3OH(g)反应,T1℃时,在一个体积为1L的恒容容器中充入1molCO、3molH2,经过5min达到平衡,CO的转化率为80%,则5min内用H2表示的反应速率为v(H2)=___ 。此时,这个反应的平衡常数是___ ,反应温度为___ ℃。
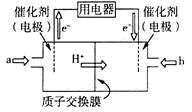
(5)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如图,质子交换膜左右两侧的溶液均为1L1.5mol/LH2SO4溶液。通入气体a的电极是电池的___ (填“正”或“负”)极,其电极反应式为__ 。
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l)△H=-37.3kJ/mol,则CO2与H2反应生成甲醇蒸气和液态水的热化学方程式为
(2)若在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)下列能说明该反应达到平衡状态的是
CH3OH(g)+H2O(g)下列能说明该反应达到平衡状态的是A.混合气体平均相对分子质量不变
B.混合气体密度不变
C.容器内压强恒定不变
D.反应速率满足以下关系:v正(CO2)=3v逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH—H键的同时形成2molH—O键
(3)下表所列数据是CO和H2形成CH3OH的反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(4)甲醇也可由CO和H2合成,发生CO(g)+2H2(g)
 CH3OH(g)反应,T1℃时,在一个体积为1L的恒容容器中充入1molCO、3molH2,经过5min达到平衡,CO的转化率为80%,则5min内用H2表示的反应速率为v(H2)=
CH3OH(g)反应,T1℃时,在一个体积为1L的恒容容器中充入1molCO、3molH2,经过5min达到平衡,CO的转化率为80%,则5min内用H2表示的反应速率为v(H2)=(5)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如图,质子交换膜左右两侧的溶液均为1L1.5mol/LH2SO4溶液。通入气体a的电极是电池的

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】汽车尾气中通常含有NxOy和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化进而减少汽车尾气对大气的污染。
(1)已知:①CO的燃烧热△H1=-283kJ·mol-1②N2(g)+O2(g) =2NO(g)△H2=+183kJ·mol-1
由此写出NO和CO反应的热化学反应方程式________________________________ 。
(2)一定温度下,向2L密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应4CO(g)+2NO2(g) N2(g)+4CO2(g)△H<0,测得相关数据如下:
N2(g)+4CO2(g)△H<0,测得相关数据如下:
①5〜l0min,用N2的浓度变化表示的反应速率为__________________ 。
②以下表述能说明该反应已达到平衡状态的是________ 。
A.气体颜色不再变化B.气体密度不再变化C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡______________ (填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=__________ (保留两位有效数字)。
(3)CO、空气与过量KOH溶液可构成燃料电池(石墨为电极):
①写出该电池的负极反应式____________________________ ;
②常温下,用该燃料电池电解(惰性电极)1L饱和食盐水(足量),当两极共生成4.48L (折算为标准状况)气体时电解池溶液的pH=__________ 。(忽略溶液的体积变化,已知1g2=0.3,lg5=0.7)
(1)已知:①CO的燃烧热△H1=-283kJ·mol-1②N2(g)+O2(g) =2NO(g)△H2=+183kJ·mol-1
由此写出NO和CO反应的热化学反应方程式
(2)一定温度下,向2L密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应4CO(g)+2NO2(g)
 N2(g)+4CO2(g)△H<0,测得相关数据如下:
N2(g)+4CO2(g)△H<0,测得相关数据如下:| 0 min | 5 min | 10 min | 15 min | 20 min | |
| c(NO2)/ mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| C(N2)/ mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②以下表述能说明该反应已达到平衡状态的是
A.气体颜色不再变化B.气体密度不再变化C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡
④该温度下反应的化学平衡常数K=
(3)CO、空气与过量KOH溶液可构成燃料电池(石墨为电极):
①写出该电池的负极反应式
②常温下,用该燃料电池电解(惰性电极)1L饱和食盐水(足量),当两极共生成4.48L (折算为标准状况)气体时电解池溶液的pH=
您最近一年使用:0次
【推荐3】甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
在以上制备甲醇的两个反应中,反应I优于反应Ⅱ,原因为___________
(2)下表所列数据是反应I在不同温度下的化学平衡常数的数值:
①在一密闭容器中发生反应工并达到平衡后,保持其他条件不变,对容器升温,此反应的化学平衡应___________ (填“正向”“逆向”或“不”)移动。
②某温度下,将1molCO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为___________ ,此时的温度___________ (填“>”“<”或“=”)250℃。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-Q1kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-Q2kJ/mol
③H2O(g)=H2O(l) △H3=-Q3kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:___________ 。
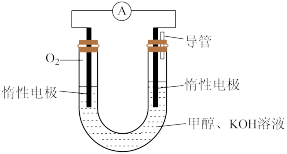
(4)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将___________ (填“升高”“降低”或“不变”),该燃料电池负极反应的离子方程式为___________ 。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2在以上制备甲醇的两个反应中,反应I优于反应Ⅱ,原因为
(2)下表所列数据是反应I在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①在一密闭容器中发生反应工并达到平衡后,保持其他条件不变,对容器升温,此反应的化学平衡应
②某温度下,将1molCO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-Q1kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-Q2kJ/mol
③H2O(g)=H2O(l) △H3=-Q3kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:
(4)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将

您最近一年使用:0次
【推荐1】丙烯腈主要用于制造聚丙烯腈、丁腈橡胶、染料、合成树脂、医药等。以氨、丙烯、氧气为原料,在催化剂存在下生成丙烯腈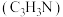 和副产物丙烯醛
和副产物丙烯醛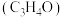 的热化学方程式如下:
的热化学方程式如下:
主反应:
 ;
;
副反应:
 。
。
(1)一定条件下,若容器内只发生主反应,在1L恒容密闭容器中通入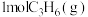 、
、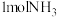 、
、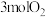 ,丙烯腈的产率与温度的关系如图所示。
,丙烯腈的产率与温度的关系如图所示。

①
________ 0(填“>”或“<”)。
②若该反应达到A点所需的时间为tmin,则理论上 的平均反应速率为
的平均反应速率为________ 。
(2)恒温恒容条件下,若容器内只发生主反应,下列选项表明反应一定已经达平衡状态的是________(填字母)。
(3)恒温时若容器内主反应、副反应同时发生,达到平衡后压缩容器体积,副反应的平衡移动方向为________ 。(填“正向移动”“逆向移动”或“不移动”)。
(4)已知对于反应: ,其标准平衡常数:
,其标准平衡常数: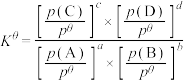 。T℃,压强为
。T℃,压强为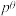 的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气同时发生主反应、副反应,达到平衡时容器内有
的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气同时发生主反应、副反应,达到平衡时容器内有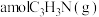 ,
,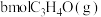 ,此时丙烯的分压
,此时丙烯的分压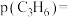
________ (分压=总压 物质的量分数,用含a,b的代数式表示,下同);副反应的标准平衡常数为
物质的量分数,用含a,b的代数式表示,下同);副反应的标准平衡常数为________ 。
(5)用丙烯腈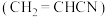 电合成已二腈
电合成已二腈 的原理如图:
的原理如图:
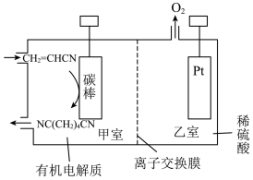
阴极的电极反应式为________ ;工作时乙室的pH________ (填“增大”“减小”或“不变”)
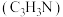 和副产物丙烯醛
和副产物丙烯醛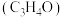 的热化学方程式如下:
的热化学方程式如下:主反应:

 ;
;副反应:

 。
。(1)一定条件下,若容器内只发生主反应,在1L恒容密闭容器中通入
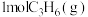 、
、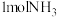 、
、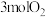 ,丙烯腈的产率与温度的关系如图所示。
,丙烯腈的产率与温度的关系如图所示。
①

②若该反应达到A点所需的时间为tmin,则理论上
 的平均反应速率为
的平均反应速率为(2)恒温恒容条件下,若容器内只发生主反应,下列选项表明反应一定已经达平衡状态的是________(填字母)。
A.容器内 的转化率保持不变 的转化率保持不变 | B.容器内混合气体的平均摩尔质量不再变化 |
| C.化学平衡常数保持不变 | D.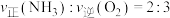 |
(4)已知对于反应:
 ,其标准平衡常数:
,其标准平衡常数: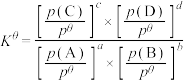 。T℃,压强为
。T℃,压强为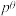 的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气同时发生主反应、副反应,达到平衡时容器内有
的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气同时发生主反应、副反应,达到平衡时容器内有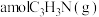 ,
,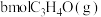 ,此时丙烯的分压
,此时丙烯的分压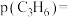
 物质的量分数,用含a,b的代数式表示,下同);副反应的标准平衡常数为
物质的量分数,用含a,b的代数式表示,下同);副反应的标准平衡常数为(5)用丙烯腈
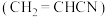 电合成已二腈
电合成已二腈 的原理如图:
的原理如图:
阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】按要求回答下列问题
(1)NaHCO3水解的离子方程式___________ 。
(2)Al2(SO4)3溶液和NaHCO3溶液混合的离子方程式___________ 。
(3)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,溶液显中性。用含a的代数式表示NH3H2O的电离常数Kb=___________ 。
(4)已知下表中数据
写出少量CO2通入到过量的NaClO溶液中的离子方程式:___________ 。
(5)已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41kJ∙mol-1
CO2(g)+H2(g) ΔH=-41kJ∙mol-1
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH=-187kJ∙mol-1
CH4(g)+2H2O(g) ΔH=-187kJ∙mol-1
写出CO与H2生成CH4和水蒸气的热化学方程式___________ 。
(6)CO(g)+2H2(g) CH3OH(g),恒温恒容时体积比1:1投入CO与H2,下列不能判断是否达到平衡的是________
CH3OH(g),恒温恒容时体积比1:1投入CO与H2,下列不能判断是否达到平衡的是________
a.平均分子量不再变化 b.混合气密度不再变化
c.CO体积分数不再变化 d.单位时间生成CH3OH与CO的体积相等
(7)Na2CO3溶液中各离子(五种)浓度从大到小的顺序为___________ 。
(1)NaHCO3水解的离子方程式
(2)Al2(SO4)3溶液和NaHCO3溶液混合的离子方程式
(3)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,溶液显中性。用含a的代数式表示NH3H2O的电离常数Kb=
(4)已知下表中数据
| 酸 | 电离常数(25℃) |
| H2CO3 | Kal=4.3×10-7;Ka2=5.6×10-11 |
| HClO | Ka=2.4×10-9 |
写出少量CO2通入到过量的NaClO溶液中的离子方程式:
(5)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41kJ∙mol-1
CO2(g)+H2(g) ΔH=-41kJ∙mol-1CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH=-187kJ∙mol-1
CH4(g)+2H2O(g) ΔH=-187kJ∙mol-1写出CO与H2生成CH4和水蒸气的热化学方程式
(6)CO(g)+2H2(g)
 CH3OH(g),恒温恒容时体积比1:1投入CO与H2,下列不能判断是否达到平衡的是________
CH3OH(g),恒温恒容时体积比1:1投入CO与H2,下列不能判断是否达到平衡的是________a.平均分子量不再变化 b.混合气密度不再变化
c.CO体积分数不再变化 d.单位时间生成CH3OH与CO的体积相等
(7)Na2CO3溶液中各离子(五种)浓度从大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”,以NOx和燃煤为主的污染综合治理是当前重要的研究课题。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ/mol
2NO2(g) ⇌ N2O4(g) ΔH=-56.9 kJ/mol
写出CH4(g)+N2O4(g) =N2(g)+CO2(g)+2H2O(g) ΔH=___________ 。
(2)汽车尾气中含有NOx主要以NO为主,净化的主要原理为:
2NO(g)+ 2CO(g) ⇌ 2CO2(g)+ N2(g) △H= akJ/mol
在500℃时,向恒容密闭体系中进行通入5mol的NO 和5 mol的CO进行反应时,体系中压强与时间的关系如图所示:
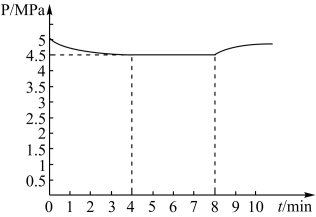
①求6min时NO的转化率___________ 。
②求在500℃平衡常数Kp=___________ MPa-1。(Kp为以平衡分压表示的平衡常数:平衡分压=总压×物质的量分数,计算结果保留2位有效数字)
③下列描述能说明反应达到平衡状态的是___________
A.混合气体的平均相对分子质量不变。
B.体系中混合气体密度不变
C.体系中NO 、CO、CO2、N2的浓度相等
D.单位时间内消耗n mol的NO 同时消耗 n mol的N2。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式如图所示:
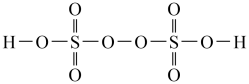
①在Ag+催化作用下,S2O 能与 Mn2+ 在水溶液中发生反应生成SO
能与 Mn2+ 在水溶液中发生反应生成SO 和 MnO
和 MnO ,1 molS2O
,1 molS2O 能氧化的 Mn2+ 的物质的量为
能氧化的 Mn2+ 的物质的量为___________ mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为___________ 。
(4)NaHS可用作处理含Hg2+的污水的沉淀剂,已知 25℃时,反应 Hg2+(aq)+HS-( aq) HgS(s) + H+(aq) 的平衡常数 K=l.75×l038,H2S的电离平衡常数Ka1=1.3×l0-7,Ka2=7.0×l 0-15,则Ksp(HgS) =
HgS(s) + H+(aq) 的平衡常数 K=l.75×l038,H2S的电离平衡常数Ka1=1.3×l0-7,Ka2=7.0×l 0-15,则Ksp(HgS) =___________ 。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ/mol
2NO2(g) ⇌ N2O4(g) ΔH=-56.9 kJ/mol
写出CH4(g)+N2O4(g) =N2(g)+CO2(g)+2H2O(g) ΔH=
(2)汽车尾气中含有NOx主要以NO为主,净化的主要原理为:
2NO(g)+ 2CO(g) ⇌ 2CO2(g)+ N2(g) △H= akJ/mol
在500℃时,向恒容密闭体系中进行通入5mol的NO 和5 mol的CO进行反应时,体系中压强与时间的关系如图所示:

①求6min时NO的转化率
②求在500℃平衡常数Kp=
③下列描述能说明反应达到平衡状态的是
A.混合气体的平均相对分子质量不变。
B.体系中混合气体密度不变
C.体系中NO 、CO、CO2、N2的浓度相等
D.单位时间内消耗n mol的NO 同时消耗 n mol的N2。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式如图所示:
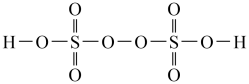
①在Ag+催化作用下,S2O
 能与 Mn2+ 在水溶液中发生反应生成SO
能与 Mn2+ 在水溶液中发生反应生成SO 和 MnO
和 MnO ,1 molS2O
,1 molS2O 能氧化的 Mn2+ 的物质的量为
能氧化的 Mn2+ 的物质的量为②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为
(4)NaHS可用作处理含Hg2+的污水的沉淀剂,已知 25℃时,反应 Hg2+(aq)+HS-( aq)
 HgS(s) + H+(aq) 的平衡常数 K=l.75×l038,H2S的电离平衡常数Ka1=1.3×l0-7,Ka2=7.0×l 0-15,则Ksp(HgS) =
HgS(s) + H+(aq) 的平衡常数 K=l.75×l038,H2S的电离平衡常数Ka1=1.3×l0-7,Ka2=7.0×l 0-15,则Ksp(HgS) =
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】CO、CO2、CH3OH等含碳物质是重要的基础化工原料。回答下列问题:
(1)CH3OH(l)气化时吸收的热量为27 kJ∙mol−1, CH3OH(g)的燃烧热为677 kJ∙mol−1,写出CH3OH(l)完全燃烧的热化学方程式:_________ 。
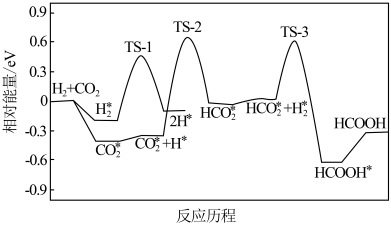
(2)CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。该历程中起决速步骤的化学方程式是_________ 。
(3)在恒温恒容密闭容器中投入足量石墨与CO2进行反应C(s)+CO2(g) 2CO(g),可判定其达到平衡的条件有_______(填序号)。
2CO(g),可判定其达到平衡的条件有_______(填序号)。
(4)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1
反应2:CO2(g) +H2(g) CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2
若起始按 =3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =
=3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =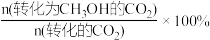 ]
]

①p1_____ (填 “>”或“<”)p2。
②温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是_____ 。
③250 °C时反应2的压强平衡常数Kp=_______ (结果保留2位有效数字)。
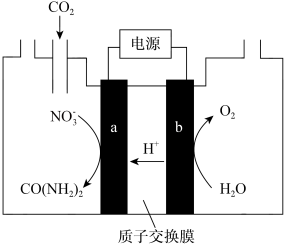
(5)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是_________ 。
(1)CH3OH(l)气化时吸收的热量为27 kJ∙mol−1, CH3OH(g)的燃烧热为677 kJ∙mol−1,写出CH3OH(l)完全燃烧的热化学方程式:
(2)CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。该历程中起决速步骤的化学方程式是

(3)在恒温恒容密闭容器中投入足量石墨与CO2进行反应C(s)+CO2(g)
 2CO(g),可判定其达到平衡的条件有_______(填序号)。
2CO(g),可判定其达到平衡的条件有_______(填序号)。| A.容器总压保持不变 | B.相同时间内,消耗1molCO2的同时生成2molCO |
| C.CO的体积分数保持不变 | D.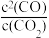 保持不变 保持不变 |
(4)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1反应2:CO2(g) +H2(g)
 CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2若起始按
 =3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =
=3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =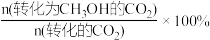 ]
]
①p1
②温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是
③250 °C时反应2的压强平衡常数Kp=
(5)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氮及其化合物在工业生产中有广泛用。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为___ (填化学式)。
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:__________________ 。
(3)已知以下热化学方程式: 2N2O5(g) 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH1
2NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g) N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3
①ΔH3=______________________ (用ΔH1、ΔH2表示)。
②一定温度下,在恒容密闭容器中进行反应:3NO2(g) N2O5(g)+NO(g),下列表明反应已达到平衡状态的是
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________ 。
A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D. 保持不变
保持不变
(4)在密闭容器中充入NO,发生反应2NO(g) N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
①ΔH________ 0。(填“>”“<”或“=”)
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是_________ 。
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g) 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________ 。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________ (填“增大”“减小”或“不变”)。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:
(3)已知以下热化学方程式: 2N2O5(g)
 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH12NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g)
 N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3①ΔH3=
②一定温度下,在恒容密闭容器中进行反应:3NO2(g)
 N2O5(g)+NO(g),下列表明反应已达到平衡状态的是
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D.
 保持不变
保持不变(4)在密闭容器中充入NO,发生反应2NO(g)
 N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。①ΔH
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g)
 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】石油化工、煤化工等行业的废气中普遍含有硫化氢, 的回收利用有重要意义。以下是
的回收利用有重要意义。以下是 处理的一些方法。
处理的一些方法。
完成下列填空:
Ⅰ.用氢氧化钠溶液吸收。
(1)硫化氢被完全吸收后,溶液里含硫的微粒可能为_______ ,25℃时若溶液 ,则溶液中
,则溶液中
_______  (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。
Ⅱ.制取 ,其反应的能量示意如下图所示。
,其反应的能量示意如下图所示。

(2)写出该总反应的热化学方程式。_______
Ⅲ.高温分解: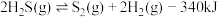
(3)能够判断上述反应到达平衡状态的是_______ 。(选填编号)
a. 的浓度保持不变b.气体的质量保持不变
的浓度保持不变b.气体的质量保持不变
c.恒容时,容器的压强保持不变d.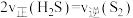
(4)在恒温恒压条件下,充入氩气,发现: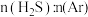 越小,
越小, 平衡转化率越大,请解释可能的原因。
平衡转化率越大,请解释可能的原因。_______
Ⅳ.将 燃烧,产生的
燃烧,产生的 与剩余
与剩余 混合后反应,生成单质硫回收。
混合后反应,生成单质硫回收。
①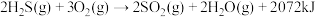
②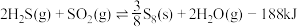
(5)②的平衡常数表达式为_______ ,某温度下,若只发生反应②,从反应开始到15s时,测得容器内的气体密度减小了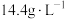 ,则
,则 内,
内, 平均反应速率
平均反应速率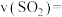
_______ 。
(6)在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为: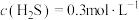 、
、 、
、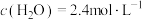 ,请计算开始时投料比
,请计算开始时投料比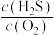
_______ 。
 的回收利用有重要意义。以下是
的回收利用有重要意义。以下是 处理的一些方法。
处理的一些方法。完成下列填空:
Ⅰ.用氢氧化钠溶液吸收。
(1)硫化氢被完全吸收后,溶液里含硫的微粒可能为
 ,则溶液中
,则溶液中
 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。Ⅱ.制取
 ,其反应的能量示意如下图所示。
,其反应的能量示意如下图所示。
(2)写出该总反应的热化学方程式。
Ⅲ.高温分解:
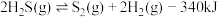
(3)能够判断上述反应到达平衡状态的是
a.
 的浓度保持不变b.气体的质量保持不变
的浓度保持不变b.气体的质量保持不变c.恒容时,容器的压强保持不变d.
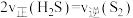
(4)在恒温恒压条件下,充入氩气,发现:
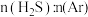 越小,
越小, 平衡转化率越大,请解释可能的原因。
平衡转化率越大,请解释可能的原因。Ⅳ.将
 燃烧,产生的
燃烧,产生的 与剩余
与剩余 混合后反应,生成单质硫回收。
混合后反应,生成单质硫回收。①
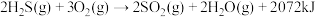
②
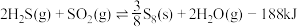
(5)②的平衡常数表达式为
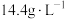 ,则
,则 内,
内, 平均反应速率
平均反应速率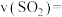
(6)在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为:
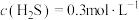 、
、 、
、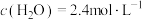 ,请计算开始时投料比
,请计算开始时投料比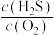
您最近一年使用:0次
【推荐1】铁及其化合物有着广泛的用途。请回答:
(1)高炉炼铁是目前普遍采用的冶炼铁的方法。已知:
FeO(s)+CO(g) Fe(s)+CO2(g) △H=a kJ·mol-1
Fe(s)+CO2(g) △H=a kJ·mol-1
Fe2O3(s)+CO(g) 2FeO(s)+CO2 △H=b kJ·mol-1
2FeO(s)+CO2 △H=b kJ·mol-1
工业上用铁红冶炼铁的热化学方程式为_________________________________ 。
(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化。
①该反应的离子方程式为_________________________________ 。
②T ℃时,向0.5mol·L-1 Fe(NO3)3溶液中加入足量Ag,溶液中c(Ag+)与反应时间(t)的关系如图1所示(溶液体积变化忽略不计)。
t1时,溶液中c(Fe3+)=__________ ;t1、t2时,逆反应速率v逆1______ v逆2(填“>”“<”或“=”)理由为_________________________________ 。
③T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,再加入6.0g Ag,一段时间后,Ag的质量________ (填“增大”“减小”或“不变”)。
④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,理由为__________ 。
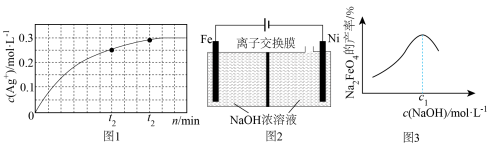
(3)Na2FeO4是重要的水处理剂,在强碱性介质中稳定,可用图2所示装置制备。已知:电解时,碱的浓度过高,阳极区产生红色物质。
①电解时,阴极附近溶液的碱性__________ (填“增大”“减小”或“不变”)。
②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为_________________________________ 。
(1)高炉炼铁是目前普遍采用的冶炼铁的方法。已知:
FeO(s)+CO(g)
 Fe(s)+CO2(g) △H=a kJ·mol-1
Fe(s)+CO2(g) △H=a kJ·mol-1Fe2O3(s)+CO(g)
 2FeO(s)+CO2 △H=b kJ·mol-1
2FeO(s)+CO2 △H=b kJ·mol-1工业上用铁红冶炼铁的热化学方程式为
(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化。
①该反应的离子方程式为
②T ℃时,向0.5mol·L-1 Fe(NO3)3溶液中加入足量Ag,溶液中c(Ag+)与反应时间(t)的关系如图1所示(溶液体积变化忽略不计)。

t1时,溶液中c(Fe3+)=
③T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,再加入6.0g Ag,一段时间后,Ag的质量
④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,理由为
(3)Na2FeO4是重要的水处理剂,在强碱性介质中稳定,可用图2所示装置制备。已知:电解时,碱的浓度过高,阳极区产生红色物质。
①电解时,阴极附近溶液的碱性
②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为
您最近一年使用:0次
【推荐2】铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中, (Ⅲ)以
(Ⅲ)以 形态存在:
形态存在: (Ⅱ)主要以
(Ⅱ)主要以 和
和 形态存在,其毒性是
形态存在,其毒性是 (Ⅲ)的100倍,处理含
(Ⅲ)的100倍,处理含 (Ⅵ)废水的常用方法是先将其转化为
(Ⅵ)废水的常用方法是先将其转化为 (Ⅲ),再进一步将
(Ⅲ),再进一步将 转化为
转化为 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。
(1)探究 (Ⅵ)的存在形式:
(Ⅵ)的存在形式: (Ⅵ)在水溶液中常有
(Ⅵ)在水溶液中常有 和
和 两种存在形式,该废水中两种离子的浓度与溶液
两种存在形式,该废水中两种离子的浓度与溶液 的关系如下图所示:
的关系如下图所示:
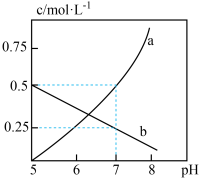
①加酸可以使 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
②计算该反应的平衡常数为______ 。(已知 时,
时,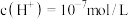 )
)
(2) (Ⅵ)转化为
(Ⅵ)转化为
在 时,向该废水中加入
时,向该废水中加入 溶液将
溶液将 (Ⅵ)还原为
(Ⅵ)还原为 ,然后再向其中加入浓氨水调节溶液
,然后再向其中加入浓氨水调节溶液 。
。
①加入 溶液后,发生反应的离子方程式为
溶液后,发生反应的离子方程式为______ 。
②还原 (Ⅵ)时,需控制溶液的
(Ⅵ)时,需控制溶液的 ,若酸性过高会造成的后果是
,若酸性过高会造成的后果是______ 。
(3) 也可用于直接还原去除废水中的
也可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 .废水的初始
.废水的初始 对去除溶液中的
对去除溶液中的 (Ⅵ)和总
(Ⅵ)和总 的影响关系如下图所示:
的影响关系如下图所示:
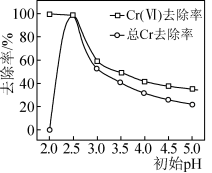
废水初始 时,
时, 和
和 反应生成
反应生成 、
、 和氢气,最终溶液的
和氢气,最终溶液的 约为9,反应生成的
约为9,反应生成的 转化为
转化为 沉淀得到有效去除,废水初始
沉淀得到有效去除,废水初始 时,虽然
时,虽然 (Ⅵ)的去除率达到100%,但总
(Ⅵ)的去除率达到100%,但总 的去除率为0.0%,其原因是
的去除率为0.0%,其原因是______ 。
 (Ⅲ)以
(Ⅲ)以 形态存在:
形态存在: (Ⅱ)主要以
(Ⅱ)主要以 和
和 形态存在,其毒性是
形态存在,其毒性是 (Ⅲ)的100倍,处理含
(Ⅲ)的100倍,处理含 (Ⅵ)废水的常用方法是先将其转化为
(Ⅵ)废水的常用方法是先将其转化为 (Ⅲ),再进一步将
(Ⅲ),再进一步将 转化为
转化为 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。(1)探究
 (Ⅵ)的存在形式:
(Ⅵ)的存在形式: (Ⅵ)在水溶液中常有
(Ⅵ)在水溶液中常有 和
和 两种存在形式,该废水中两种离子的浓度与溶液
两种存在形式,该废水中两种离子的浓度与溶液 的关系如下图所示:
的关系如下图所示:
①加酸可以使
 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为②计算该反应的平衡常数为
 时,
时,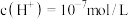 )
)(2)
 (Ⅵ)转化为
(Ⅵ)转化为
在
 时,向该废水中加入
时,向该废水中加入 溶液将
溶液将 (Ⅵ)还原为
(Ⅵ)还原为 ,然后再向其中加入浓氨水调节溶液
,然后再向其中加入浓氨水调节溶液 。
。①加入
 溶液后,发生反应的离子方程式为
溶液后,发生反应的离子方程式为②还原
 (Ⅵ)时,需控制溶液的
(Ⅵ)时,需控制溶液的 ,若酸性过高会造成的后果是
,若酸性过高会造成的后果是(3)
 也可用于直接还原去除废水中的
也可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 .废水的初始
.废水的初始 对去除溶液中的
对去除溶液中的 (Ⅵ)和总
(Ⅵ)和总 的影响关系如下图所示:
的影响关系如下图所示:
废水初始
 时,
时, 和
和 反应生成
反应生成 、
、 和氢气,最终溶液的
和氢气,最终溶液的 约为9,反应生成的
约为9,反应生成的 转化为
转化为 沉淀得到有效去除,废水初始
沉淀得到有效去除,废水初始 时,虽然
时,虽然 (Ⅵ)的去除率达到100%,但总
(Ⅵ)的去除率达到100%,但总 的去除率为0.0%,其原因是
的去除率为0.0%,其原因是
您最近一年使用:0次
【推荐3】尿素[CO(NH2)2]是一种重要的化工产品和常用氮肥。回答下列问题:
(1)尿素中C、N、O三种元素的电负性由小到大的顺序是___________ (用元素符号表示)。
(2)工业上,用CO2和NH3制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图):
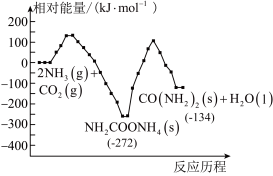
①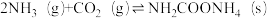
②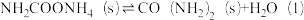
写出总反应的热化学方程式:___________ 。该历程中决速步骤的反应是___________ (填“①”或“②”)。
(3)工业上常用ZnO/NaY作催化剂,用1,2-丙二醇和尿素合成碳酸丙烯酯(PC),原理如下:
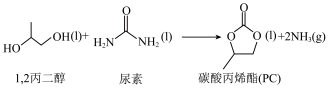 △H=+52kJ·mol-1
△H=+52kJ·mol-1
已知:碳酸丙烯酯(PC)沸点为238.14℃;1,2-丙二醇的沸点为162℃,尿素在160℃以上会分解。
在烧瓶中加入物质的量之比为2:1的1,2-丙二醇和尿素,加入催化剂ZnO/NaY充分反应,测定不同温度下PC的平衡收率变化如图所示。(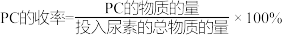 )
)
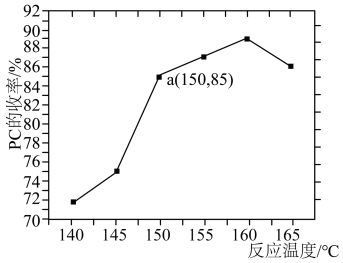
①160℃以上,PC的收率下降的主要原因可能是___________ 。
②150℃时,1,2-丙二醇的平衡转化率为___________ ;以液相中各物质的量分数代替浓度表示平衡常数Kx=___________ (列出计算式即可)。
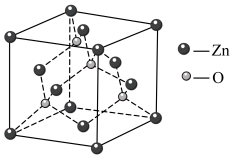
③催化剂中的ZnO有晶体形式,其晶胞如下图,则锌的配位数为___________ ;已知晶胞参数为acm,该晶体的密度为___________ g·cm-3(写出计算式,阿佛加德罗常数的值为NA)。
(1)尿素中C、N、O三种元素的电负性由小到大的顺序是
(2)工业上,用CO2和NH3制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图):

①
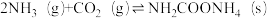
②
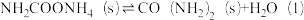
写出总反应的热化学方程式:
(3)工业上常用ZnO/NaY作催化剂,用1,2-丙二醇和尿素合成碳酸丙烯酯(PC),原理如下:
 △H=+52kJ·mol-1
△H=+52kJ·mol-1已知:碳酸丙烯酯(PC)沸点为238.14℃;1,2-丙二醇的沸点为162℃,尿素在160℃以上会分解。
在烧瓶中加入物质的量之比为2:1的1,2-丙二醇和尿素,加入催化剂ZnO/NaY充分反应,测定不同温度下PC的平衡收率变化如图所示。(
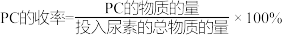 )
)
①160℃以上,PC的收率下降的主要原因可能是
②150℃时,1,2-丙二醇的平衡转化率为
③催化剂中的ZnO有晶体形式,其晶胞如下图,则锌的配位数为

您最近一年使用:0次



