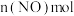道路千万条,安全第一条。当汽车在高速行驶中受到猛烈撞击时,会产生大量气体充满气囊,从而保护驾驶员和乘客的安全。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:______ (填“吸热”或“放热”)反应。
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为______ kJ(用含a、b的代数式表示)。
Ⅱ.汽车尾气中的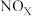 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应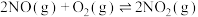 体系中,
体系中,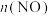 随时间的变化如表:
随时间的变化如表:
(3)下图表示 的变化的曲线是
的变化的曲线是______ ______ (选填序号,下同)。
a.容器内气体的颜色不再变化 b.
c. d.消耗
d.消耗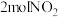 的同时生成
的同时生成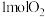
(5)为使该反应的反应速率增大,下列措施正确的是______ 。
a.增大 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体
Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示:______ 极(填写“正”或“负”),M处电极反应式是______ ;
(7)该电池产生11.2L(标况下) ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为______ 。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:
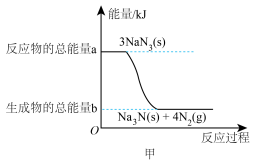
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为
Ⅱ.汽车尾气中的
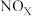 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应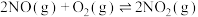 体系中,
体系中,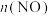 随时间的变化如表:
随时间的变化如表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)下图表示
 的变化的曲线是
的变化的曲线是 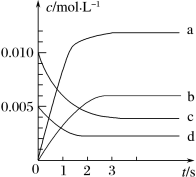
a.容器内气体的颜色不再变化 b.

c.
 d.消耗
d.消耗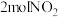 的同时生成
的同时生成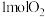
(5)为使该反应的反应速率增大,下列措施正确的是
a.增大
 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应
 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示: 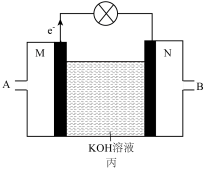
(7)该电池产生11.2L(标况下)
 ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为
23-24高一下·福建·期中 查看更多[2]
更新时间:2024-06-16 07:07:55
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】I.依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kpa下,1g甲烷燃烧生成CO2和液态水时放热22.68kJ。则表示甲烷燃烧的热化学方程式为___________ 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___________ 。
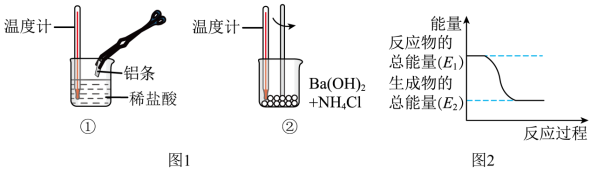
Ⅱ.某实验小组同学进行如图实验,以检验化学反应中的能量变化。请回答下列问题:___________ ,(选填“放热反应”或“吸热反应”)。反应过程___________ (填“①”或“②”)的能量变化可用图2表示。
Ⅲ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH.
3Zn(OH)2+2Fe(OH)3+4KOH.
(4)放电时负极反应为___________ 。
(5)放电时正极附近溶液的碱性___________ (填“增强”或“减弱”或“不变”)。
(6)放电时每转移___________ mol电子,正极有1molK2FeO4被还原。
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。___________ 。
(8)a膜为___________ (填“阳离子”或“阴离子”)交换膜。
(1)在25℃、101kpa下,1g甲烷燃烧生成CO2和液态水时放热22.68kJ。则表示甲烷燃烧的热化学方程式为
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
Ⅱ.某实验小组同学进行如图实验,以检验化学反应中的能量变化。请回答下列问题:
Ⅲ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH.
3Zn(OH)2+2Fe(OH)3+4KOH.(4)放电时负极反应为
(5)放电时正极附近溶液的碱性
(6)放电时每转移
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。
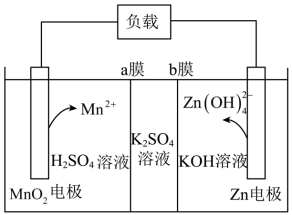
(8)a膜为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】工业上,以 为原料,通过不同反应生产更高价值的
为原料,通过不同反应生产更高价值的 。
。
I. 直接分解生产
直接分解生产 :
:
反应①: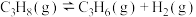
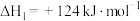
反应②: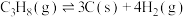

请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol (g)(仅考虑发生上述反应)。某时刻
(g)(仅考虑发生上述反应)。某时刻 转化率为20%,
转化率为20%, 选择性为40%,则该时刻反应①的浓度商
选择性为40%,则该时刻反应①的浓度商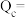
_______ 。
(2)下列说法正确的是_______。
(3)研究表明,在固体催化剂N存在下,反应①分三步进行,生成 步骤的活化能远大于生成
步骤的活化能远大于生成 步骤的活化能,且开始一段时间内
步骤的活化能,且开始一段时间内 与
与 的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图_______ 。

II. 辅助
辅助 生产
生产 :
:
反应③:
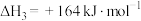
恒温恒压下, 和
和 按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:

(4)关于反应过程,下列说法正确的是_______。
(5)对该反应器催化剂表面上CO的生成速率和 的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和
的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和 的消耗速率不相等的可能原因
的消耗速率不相等的可能原因_______ 。

 为原料,通过不同反应生产更高价值的
为原料,通过不同反应生产更高价值的 。
。I.
 直接分解生产
直接分解生产 :
:反应①:
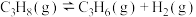
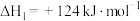
反应②:
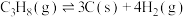

请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol
 (g)(仅考虑发生上述反应)。某时刻
(g)(仅考虑发生上述反应)。某时刻 转化率为20%,
转化率为20%, 选择性为40%,则该时刻反应①的浓度商
选择性为40%,则该时刻反应①的浓度商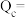
(2)下列说法正确的是_______。
| A.反应①能自发进行的条件是低温 |
| B.温度升高,反应②的平衡常数增大 |
| C.压强增大,活化分子百分数增多,导致反应①速率加快 |
| D.可通过C(s)的物质的量不再变化判断反应②达到平衡状态 |
 步骤的活化能远大于生成
步骤的活化能远大于生成 步骤的活化能,且开始一段时间内
步骤的活化能,且开始一段时间内 与
与 的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
II.
 辅助
辅助 生产
生产 :
:反应③:

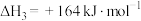
恒温恒压下,
 和
和 按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
(4)关于反应过程,下列说法正确的是_______。
A.M可循环利用, 不可循环利用 不可循环利用 |
| B.过程1作用力a是氢键,过程2涉及极性键的形成和断裂 |
| C.温度升高,过程1和过程2的反应速率均加快,总反应速率一定加快 |
D.其他条件不变,更换不同催化剂,同样生产1mol  (g)所需能量不一定相同 (g)所需能量不一定相同 |
 的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和
的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和 的消耗速率不相等的可能原因
的消耗速率不相等的可能原因
您最近一年使用:0次
【推荐3】CH3OH是重要的能源物质,CO2转化为甲醇是一种有效减少CO2排放的方法。
(1) 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ

反应Ⅲ
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)向恒温2L容器中充入一定量 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
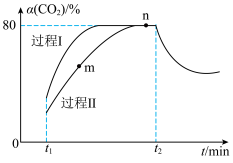
下列说法正确的是___________(填序号)。
(3)在25℃和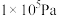 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
①压强从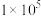 到
到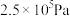 ,平衡
,平衡___________ (填“正向”“逆向”或“不”)移动;
②压强从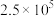 到
到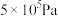 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是___________ 。
(4)在温度 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,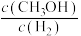
___________  (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)
(5)温度为 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为___________ 。
反应Ⅰ
反应Ⅱ
反应Ⅲ
(1)
 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ


反应Ⅲ

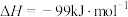
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A.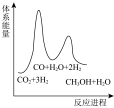 | B.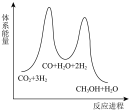 | C. | D. |
(2)向恒温2L容器中充入一定量
 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
下列说法正确的是___________(填序号)。
A.m点: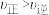 |
B. 时刻改变的反应条件可能是增大水蒸气的浓度 时刻改变的反应条件可能是增大水蒸气的浓度 |
| C.活化能:过程Ⅱ<过程Ⅰ |
D. 时刻改变的反应条件可能是降低温度 时刻改变的反应条件可能是降低温度 |
(3)在25℃和
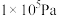 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。| 压强(Pa) | 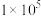 | 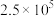 | 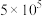 |
浓度( ) ) | 0.08 | 0.20 | 0.44 |
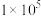 到
到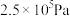 ,平衡
,平衡②压强从
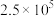 到
到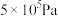 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是(4)在温度
 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,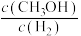
 (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)(5)温度为
 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为反应Ⅰ

反应Ⅱ

反应Ⅲ

您最近一年使用:0次
【推荐1】我国力争2030年前实现碳达峰,2060年前实现碳中和。CO2的综合利用是实现碳中和的措施之一。
I.CO2和CH4在催化剂表面可以合成CH3COOH,该反应的历程和相对能量的变化情况如下图所示(*指微粒吸附在催化剂表面,H*指H吸附在催化剂载体上的氧原子上,TS表示过渡态):

(1)决定该过程的总反应速率的基元反应方程式为___________ 。
(2)下列说法不正确的有___________ 。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b.CH3COOH*比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ.CO2和H2在一定条件下也可以合成甲醇,该过程存在副反应ii。
反应i:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.3kJ·mol-1
反应ii:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
(3)有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2=___________ kJ·mol-1。
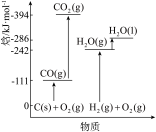
(4)恒温恒容条件下,仅发生反应ii,反应达到平衡的标志是___________ 。
a.CO的浓度不再发生变化
b.气体平均相对分子质量不再发生变化
c.容器压强不再发生变化
d.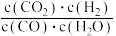 比值不再发生变化
比值不再发生变化
(5)在5.0MPa,将n(CO2):n(H2)=5:16的混合气体在催化剂作用下进行反应。体系中气体平衡组成比例(CO和CH3OH在含碳产物中物质的量百分数)及CO2的转化率随温度的变化如图所示。

①表示平衡时CO在含碳产物中物质的量百分数的曲线是___________ (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是___________ 。
③250℃时反应i:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的Kp=___________ (MPa)-2(用最简分数表示)。
I.CO2和CH4在催化剂表面可以合成CH3COOH,该反应的历程和相对能量的变化情况如下图所示(*指微粒吸附在催化剂表面,H*指H吸附在催化剂载体上的氧原子上,TS表示过渡态):

(1)决定该过程的总反应速率的基元反应方程式为
(2)下列说法不正确的有
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b.CH3COOH*比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ.CO2和H2在一定条件下也可以合成甲醇,该过程存在副反应ii。
反应i:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.3kJ·mol-1
反应ii:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
(3)有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2=

(4)恒温恒容条件下,仅发生反应ii,反应达到平衡的标志是
a.CO的浓度不再发生变化
b.气体平均相对分子质量不再发生变化
c.容器压强不再发生变化
d.
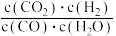 比值不再发生变化
比值不再发生变化(5)在5.0MPa,将n(CO2):n(H2)=5:16的混合气体在催化剂作用下进行反应。体系中气体平衡组成比例(CO和CH3OH在含碳产物中物质的量百分数)及CO2的转化率随温度的变化如图所示。

①表示平衡时CO在含碳产物中物质的量百分数的曲线是
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是
③250℃时反应i:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的Kp=
您最近一年使用:0次
【推荐2】为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
①下列有关说法正确的是_________ 。
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
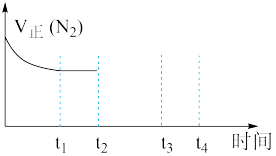
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g) N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________ 。
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=_______________ 。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如P(NO2)为NO2的平衡分压,P(NO2)=x(NO2)P, P为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_____________ 。

(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。①下列有关说法正确的是
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:

(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)
 N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染| 反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) N2(g)+O2(g) N2(g)+O2(g) | K1=1×1030 | ΔH=-180.5kJ/mol |
反应II:2CO2 (g) 2CO(g)+O2(g) 2CO(g)+O2(g) | K2=4×10-92 | ΔH= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)
 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
 已知
已知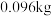 碳完全燃烧可放出3148kJ热量,
碳完全燃烧可放出3148kJ热量, 液态水汽化时要吸收44kJ热量。
液态水汽化时要吸收44kJ热量。
①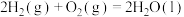
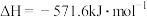
②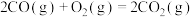

请写出制备水煤气的热化学方程式________ 。
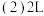 恒容密闭容器中发生
恒容密闭容器中发生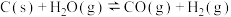 反应,当通入不同量的
反应,当通入不同量的 和
和 充分反应后得到如下实验数据:
充分反应后得到如下实验数据:
①由实验组1数据可知,达到平衡时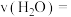
________ mol/(L∙min)。
②由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________ 。
③若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________ 。 填编号
填编号
a.容器中压强不变 b.1molH-H键断裂,同时断裂2molO-H键
c.c(H2O)=c(CO) d.v(H2O)=v(H2) e..容器体积不变
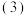 取
取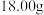 草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
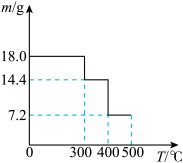
①350℃时,固体的成分是________ 。
②400℃时,样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,也能使灼热的CuO出现红色,则400℃时样品发生反应的化学方程式为________ 。
③取350℃时的上述样品 难溶于水
难溶于水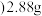 ,置入0.12mol/L、
,置入0.12mol/L、 的酸性
的酸性 溶液中,二者恰好反应,写出该反应的离子方程式
溶液中,二者恰好反应,写出该反应的离子方程式________ 。
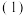 已知
已知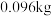 碳完全燃烧可放出3148kJ热量,
碳完全燃烧可放出3148kJ热量, 液态水汽化时要吸收44kJ热量。
液态水汽化时要吸收44kJ热量。①
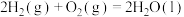
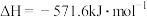
②
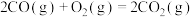

请写出制备水煤气的热化学方程式
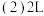 恒容密闭容器中发生
恒容密闭容器中发生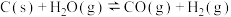 反应,当通入不同量的
反应,当通入不同量的 和
和 充分反应后得到如下实验数据:
充分反应后得到如下实验数据:| 实验组 | 温度 | 起始量  足量 足量 | 平衡量 | 达到平衡所需的时间 | ||
 |  |  |  | |||
| 1 | 650 | 2 |  |  | 2 | 4 |
| 2 | 650 |  |  |  |  | 5 |
①由实验组1数据可知,达到平衡时
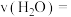
②由实验组1和2数据分析可知,增大压强对该可逆反应的影响是
③若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是
 填编号
填编号
a.容器中压强不变 b.1molH-H键断裂,同时断裂2molO-H键
c.c(H2O)=c(CO) d.v(H2O)=v(H2) e..容器体积不变
 取
取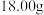 草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
①350℃时,固体的成分是
②400℃时,样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,也能使灼热的CuO出现红色,则400℃时样品发生反应的化学方程式为
③取350℃时的上述样品
 难溶于水
难溶于水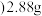 ,置入0.12mol/L、
,置入0.12mol/L、 的酸性
的酸性 溶液中,二者恰好反应,写出该反应的离子方程式
溶液中,二者恰好反应,写出该反应的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2 合成甲烷的热化学方程式为:CO(g) +3H2(g)==CH4(g) +H2O(1) △H
则△H=________ ;该反应能自发进行的原因是_____________________________________ 。
(2)工业上一般采用下列两种反应合成甲醇:
反应I :CO(g) +2H2( g) CH3OH(g)
CH3OH(g)
反应II :CO2(g) +3H2(g) CH3OH( g) + H2O( g)
CH3OH( g) + H2O( g)
①一定温度下,在体积可变的恒压密闭容器中加入4mol H2 和 一定量的CO 发生反应I,开始时容器体积为2L,CO 和CH3OH( g)的浓度随时间变化如图1。10min 达到平衡,则反应I的化学平衡常数为______________ (结果保留一位小数)。

②恒温恒容条件下,在密闭容器中通入等物质的量的CO2 和H2,下列描述能说明反应II 已经达到平衡状态的是________________ (填序号)。
A.容器内CO2 的体积分数不再变化 B.当CO2 和H2 转化率的比值不再变化
C.当水分子中断裂2NA个O-H 键,同时氢分子中断裂3NA个H-H 键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
(3)用KOH 作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________ ;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______ g。

(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g) + CH3OH(g) HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是
HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________ 。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2 合成甲烷的热化学方程式为:CO(g) +3H2(g)==CH4(g) +H2O(1) △H
则△H=
(2)工业上一般采用下列两种反应合成甲醇:
反应I :CO(g) +2H2( g)
 CH3OH(g)
CH3OH(g)反应II :CO2(g) +3H2(g)
 CH3OH( g) + H2O( g)
CH3OH( g) + H2O( g)①一定温度下,在体积可变的恒压密闭容器中加入4mol H2 和 一定量的CO 发生反应I,开始时容器体积为2L,CO 和CH3OH( g)的浓度随时间变化如图1。10min 达到平衡,则反应I的化学平衡常数为

②恒温恒容条件下,在密闭容器中通入等物质的量的CO2 和H2,下列描述能说明反应II 已经达到平衡状态的是
A.容器内CO2 的体积分数不再变化 B.当CO2 和H2 转化率的比值不再变化
C.当水分子中断裂2NA个O-H 键,同时氢分子中断裂3NA个H-H 键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
(3)用KOH 作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为

(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g) + CH3OH(g)
 HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是
HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】(1)乙醇—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极,在两极区分别加入乙醇和氧气,其负极反应式为:_____________ 。
(2)古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的 还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。①写出该电化学腐蚀的正极反应式:
还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。①写出该电化学腐蚀的正极反应式:____________ 。
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)____________ 。
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜。碱洗时常有气泡冒出,原因是(用离子方程式表示):____________ 。
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为:____________ 。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________ 。
(4)采用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.1molCu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中通过导线的电量为____________ C(已知NA=6.02×1023mol—1,1个电子所带的电量为1.60×10-19C)。
(2)古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的
 还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。①写出该电化学腐蚀的正极反应式:
还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。①写出该电化学腐蚀的正极反应式:②文物出土前,铁器表面的腐蚀产物可能有(写化学式)
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜。碱洗时常有气泡冒出,原因是(用离子方程式表示):
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为:
(4)采用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.1molCu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中通过导线的电量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】甲醇是一种化工原料,在工业生产中有重要的应用。
Ⅰ.在l.0L恒容密闭容器中投入1 molCO2和2.75molH2发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______ 。


A.该反应的正反应为放热反应
B.压强大小关系为pl<p2<p3
c. M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.甲醇是基本有机化工原料。甲醇及其可制得的产品的沸点如下。
(1)在425℃、Al2O3做催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为____________ 。
(2)甲醇制甲醚的化学方程式为2CH3OH CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。已知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向
CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。已知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______ (填“正”或“逆”)反应方向进行。
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示。
电源的负极为__________ (填“A”或“B”),写出阳极的电极反应_________ ;若参加反应的O2为1.12m3(标准状况),则制得的碳酸二甲酯的质量为______ kg。
Ⅰ.在l.0L恒容密闭容器中投入1 molCO2和2.75molH2发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是

A.该反应的正反应为放热反应
B.压强大小关系为pl<p2<p3
c. M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.甲醇是基本有机化工原料。甲醇及其可制得的产品的沸点如下。
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构简式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH3 | (CH3O)2CO |
| 沸点/℃ | 64.7 | 7.4 | 153 | -24.9 | 90 |
(1)在425℃、Al2O3做催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为
(2)甲醇制甲醚的化学方程式为2CH3OH
 CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。已知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向
CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。已知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示。
电源的负极为
您最近一年使用:0次