解题方法
1 . 钛合金是航天航空工业的重要材料。钛铁矿的主要成分为钛酸亚铁 。由钛铁矿制备人造金红石
。由钛铁矿制备人造金红石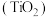 ,发生的反应有:
,发生的反应有:
反应①: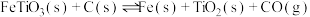

反应②: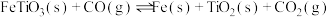
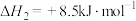
回答下列问题:
(1)已知C(s)的燃烧热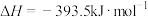 ,则表示CO(g)燃烧热的热化学方程式为
,则表示CO(g)燃烧热的热化学方程式为___________ 。
(2)一定温度下,在V L恒容密闭容器中加入 和
和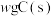 ,经过t min反应达到平衡,测得
,经过t min反应达到平衡,测得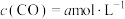 ,
,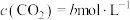 。
。
①用单位时间内固体反应物的物质的量的减小或固体生成物的物质的量的增大来表示固体的平均反应速率,0~t min,反应①中反应物C(s)的平均反应速率为___________  ,平衡时C(s)的转化率为
,平衡时C(s)的转化率为___________ 。
②该条件下,当密闭容器中下列物理量不再发生变化时,不能说明该反应体系达到平衡状态的是___________ (填标号)。
A.混合气体的压强
B.混合气体的密度
C.混合气体的总物质的量
D.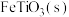 和Fe(s)的反应速率(单位:
和Fe(s)的反应速率(单位: )之比等于化学计量数之比
)之比等于化学计量数之比
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时 为
为___________ (填标号)。
A. B.
B.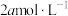
C.大于 ,小于
,小于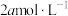 D.大于
D.大于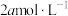
④若该条件下,平衡时压强为100kPa,其体系中隐藏的可逆反应为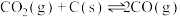 ,则该反应的平衡常数
,则该反应的平衡常数
___________ kPa(列出含a、b的计算式。用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。升高温度,该反应的
___________ (填“增大”“减小”或“不变”),原因是___________ 。
(3)钛铁矿冶炼采用电炉熔融还原,还原温度与铁、钛的品位及回收率的关系如图所示,则还原温度应控制在___________ 。 ,反应②的
,反应②的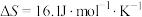 。反应①、反应②能自发进行的最低温度分别为
。反应①、反应②能自发进行的最低温度分别为 、
、 ,则
,则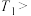
___________ K(保留整数,下同),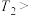
___________ K。
 。由钛铁矿制备人造金红石
。由钛铁矿制备人造金红石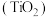 ,发生的反应有:
,发生的反应有:反应①:
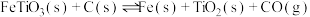

反应②:
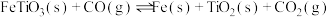
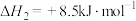
回答下列问题:
(1)已知C(s)的燃烧热
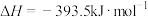 ,则表示CO(g)燃烧热的热化学方程式为
,则表示CO(g)燃烧热的热化学方程式为(2)一定温度下,在V L恒容密闭容器中加入
 和
和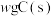 ,经过t min反应达到平衡,测得
,经过t min反应达到平衡,测得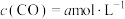 ,
,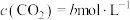 。
。①用单位时间内固体反应物的物质的量的减小或固体生成物的物质的量的增大来表示固体的平均反应速率,0~t min,反应①中反应物C(s)的平均反应速率为
 ,平衡时C(s)的转化率为
,平衡时C(s)的转化率为②该条件下,当密闭容器中下列物理量不再发生变化时,不能说明该反应体系达到平衡状态的是
A.混合气体的压强
B.混合气体的密度
C.混合气体的总物质的量
D.
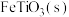 和Fe(s)的反应速率(单位:
和Fe(s)的反应速率(单位: )之比等于化学计量数之比
)之比等于化学计量数之比③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时
 为
为A.
 B.
B.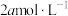
C.大于
 ,小于
,小于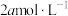 D.大于
D.大于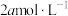
④若该条件下,平衡时压强为100kPa,其体系中隐藏的可逆反应为
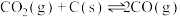 ,则该反应的平衡常数
,则该反应的平衡常数

(3)钛铁矿冶炼采用电炉熔融还原,还原温度与铁、钛的品位及回收率的关系如图所示,则还原温度应控制在
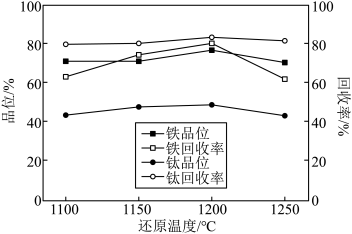
 ,反应②的
,反应②的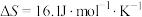 。反应①、反应②能自发进行的最低温度分别为
。反应①、反应②能自发进行的最低温度分别为 、
、 ,则
,则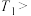
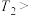
您最近一年使用:0次
解题方法
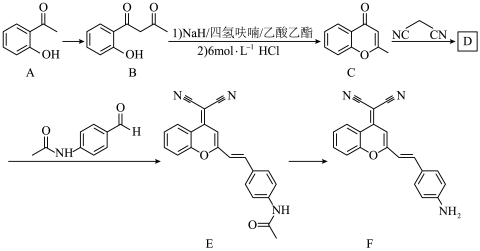
2 . 一种高灵敏的近红外荧光探针可实现对肿瘤活性大小的实时监测和追踪。下图是合成该探针中间体F的一种路线。
(1)A中含有的官能团的名称为_______ 。
(2)A→B需要在氩气氛围中进行的原因是_______ 。
(3)C→D的反应方程式为_______ 。
(4)E→F的反应条件为_______ 。
(5)已知A→D、D→E、E→F的产率分别为90%、40%和45%,则A→F的总产率为_______ 。
(6)化合物W是 的同分异构体,满足下列条件的W有
的同分异构体,满足下列条件的W有_______ 种。
①除苯环外无其他环状结构;② 连在苯环上;③能发生水解反应。
连在苯环上;③能发生水解反应。
其中,核磁共振氢谱显示5组峰,且峰面积比为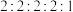 的同分异构体结构简式为
的同分异构体结构简式为_______ (写出一种即可)。
(1)A中含有的官能团的名称为
(2)A→B需要在氩气氛围中进行的原因是
(3)C→D的反应方程式为
(4)E→F的反应条件为
(5)已知A→D、D→E、E→F的产率分别为90%、40%和45%,则A→F的总产率为
(6)化合物W是
 的同分异构体,满足下列条件的W有
的同分异构体,满足下列条件的W有①除苯环外无其他环状结构;②
 连在苯环上;③能发生水解反应。
连在苯环上;③能发生水解反应。其中,核磁共振氢谱显示5组峰,且峰面积比为
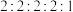 的同分异构体结构简式为
的同分异构体结构简式为
您最近一年使用:0次
解题方法
3 . 近年来,我国大力推行“双碳”战略,倡导绿色、环保、低碳的生产、生活方式,CO和 的资源化利用成为研究热点。
的资源化利用成为研究热点。
(1)目前大规模制氢方法之一是
 ,速率方程式为
,速率方程式为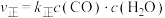 ,
,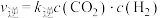 (
( 、
、 为正、逆反应速率常数,只与温度、催化剂、接触面积有关,与浓度、压强无关)。其平衡常数(K)与温度(T)关系如下表所示。
为正、逆反应速率常数,只与温度、催化剂、接触面积有关,与浓度、压强无关)。其平衡常数(K)与温度(T)关系如下表所示。
①上述反应达到平衡后,升高温度,
___________ (填“增大”“减小”或“不变”)。
②830℃时,向密闭容器中充入等物质的量的 和
和 ,发生上述反应的逆反应,达到平衡时
,发生上述反应的逆反应,达到平衡时 的转化率为
的转化率为___________ 。
(2)某温度下,向恒容密闭容器中充入物质的量之比为1∶4的 和
和 ,发生反应:
,发生反应: ,容器内气体压强随时间的变化如表所示:
,容器内气体压强随时间的变化如表所示:
①0~150min内,用 的分压变化表示的反应速率为
的分压变化表示的反应速率为___________  ;该温度下,反应的压强平衡常数
;该温度下,反应的压强平衡常数 为
为___________  (只列计算式,
(只列计算式, 是用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
是用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
②其他条件不变,在不同催化剂Cat1、Cat2作用下,反应相同时间内, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。 、
、 ,则有:
,则有:
___________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
ⅱ.比较x、y两点速率大小: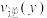
___________  。
。
(3)科学家开发高效催化电极,实现CO和 气体(体积比为3∶1)还原制备
气体(体积比为3∶1)还原制备 ,其反应机理如图所示。
,其反应机理如图所示。___________ 。
 的资源化利用成为研究热点。
的资源化利用成为研究热点。(1)目前大规模制氢方法之一是

 ,速率方程式为
,速率方程式为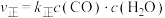 ,
,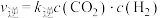 (
( 、
、 为正、逆反应速率常数,只与温度、催化剂、接触面积有关,与浓度、压强无关)。其平衡常数(K)与温度(T)关系如下表所示。
为正、逆反应速率常数,只与温度、催化剂、接触面积有关,与浓度、压强无关)。其平衡常数(K)与温度(T)关系如下表所示。| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.59 | 0.38 |

②830℃时,向密闭容器中充入等物质的量的
 和
和 ,发生上述反应的逆反应,达到平衡时
,发生上述反应的逆反应,达到平衡时 的转化率为
的转化率为(2)某温度下,向恒容密闭容器中充入物质的量之比为1∶4的
 和
和 ,发生反应:
,发生反应: ,容器内气体压强随时间的变化如表所示:
,容器内气体压强随时间的变化如表所示:| 时间/min | 0 | 50 | 100 | 150 | 200 | 250 |
| 压强/kPa | 100 | 88.0 | 79.8 | 72.4 | 65.0 | 65.0 |
 的分压变化表示的反应速率为
的分压变化表示的反应速率为 ;该温度下,反应的压强平衡常数
;该温度下,反应的压强平衡常数 为
为 (只列计算式,
(只列计算式, 是用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
是用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。②其他条件不变,在不同催化剂Cat1、Cat2作用下,反应相同时间内,
 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。
 、
、 ,则有:
,则有:
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。ⅱ.比较x、y两点速率大小:
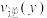
 。
。(3)科学家开发高效催化电极,实现CO和
 气体(体积比为3∶1)还原制备
气体(体积比为3∶1)还原制备 ,其反应机理如图所示。
,其反应机理如图所示。
您最近一年使用:0次
昨日更新
|
71次组卷
|
2卷引用:江西省稳派上进2025届高三上学期秋季入学摸底考试 化学试题
解题方法
4 . 为探究铜的化合物有关性质,现进行如下实验。
回答下列问题:
(1)由 配制实验I中的
配制实验I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是_______ (填仪器名称),定容后还需要进行的操作为_______ 。_______ 。
(3)实验Ⅱ未观察到蓝色絮状沉淀,猜想原因是实验Ⅱ取用的 溶液浓度太低。查阅资料得:
溶液浓度太低。查阅资料得: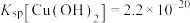 ,通过计算否定该猜想
,通过计算否定该猜想_______ 。
(4)实验Ⅲ生成蓝色絮状沉淀的离子方程式为_______ 。
(5)查阅资料:烯醛类物质易形成亮黄色树脂状化合物,微溶于水。实验Ⅳ中产生烯醛类物质的结构简式为_______ 。
(6)实验Ⅴ的现象为_______ 。
序号 | 实验操作 | 实验现象 |
Ⅰ | 将绿豆大的钠放入装有100mL 0.2  溶液的烧杯中 溶液的烧杯中 | |固体溶解,有气泡冒出,有蓝色絮状沉淀 |
Ⅱ | 取实验I等量的钠放入装有100mL 0.002  溶液的烧杯中 溶液的烧杯中 | 固体溶解,有气泡冒出,无蓝色絮状沉淀,测得溶液pH=9 |
Ⅲ | 取实验Ⅱ反应后的溶液于试管中,逐滴加入0.1 HCl溶液 HCl溶液 | 先出现蓝色絮状沉淀,后沉淀溶解 |
Ⅳ | 取实验Ⅰ反应后的溶液于试管中,振荡,加入0.5mL乙醛溶液,加热 | 试管底部出现砖红色沉淀,上层悬浊液呈现亮黄色 |
Ⅴ | 取实验I反应后的溶液于试管中,振荡,加入0.5mL甲醛溶液,加热 |
(1)由
 配制实验I中的
配制实验I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
(3)实验Ⅱ未观察到蓝色絮状沉淀,猜想原因是实验Ⅱ取用的
 溶液浓度太低。查阅资料得:
溶液浓度太低。查阅资料得: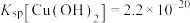 ,通过计算否定该猜想
,通过计算否定该猜想(4)实验Ⅲ生成蓝色絮状沉淀的离子方程式为
(5)查阅资料:烯醛类物质易形成亮黄色树脂状化合物,微溶于水。实验Ⅳ中产生烯醛类物质的结构简式为
(6)实验Ⅴ的现象为
您最近一年使用:0次
昨日更新
|
403次组卷
|
4卷引用:湖北省高中名校联盟2025届高三上学期8月第一次联考 化学试题
名校
5 . 室温下,HR、 、
、 三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示
三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示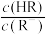 、
、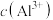 、
、 ]随溶液pH变化的关系如图所示。已知
]随溶液pH变化的关系如图所示。已知 比
比 更难溶,下列说法正确的是
更难溶,下列说法正确的是
 、
、 三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示
三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示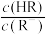 、
、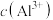 、
、 ]随溶液pH变化的关系如图所示。已知
]随溶液pH变化的关系如图所示。已知 比
比 更难溶,下列说法正确的是
更难溶,下列说法正确的是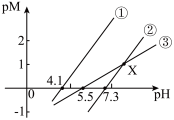
A.室温下,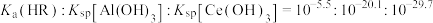 |
B.调节HR溶液pH=7时,溶液中: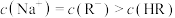 |
| C.可通过计算得出曲线②③的交点X点横坐标为8.6 |
D.向 沉淀中加入足量饱和 沉淀中加入足量饱和 溶液可生成 溶液可生成 沉淀 沉淀 |
您最近一年使用:0次
昨日更新
|
135次组卷
|
2卷引用:东北三省精准教学2024-2025学年高三上学期9月联考化学试卷
解题方法
6 . 天然产物5-异戊烯基紫铆花素(G)是一种新型的查尔酮,对氯喹敏感和抗氯喹菌株有很好抗疟原虫活性。以 和
和 为起始原料合成
为起始原料合成 的路线如图所示:
的路线如图所示:___________ 。
(2)反应①为取代反应,X的分子式为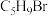 ,其结构简式为
,其结构简式为___________ 。
(3)反应③的化学方程式为___________ 。
(4)设置反应②、③的目的是___________ 。
(5)反应④分为两步,第二步发生消去反应,则第一步的反应类型是___________ 。
(6)同时满足下列条件的D的一种同分异构体的结构简式为___________ 。
a.1molD能与3molNaOH发生反应
b.核磁共振氢谱为3∶2∶2∶1
 和
和 为起始原料合成
为起始原料合成 的路线如图所示:
的路线如图所示: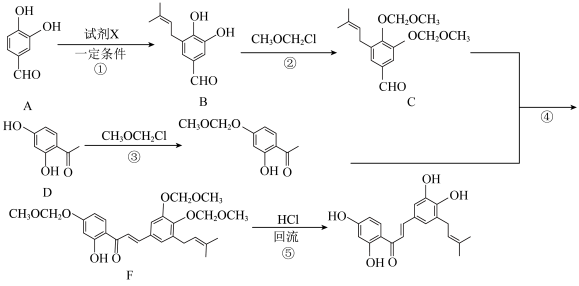
(2)反应①为取代反应,X的分子式为
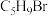 ,其结构简式为
,其结构简式为(3)反应③的化学方程式为
(4)设置反应②、③的目的是
(5)反应④分为两步,第二步发生消去反应,则第一步的反应类型是
(6)同时满足下列条件的D的一种同分异构体的结构简式为
a.1molD能与3molNaOH发生反应
b.核磁共振氢谱为3∶2∶2∶1
您最近一年使用:0次
解题方法
7 . 有效利用工业废气中多余的 催化加氢制取清洁、可再生的甲醇化学品成为研究的热点之一,某催化体系中可能涉及如下反应:
催化加氢制取清洁、可再生的甲醇化学品成为研究的热点之一,某催化体系中可能涉及如下反应:
反应ⅰ: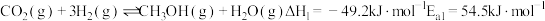
反应ⅱ: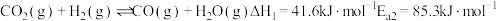
回答下列问题:
(1)已知速率常数k与温度T、活化能 的关系为
的关系为 为摩尔气体常数。上述反应体系在一定条件下建立平衡后,下列说法正确的是
为摩尔气体常数。上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ 。
a.适当增大 的浓度,反应ⅰ、ⅱ均向右移动
的浓度,反应ⅰ、ⅱ均向右移动
b.移去部分 ,反应ⅱ的正反应速率增大
,反应ⅱ的正反应速率增大
c.适当提高反应温度,反应ⅱ的正反应速率改变程度比反应ⅰ的更大
d.加入催化剂,可提高 的平衡转化率
的平衡转化率
(2)起始物 时,在一定条件下,
时,在一定条件下, 和
和 的产率与温度、压强的关系如下图所示。
的产率与温度、压强的关系如下图所示。 中压强最大的是
中压强最大的是___________ (选填 ),理由是
),理由是___________ 。
②图中A、B点为平衡点的是___________ ,理由是___________ 。
③ 时,反应ⅰ的平衡常数
时,反应ⅰ的平衡常数
___________ (列计算式,分压 总压×物质的量分数)。
总压×物质的量分数)。
(3)研究小组给出了 加氢制
加氢制 的可能反应机理(如下图所示):
的可能反应机理(如下图所示): 首先在
首先在 催化剂表面解离成2个
催化剂表面解离成2个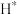 ,随后参与到
,随后参与到 的还原过程。(注:□表示氧原子空位,*表示吸附在催化剂上的微粒)
的还原过程。(注:□表示氧原子空位,*表示吸附在催化剂上的微粒)___________ 。
a.碳原子的杂化类型涉及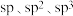
b.反应过程存在 的断裂和生成
的断裂和生成
c.催化剂氧空位用于捕获 ,氧空位越多反应速率越快
,氧空位越多反应速率越快
d.反应温度过高使甲醇炭化,易使催化剂反应活性降低
②理论上,每生成 ,该历程中消耗的
,该历程中消耗的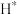 的数目为
的数目为___________ 。
 催化加氢制取清洁、可再生的甲醇化学品成为研究的热点之一,某催化体系中可能涉及如下反应:
催化加氢制取清洁、可再生的甲醇化学品成为研究的热点之一,某催化体系中可能涉及如下反应:反应ⅰ:
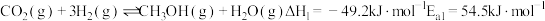
反应ⅱ:
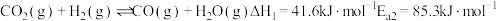
回答下列问题:
(1)已知速率常数k与温度T、活化能
 的关系为
的关系为 为摩尔气体常数。上述反应体系在一定条件下建立平衡后,下列说法正确的是
为摩尔气体常数。上述反应体系在一定条件下建立平衡后,下列说法正确的是a.适当增大
 的浓度,反应ⅰ、ⅱ均向右移动
的浓度,反应ⅰ、ⅱ均向右移动b.移去部分
 ,反应ⅱ的正反应速率增大
,反应ⅱ的正反应速率增大c.适当提高反应温度,反应ⅱ的正反应速率改变程度比反应ⅰ的更大
d.加入催化剂,可提高
 的平衡转化率
的平衡转化率(2)起始物
 时,在一定条件下,
时,在一定条件下, 和
和 的产率与温度、压强的关系如下图所示。
的产率与温度、压强的关系如下图所示。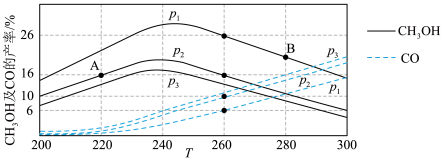
 中压强最大的是
中压强最大的是 ),理由是
),理由是②图中A、B点为平衡点的是
③
 时,反应ⅰ的平衡常数
时,反应ⅰ的平衡常数
 总压×物质的量分数)。
总压×物质的量分数)。(3)研究小组给出了
 加氢制
加氢制 的可能反应机理(如下图所示):
的可能反应机理(如下图所示): 首先在
首先在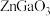 催化剂表面解离成2个
催化剂表面解离成2个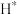 ,随后参与到
,随后参与到 的还原过程。(注:□表示氧原子空位,*表示吸附在催化剂上的微粒)
的还原过程。(注:□表示氧原子空位,*表示吸附在催化剂上的微粒)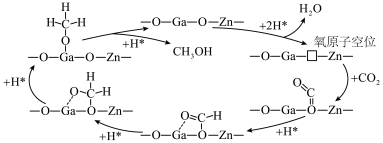
a.碳原子的杂化类型涉及
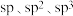
b.反应过程存在
 的断裂和生成
的断裂和生成c.催化剂氧空位用于捕获
 ,氧空位越多反应速率越快
,氧空位越多反应速率越快d.反应温度过高使甲醇炭化,易使催化剂反应活性降低
②理论上,每生成
 ,该历程中消耗的
,该历程中消耗的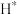 的数目为
的数目为
您最近一年使用:0次
解题方法
8 . 常温下,向 的
的 溶液中逐滴滴入等体积
溶液中逐滴滴入等体积 的
的 溶液。反应过程中部分含碳微粒或含氮微粒分布系数
溶液。反应过程中部分含碳微粒或含氮微粒分布系数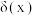 与
与 的关系如图所示,已知曲线
的关系如图所示,已知曲线 分别代表
分别代表 和
和 。下列说法错误的是
。下列说法错误的是
 的
的 溶液中逐滴滴入等体积
溶液中逐滴滴入等体积 的
的 溶液。反应过程中部分含碳微粒或含氮微粒分布系数
溶液。反应过程中部分含碳微粒或含氮微粒分布系数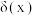 与
与 的关系如图所示,已知曲线
的关系如图所示,已知曲线 分别代表
分别代表 和
和 。下列说法错误的是
。下列说法错误的是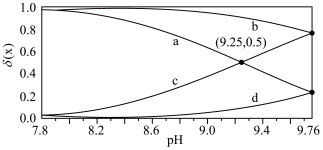
A.曲线a、d分别为 和 和 |
B.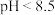 前, 前, 逐渐增大是因为 逐渐增大是因为 水解平衡逆向移动 水解平衡逆向移动 |
C. 后, 后, 和 和 同时参与反应 同时参与反应 |
D.据图中数据推算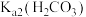 的数量级为 的数量级为 |
您最近一年使用:0次
9 . 2019年诺贝尔化学奖授予英国科学家古德纳夫及另外两位科学家,以表彰他们在锂离子电池研究中的杰出贡献。新能源汽车的核心部件是锂离子电池,磷酸亚铁锂( )以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
【方法一】制备流程如图。___________ 。
(2)可循环利用的物质是___________ (写化学式)。
(3)“煅烧”中生成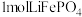 的同时产生
的同时产生 在标准状况下的体积为
在标准状况下的体积为___________  。
。
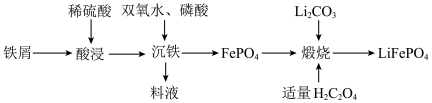
【方法二】钛铁矿为铁源, 、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图: 的主要成分是:
的主要成分是: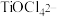 、
、 ,还含有少量
,还含有少量 、
、 、
、 ;
;
②滤渣的成分是 ;滤液中
;滤液中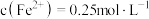 ,
,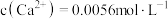 ,
,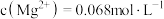 ;
;
③残留在溶液中的离子浓度小于 ,说明该离子沉淀完全;
,说明该离子沉淀完全;
几种物质的
(4)写出生成滤渣 的离子方程式:
的离子方程式:___________ 。
(5)通过计算判断实际工业生产方案中得到 的过程中是否会引入其他杂质
的过程中是否会引入其他杂质___________ ?
(6)写出在高温下生成磷酸亚铁锂的化学方程式:___________ 。
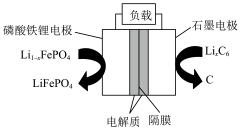
(7)磷酸亚铁锂锂离子电池工作原理如图所示,写出正极的电极反应式:___________ 。
 )以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。【方法一】制备流程如图。
(2)可循环利用的物质是
(3)“煅烧”中生成
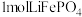 的同时产生
的同时产生 在标准状况下的体积为
在标准状况下的体积为 。
。【方法二】钛铁矿为铁源,
 、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图: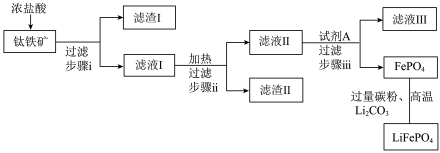
 的主要成分是:
的主要成分是: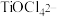 、
、 ,还含有少量
,还含有少量 、
、 、
、 ;
;②滤渣的成分是
 ;滤液中
;滤液中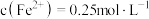 ,
,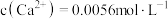 ,
,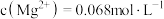 ;
;③残留在溶液中的离子浓度小于
 ,说明该离子沉淀完全;
,说明该离子沉淀完全;几种物质的

| 物质 | 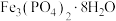 |  |  |  |
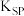 (单位略) (单位略) |  | 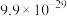 | 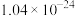 | 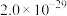 |
(4)写出生成滤渣
 的离子方程式:
的离子方程式:(5)通过计算判断实际工业生产方案中得到
 的过程中是否会引入其他杂质
的过程中是否会引入其他杂质(6)写出在高温下生成磷酸亚铁锂的化学方程式:
(7)磷酸亚铁锂锂离子电池工作原理如图所示,写出正极的电极反应式:
您最近一年使用:0次
解题方法
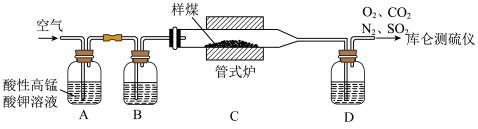
10 . 在煤中硫以有机硫和无机硫(CaSO4、硫化物及微量单质硫等)的形态存在。库仑滴定法是常用的快捷检测煤中含硫量的方法,其实验装置如图所示(煤在催化剂作用下,在管式炉中燃烧)。 I
I ),仪器便立即自动电解KI使
),仪器便立即自动电解KI使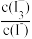 回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
回答下列问题:
(1)装置A中盛放酸性高锰酸钾溶液的作用是______ 。
(2)高温下,碳单质将CaSO4完全转化为SO2的反应中氧化剂与还原剂的物质的量之比是______ 。
(3)①SO2破坏库仑测硫仪中I2的KI溶液中KI3-KI电对的电位平衡的原因是_______ (用离子方程式表示)。
②装置D中盛放的试剂是______ ,若无装置D,造成的后果是______ 。
③库仑测硫仪中,电解过程中使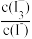 回到原定值的反应在
回到原定值的反应在______ (填“阳”或“阴”)极进行,该极的电极反应式为______ 。
 I
I ),仪器便立即自动电解KI使
),仪器便立即自动电解KI使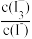 回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。回答下列问题:
(1)装置A中盛放酸性高锰酸钾溶液的作用是
(2)高温下,碳单质将CaSO4完全转化为SO2的反应中氧化剂与还原剂的物质的量之比是
(3)①SO2破坏库仑测硫仪中I2的KI溶液中KI3-KI电对的电位平衡的原因是
②装置D中盛放的试剂是
③库仑测硫仪中,电解过程中使
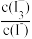 回到原定值的反应在
回到原定值的反应在
您最近一年使用:0次



