名校
1 . 物质的性质决定用途。下列有关物质的性质与用途的对应关系错误的
性质 | 用途 | |
A. |  可使蛋白质变性 可使蛋白质变性 | 波尔多液作为杀菌剂 |
B. |  胶体具有吸附性 胶体具有吸附性 |  可治疗胃酸过多 可治疗胃酸过多 |
C. |  对X射线透过率低且难溶于酸 对X射线透过率低且难溶于酸 |  作X射线检查内服药剂 作X射线检查内服药剂 |
D. | 葡萄糖具有一定还原性 | 葡萄糖可用于工业制镜 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-30更新
|
197次组卷
|
3卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
2 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
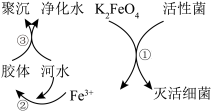
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
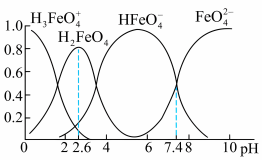
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
名校
解题方法
3 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题。

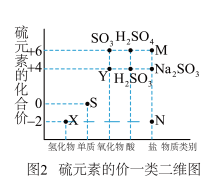
(1)图1中与图2中M、N对应的物质分别是___________ 、___________ 。(各写一个)
(2)写出物质X的电子式___________ 。
(3)SO2的排放是造成酸雨的主要因素,同时SO2在生活中也有多种用途。请回答下列问题:
①从环境保护的角度看,人们通常把pH<5.6的降水称为酸雨。已知pH=-lgc(H+)。经测定某次雨水中只含硫酸。且浓度为5×10-5mol/L,这次降雨___________ (填“是”或“不是”)酸雨。
②石灰石——石膏(CaSO4·2H2O)法是处理含SO2烟气脱硫的常见方法,该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂与烟气充分混合并接触氧化。最终生成石膏。写出该过程发生反应的化学方程式___________ 。
③在酸酒时人工添加SO2有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理___________ 。
④发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总SO2小于250mg/L,若在室温下。每升溶液中最多通入___________ mLSO2.(室温下Vm=24L/mol)
(4)向BaCl2溶液中通入SO2至饱和,此过程看不到现象,再向溶液中加入一种物质。溶液变浑浊。加入的这种物质不可能是___________。


(1)图1中与图2中M、N对应的物质分别是
(2)写出物质X的电子式
(3)SO2的排放是造成酸雨的主要因素,同时SO2在生活中也有多种用途。请回答下列问题:
①从环境保护的角度看,人们通常把pH<5.6的降水称为酸雨。已知pH=-lgc(H+)。经测定某次雨水中只含硫酸。且浓度为5×10-5mol/L,这次降雨
②石灰石——石膏(CaSO4·2H2O)法是处理含SO2烟气脱硫的常见方法,该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂与烟气充分混合并接触氧化。最终生成石膏。写出该过程发生反应的化学方程式
③在酸酒时人工添加SO2有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理
④发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总SO2小于250mg/L,若在室温下。每升溶液中最多通入
(4)向BaCl2溶液中通入SO2至饱和,此过程看不到现象,再向溶液中加入一种物质。溶液变浑浊。加入的这种物质不可能是___________。
| A.Cl2 | B.NH3 | C.CO2 | D.H2S |
您最近一年使用:0次
名校
解题方法
4 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入 和
和 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有___________ (填数字序号)。
①容器中 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗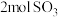
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
 =
= 。
。
①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是___________ (填字母)。
②实验测得反应2CO(g)+2NO(g) 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
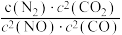 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向___________ 移动(填“正反应方向”“逆反应方向”或“不”)。k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
(3)已知:
 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
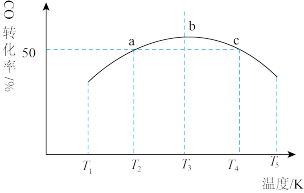
①
___________ 0(填“>”或“<”)。
②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是___________ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为___________ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入
 和
和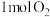 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗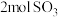
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

 =
= 。
。①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是
②实验测得反应2CO(g)+2NO(g)
 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
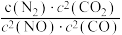 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向(3)已知:

 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
5 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
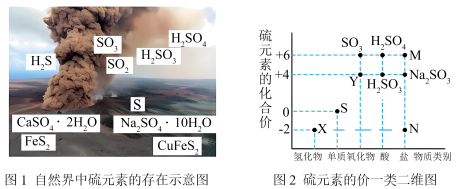
(1)图1中与图2中M、N对应的物质分别是___________ 、___________ 。
(2) 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(4)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与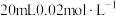 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(5) 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:

请回答下列问题:
①反应b的化学方程式为:___________ 。
②在一段时间内连续不断测定溶液 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:___________ 。
③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:___________ 。
(6)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成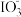 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(7)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
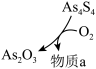
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为___________ ,消耗氧气___________  。
。

(1)图1中与图2中M、N对应的物质分别是
(2)
 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与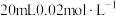 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)
 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
请回答下列问题:
①反应b的化学方程式为:
②在一段时间内连续不断测定溶液
 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:
(6)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成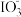 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(7)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为 。
。
您最近一年使用:0次
名校
6 . 燃油汽车尾气中NO和CO的排放,是大气污染的主要原因之一。NSR系统( ,storage and reduction)是一种有效降低
,storage and reduction)是一种有效降低 排放的策略。
排放的策略。
Ⅰ.NSR系统热力学分析
(1)NSR系统中工作原理的方程式为 。298K,101kPa下,该反应的
。298K,101kPa下,该反应的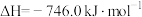 ,
,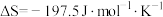 ,该反应在热力学上趋势很大,其原因是
,该反应在热力学上趋势很大,其原因是_______ 。
Ⅱ.密闭容器中NSR系统平衡研究
(2)温度 ℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
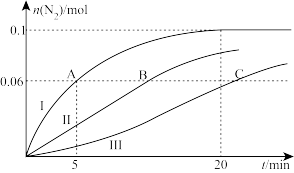
①反应开始到A点,用NO浓度变化表示的平均反应速率为_______  。
。
②B点所在体系达平衡时,放出的热量为_______ kJ。
③C点所在体系达平衡后,继续加入0.2mol NO、0.2mol CO、0.3mol 、0.2mol
、0.2mol  ,再次平衡时的
,再次平衡时的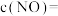
_______  。
。
Ⅲ.NSR系统机理研究
重庆一中某探究性学习小组模拟NSB系统中“吸附、储存、释放、还产物原”四个阶段的全过程。先控制气流(成分为NO、 )通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为
)通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为 。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
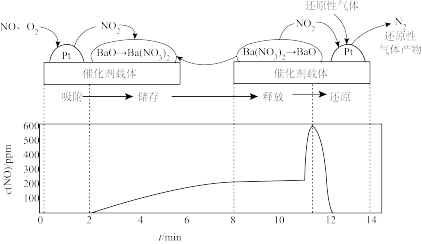
(3)吸附阶段:2min前,出口处的 浓度接近于0,原因是
浓度接近于0,原因是_______ 。
(4)释放阶段:写出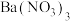 释放出
释放出 的化学反应方程式:
的化学反应方程式:_______ 。
(5)还原阶段:
①通入的还原性气体成分为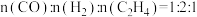 ,与
,与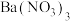 中释放的
中释放的 反应后,气体成分为
反应后,气体成分为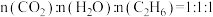 [
[ 未测定],则反应的
未测定],则反应的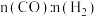

_______ 。
②有研究表明,还原性气体中若混有 ,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:_______ 。
 ,storage and reduction)是一种有效降低
,storage and reduction)是一种有效降低 排放的策略。
排放的策略。Ⅰ.NSR系统热力学分析
(1)NSR系统中工作原理的方程式为
 。298K,101kPa下,该反应的
。298K,101kPa下,该反应的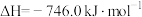 ,
,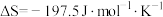 ,该反应在热力学上趋势很大,其原因是
,该反应在热力学上趋势很大,其原因是Ⅱ.密闭容器中NSR系统平衡研究
(2)温度
 ℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
℃时,在2L的密闭容器中,充入CO、NO各0.4mol,分别对比三种催化剂(Ⅰ、Ⅱ、Ⅲ)对NSR系统中反应的催化效果,结果如图所示:
①反应开始到A点,用NO浓度变化表示的平均反应速率为
 。
。②B点所在体系达平衡时,放出的热量为
③C点所在体系达平衡后,继续加入0.2mol NO、0.2mol CO、0.3mol
 、0.2mol
、0.2mol  ,再次平衡时的
,再次平衡时的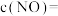
 。
。Ⅲ.NSR系统机理研究
重庆一中某探究性学习小组模拟NSB系统中“吸附、储存、释放、还产物原”四个阶段的全过程。先控制气流(成分为NO、
 )通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为
)通过NSR反应器,待出口处浓度稳定后,通入还原性气体(CO等)。总反应为 。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
。四个阶段与出口处浓度的时间对应关系如图所示,回答下列问题:
(3)吸附阶段:2min前,出口处的
 浓度接近于0,原因是
浓度接近于0,原因是(4)释放阶段:写出
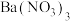 释放出
释放出 的化学反应方程式:
的化学反应方程式:(5)还原阶段:
①通入的还原性气体成分为
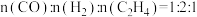 ,与
,与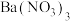 中释放的
中释放的 反应后,气体成分为
反应后,气体成分为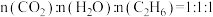 [
[ 未测定],则反应的
未测定],则反应的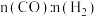

②有研究表明,还原性气体中若混有
 ,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
,会导致催化剂中毒,活性下降,从氧化还原反应原理和催化剂循环再生的角度分析可能原因:
您最近一年使用:0次
7 . 氨元素是动植物生长不可缺少的元素,图1是自然界中氨元素的循环示意图,图2是氨元素的常见化合价与部分物质类别的对应关系。回答下列问题:
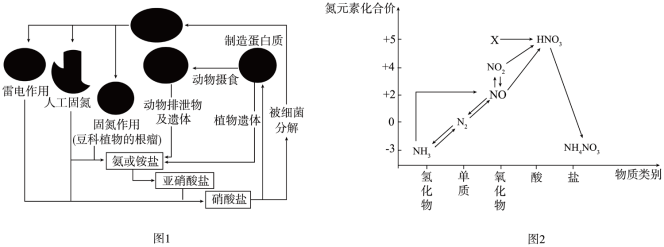
(1)图1中属于固氮过程的是_______ (写两种即可)。
(2) 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。
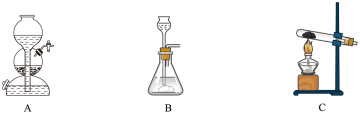
①下列各装置中常用于实验室制备氨气的是_______ (填字母),利用该装置制备氨气的化学方程式为_______ 。
② 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
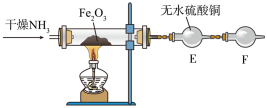
写出氨气与氧化铁反应的化学方程式:_______ 。干燥管F中装有无水氯化钙,其作用是_______ 。
(3)图2中物质X的化学式是_______ ,其与水反应生成 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为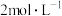 ,硝酸的浓度为
,硝酸的浓度为 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为_______ (假设只生成一种气体),最多可收集到标准状况下的该气体的体积为_______ L。

(1)图1中属于固氮过程的是
(2)
 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。①下列各装置中常用于实验室制备氨气的是

②
 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
写出氨气与氧化铁反应的化学方程式:
(3)图2中物质X的化学式是
 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为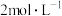 ,硝酸的浓度为
,硝酸的浓度为 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
您最近一年使用:0次
8 . 目前世界各国都规划了碳达峰、碳中和的时间节点,以CO2为碳源,将其转化为能源物质。选择性加氢合成CH3OH,合成过程中发生下列反应:
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。___________ kJ‧mol-1(用含a,b的代数式表示)。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
(3)中科院兰州化物所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图所示。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加Na助剂是否效果最好?_________ (填“是”或“否”),请叙述原因:___________ 。
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能___________ (填“>”“<”或“=”) 逆反应的活化能。
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
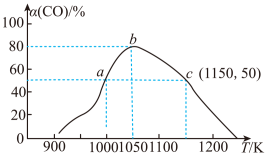
①温度为1000K时,反应开始至2min时,v(H2)=___________ mol‧L-1‧min-1
②CO的转化率随温度的升高先增大后变小的原因是___________ 。
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。
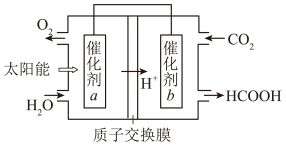
①光电转化过程中,阴极反应式为___________
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生______ L气体。
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
| A.混合气体的总物质的量不再变化 | B.n(CH3OH):n(H2O)=1:1 |
| C.v正(CH3OH)=3v逆(H2) | D.该反应的K不再变化 |

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比 | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:

①温度为1000K时,反应开始至2min时,v(H2)=
②CO的转化率随温度的升高先增大后变小的原因是
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。

①光电转化过程中,阴极反应式为
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生
您最近一年使用:0次
解题方法
9 . 海洋是人类未来赖以生存和发展的资源宝库,合理开发和有效利用应得到重视。如从海藻灰中可得到NaI溶液。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有___________ 。
(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
①用CCl4萃取反应后I、II、III、IV 的溶液,萃取后下层CCl4均为无色,取萃取后的上层溶液,用淀粉检验:I、Ⅱ的溶液变蓝色;III的溶液蓝色不明显、Ⅳ的溶液未变蓝。
i.写出实验Ⅰ中反应的离子方程式___________ 。
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:
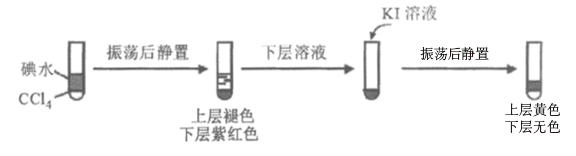
用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是___________ 。
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:
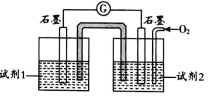
据此分析,试剂1是___________ ;试剂2是 ___________ 。
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为___________ 。
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++ +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。
①该实验达到滴定终点时,现象为___________ 。
②根据滴定有关数据,该NaI溶液中I—含量是___________ g·L-1。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有

(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
| 实验 | 编号 | pH = a | 现象 |
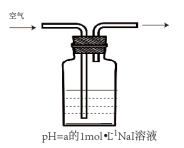 | I | 3 | 4分钟左右,溶液呈黄色 |
| Ⅱ | 7 | 60分钟左右,溶液呈浅黄色 | |
| Ⅲ | 8 | 10小时后,溶液呈很浅的黄色 | |
| Ⅳ | 10 | 10小时后,溶液颜色无明显变化 |
i.写出实验Ⅰ中反应的离子方程式
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:

用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:

据此分析,试剂1是
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++
 +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。①该实验达到滴定终点时,现象为
②根据滴定有关数据,该NaI溶液中I—含量是
您最近一年使用:0次
10 . 钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。
已知:①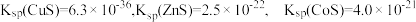 。
。
②以氢氧化物形式沉淀时,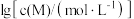 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是_____ 。
(2)“酸浸”步骤中, 发生反应的化学方程式是
发生反应的化学方程式是_____ 。
(3)假设“沉铜”后得到的滤液中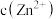 和
和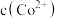 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中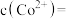
_____  ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离_____ (填“能”或“不能”)。
(4)“沉锰”步骤中,生成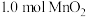 ,产生
,产生 的物质的量为
的物质的量为_____ 。
(5)“沉淀”步骤中,用 调
调 ,分离出的滤渣是
,分离出的滤渣是_____ 。
(6)“沉钴”步骤中,控制溶液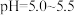 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为_____ 。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_____ 。
 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。已知:①
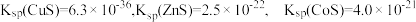 。
。②以氢氧化物形式沉淀时,
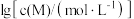 和溶液
和溶液 的关系如图所示。
的关系如图所示。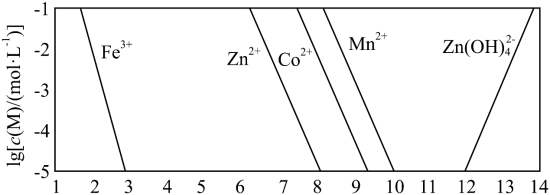
(1)“酸浸”前,需将废渣磨碎,其目的是
(2)“酸浸”步骤中,
 发生反应的化学方程式是
发生反应的化学方程式是(3)假设“沉铜”后得到的滤液中
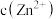 和
和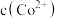 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中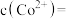
 ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离(4)“沉锰”步骤中,生成
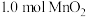 ,产生
,产生 的物质的量为
的物质的量为(5)“沉淀”步骤中,用
 调
调 ,分离出的滤渣是
,分离出的滤渣是(6)“沉钴”步骤中,控制溶液
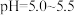 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是
您最近一年使用:0次



