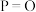1 . 双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: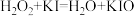 ;
;
反应②: 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。

4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为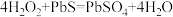 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
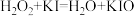 ;
;反应②:
 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.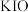 | D. |
A.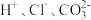 | B.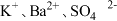 |
C. | D.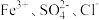 |

4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为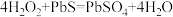 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.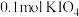 | B.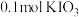 | C.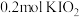 | D.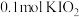 |
您最近一年使用:0次
2 . 乙烯是重要的有机化工基础原料,主要由石油裂解获得,随着石油资源的不断消耗,研究人员已开发出利用天然气替代石油生产乙烯的方法:
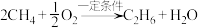
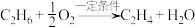
1. 的空间构型为
的空间构型为_______ 。
A.平面正方形 B.三角锥形 C.正四面体
 与
与 属于
属于_______ 。
A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.水果成熟后会释放出乙烯,在水果箱中放入一些用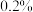 的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。
的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。_______
3.乙烯发生_______ 反应得到聚乙烯。
A.取代 B.聚合 C.氧化
聚乙烯可用于制造_______ 。
A.汽车轮胎 B.塑料大棚薄膜 C.食品保鲜袋 D.棉质内衣
4.乙烯水合制得乙醇。乙醇和_______ 在浓硫酸催化作用下反应生成乙酸乙酯。有研究表明上述反应也可使用甘氨酸 作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势
作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势_______ 。
5.自然界中也存在酯类化合物,如_______ 。
A.蛋白质 B.淀粉 C.油脂 是由_______种氨基酸通过分子间脱水形成的。
是由_______种氨基酸通过分子间脱水形成的。
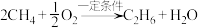
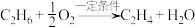
1.
 的空间构型为
的空间构型为A.平面正方形 B.三角锥形 C.正四面体
 与
与 属于
属于A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.水果成熟后会释放出乙烯,在水果箱中放入一些用
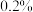 的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。
的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。3.乙烯发生
A.取代 B.聚合 C.氧化
聚乙烯可用于制造
A.汽车轮胎 B.塑料大棚薄膜 C.食品保鲜袋 D.棉质内衣
4.乙烯水合制得乙醇。乙醇和
 作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势
作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势5.自然界中也存在酯类化合物,如
A.蛋白质 B.淀粉 C.油脂
很多药物中含有酯的结构,如医药史上三大经典药物之一的解热镇痛药阿司匹林,其主要成分是乙酰水杨酸(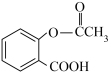 )。写出乙酰水杨酸分子中含有的官能团
)。写出乙酰水杨酸分子中含有的官能团
 是由_______种氨基酸通过分子间脱水形成的。
是由_______种氨基酸通过分子间脱水形成的。| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
名校
解题方法
3 . 填空题
(1)下表是部分化学键的键能参数:
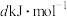 ,白磷及其完全燃烧的产物的结构如图所示,则表中
,白磷及其完全燃烧的产物的结构如图所示,则表中
________ kJ·mol-1(用含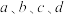 的代数式表示)
的代数式表示)
(2)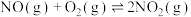 的反应机理和各基元反应的活化能为:
的反应机理和各基元反应的活化能为:
①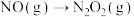
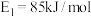
②
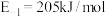
③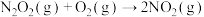
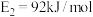
④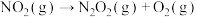
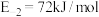
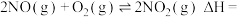
________ 。
(3)已知在 和
和 条件下,有如下反应:①
条件下,有如下反应:①
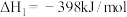
②
 ,若反应
,若反应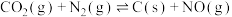 的活化能为
的活化能为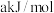 ,则反应
,则反应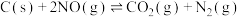 的活化能为
的活化能为________ 。
(4)已知充分燃烧乙炔 气体时,生成
气体时,生成 二氧化碳气体并生成液态水,放出热量
二氧化碳气体并生成液态水,放出热量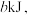 表示乙炔燃烧热的热化学方程式为
表示乙炔燃烧热的热化学方程式为____________________ 。
(5)I.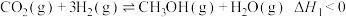
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
由实验测得该反应II的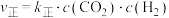 ,
, ,Arrhenius经验公式为
,Arrhenius经验公式为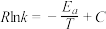 ,其中为
,其中为 活化能,
活化能, 为热力学温度,
为热力学温度, 、
、 、
、 为速率常数,
为速率常数, 和
和 为常数。则
为常数。则
________  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)下表是部分化学键的键能参数:
化学键 |
|
|
|
|
键能 |
|
|
|
|
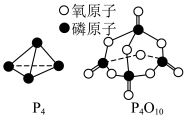
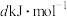 ,白磷及其完全燃烧的产物的结构如图所示,则表中
,白磷及其完全燃烧的产物的结构如图所示,则表中
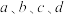 的代数式表示)
的代数式表示)(2)
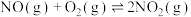 的反应机理和各基元反应的活化能为:
的反应机理和各基元反应的活化能为:①
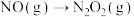
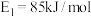
②

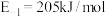
③
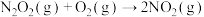
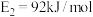
④
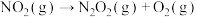
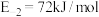
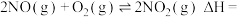
(3)已知在
 和
和 条件下,有如下反应:①
条件下,有如下反应:①
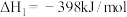
②

 ,若反应
,若反应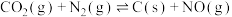 的活化能为
的活化能为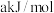 ,则反应
,则反应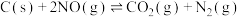 的活化能为
的活化能为(4)已知充分燃烧乙炔
 气体时,生成
气体时,生成 二氧化碳气体并生成液态水,放出热量
二氧化碳气体并生成液态水,放出热量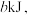 表示乙炔燃烧热的热化学方程式为
表示乙炔燃烧热的热化学方程式为(5)I.
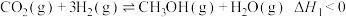
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
由实验测得该反应II的
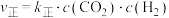 ,
, ,Arrhenius经验公式为
,Arrhenius经验公式为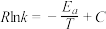 ,其中为
,其中为 活化能,
活化能, 为热力学温度,
为热力学温度, 、
、 、
、 为速率常数,
为速率常数, 和
和 为常数。则
为常数。则
 (用含
(用含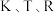 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
4 . 1,6-己二醇是精细化工领域的一种重要原料,广泛应用于UV涂料、聚氨酯、环氧树脂、增塑剂等领域。己二酸二甲酯(DMA)直接加氢制备1,6-己二醇工艺的副产物少、三废少,且产品纯度较高。其制备原理为:
(1)已知
计算上述反应的
___________  。
。
(2)欲提高己二酸二甲酯(DMA)的平衡转化率,可采取下列措施中的___________ (填标号)。
A.适当增压 B.增大DMA的浓度 C.减小产物浓度 D.改进催化剂
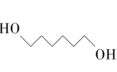
反应后气态混合物冷却至室温,可分离出氢气,冷却过程中最先液化的是1,6-己二醇,其沸点最高的原因是___________ 。
(3)在恒温为T℃、恒容为VL的密闭容器中,若投入1mol DMA和4mol ,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=
,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=___________ 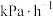 ;T℃下该反应的平衡常数K=
;T℃下该反应的平衡常数K=___________ 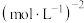 (列出计算式即可)。
(列出计算式即可)。
(4)用 作催化剂,反应压强为3MPa,
作催化剂,反应压强为3MPa,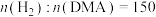 ,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
___________  (填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是
(填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是___________ 。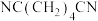 ]合成。
]合成。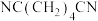 又可用丙烯腈(
又可用丙烯腈( )电有机合成,装置如图所示。
)电有机合成,装置如图所示。___________ 。
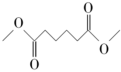 (g)+4H2(g)
(g)+4H2(g)
 (g)+2CH3OH(g) ∆H
(g)+2CH3OH(g) ∆H
(1)已知
| 化学键 | C=O | C—O | C—H | C—C | O—H | H—H |
键能/ | 745 | a | 413 | b | 467 | 436 |

 。
。(2)欲提高己二酸二甲酯(DMA)的平衡转化率,可采取下列措施中的
A.适当增压 B.增大DMA的浓度 C.减小产物浓度 D.改进催化剂
反应后气态混合物冷却至室温,可分离出氢气,冷却过程中最先液化的是1,6-己二醇,其沸点最高的原因是
(3)在恒温为T℃、恒容为VL的密闭容器中,若投入1mol DMA和4mol
 ,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=
,起始时压强为mkPa,反应th达到平衡,DMA的转化率为90%,则0~th的平均反应速率v(DMA)=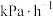 ;T℃下该反应的平衡常数K=
;T℃下该反应的平衡常数K=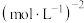 (列出计算式即可)。
(列出计算式即可)。(4)用
 作催化剂,反应压强为3MPa,
作催化剂,反应压强为3MPa,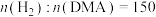 ,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
,反应物以一定的流速通过反应管,测得不同温度下DMA的转化率和1,6-己二醇的收率(收率=转化率×选择性)关系如图所示,图中X点的
 (填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是
(填“大于”“小于”或“等于”);Y点后,随温度升高1,6-己二醇的收率下降的原因是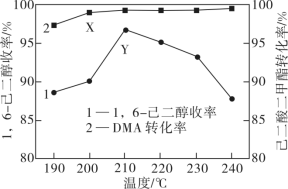
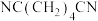 ]合成。
]合成。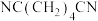 又可用丙烯腈(
又可用丙烯腈( )电有机合成,装置如图所示。
)电有机合成,装置如图所示。
您最近一年使用:0次
2024-05-27更新
|
205次组卷
|
2卷引用:2023届云南省昆明市第一中学高三下学期第五次二轮复习检测(二模)理综试卷-高中化学
解题方法
5 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,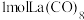 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是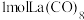 含
含 键。
键。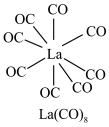
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)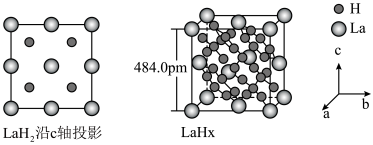
您最近一年使用:0次
名校
解题方法
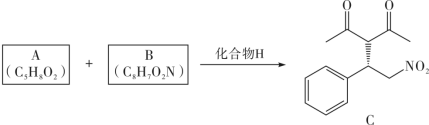
6 . 溶剂是影响化学反应的重要因素之一,当反应在无溶剂条件下进行时,具有操作简单、反应时间短、无溶剂浪费且遵循绿色化学的原理等独特优点。因此,无溶剂不对称催化已成为合成化学中的重要课题。化合物H是一种手性有机催化剂,可无溶剂催化如下迈克尔加成反应(Michael addition reaction): 、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体
、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体
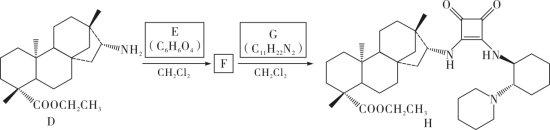
(1)A的化学名称为___________ ;B为反式结构,其结构简式为___________ 。
(2)已知E的核磁共振氢谱只有一个吸收峰。写出D(用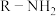 简化表示)与E反应的化学方程式
简化表示)与E反应的化学方程式___________ ,该反应类型为___________ 。
(3)G的同分异构体中,含有碳、氮环状骨架为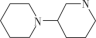 的共有
的共有___________ 种(不含立体异构)。
(4)推测H催化A和B反应的部分机理可能为:A异构化为烯醇(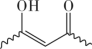 ),再和B与催化剂H结合(如图所示,
),再和B与催化剂H结合(如图所示, 表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的
表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的___________ (填标号)。
a.离子键 b.共价键 c.配位键 d.氢键___________ 。
(5)如果要合成H的类似物H′(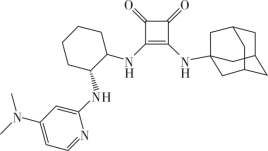 ),参照上述合成路线,写出相应的G′的结构简式
),参照上述合成路线,写出相应的G′的结构简式___________ 。以甲苯为溶剂,H′可催化A与B的迈克尔加成反应,产物主要是___________ (填“C”“C的手性异构体”或“C及其手性异构体各占50%”),判断理由是___________ 。
化合物H的合成路线如下( 、
、 分别表示由纸面向内、向外伸展的共价键):
分别表示由纸面向内、向外伸展的共价键):
 、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体
、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体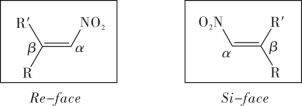
(1)A的化学名称为
(2)已知E的核磁共振氢谱只有一个吸收峰。写出D(用
 简化表示)与E反应的化学方程式
简化表示)与E反应的化学方程式(3)G的同分异构体中,含有碳、氮环状骨架为
 的共有
的共有(4)推测H催化A和B反应的部分机理可能为:A异构化为烯醇(
 ),再和B与催化剂H结合(如图所示,
),再和B与催化剂H结合(如图所示,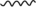 表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的
表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的a.离子键 b.共价键 c.配位键 d.氢键
(5)如果要合成H的类似物H′(
 ),参照上述合成路线,写出相应的G′的结构简式
),参照上述合成路线,写出相应的G′的结构简式
您最近一年使用:0次
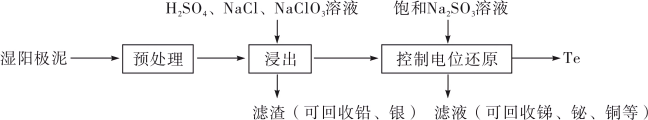
7 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)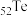 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 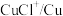 | 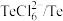 | 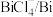 | 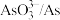 | 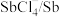 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
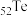 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。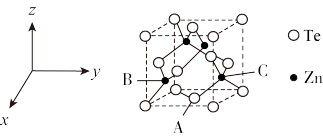
您最近一年使用:0次
名校
解题方法
8 . 某小组利用如下装置(夹持装置略),探究浓、稀硝酸与铜反应的气体产物。回答下列问题:___________ 。
(2)请写出稀硝酸与铜反应的离子方程式___________ 。
(3)为节约药品用量,有人建议用具支试管(下图)代替仪器X,用试管代替集气瓶。为方便控制铜与硝酸反应的发生和停止,改进措施是___________ ;用改进后的装置进行铜与浓硝酸反应的实验,具支试管中产生的气体和排水收集到的气体___________ (填“相同”“不相同”)。 ,
, 仅得到一个
仅得到一个 ,稀硝酸与铜反应生成NO,
,稀硝酸与铜反应生成NO, 得到三个
得到三个 ,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较
,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较___________ ;角度二:同一种还原剂能被浓硝酸氧化,不能被稀硝酸氧化。根据角度二设计了如下装置,用以证明浓硝酸和稀硝酸的氧化性强弱关系。 ,目的是
,目的是___________ ;滴加浓硝酸后,当③中为稀硝酸时,其液面上方气体仍为无色;当③中为浓硝酸时,其液面上方气体由无色变为红棕色,反应的化学方程式为___________ 。
(5)有人提出(4)中角度二的验证实验不够简约,可将之前排水集气收集满NO的两支试管用橡胶塞塞紧,为防止气体逸出产生污染,在不取下胶塞的情况下向试管中分别加入稀硝酸、浓硝酸,简述其加入稀硝酸、浓硝酸的方法___________ 。
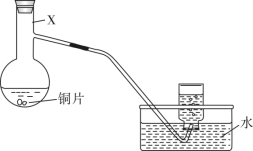
(2)请写出稀硝酸与铜反应的离子方程式
(3)为节约药品用量,有人建议用具支试管(下图)代替仪器X,用试管代替集气瓶。为方便控制铜与硝酸反应的发生和停止,改进措施是
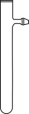
 ,
, 仅得到一个
仅得到一个 ,稀硝酸与铜反应生成NO,
,稀硝酸与铜反应生成NO, 得到三个
得到三个 ,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较
,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较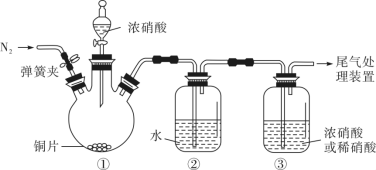
 ,目的是
,目的是(5)有人提出(4)中角度二的验证实验不够简约,可将之前排水集气收集满NO的两支试管用橡胶塞塞紧,为防止气体逸出产生污染,在不取下胶塞的情况下向试管中分别加入稀硝酸、浓硝酸,简述其加入稀硝酸、浓硝酸的方法
您最近一年使用:0次
名校
解题方法
9 . 点击化学(click chemistry)指快速、高效、模块化、简便地拼接合成,其中最具代表性的反应之一是+1价铜催化叠氮与端炔的反应:
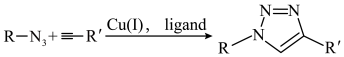
生物正交化学(Bioorthogonal chemistry)则是将化学反应放在活体细胞或组织中快速、无害进行且与生物自身生化反应相互不干扰。为避免铜(Ⅰ)对细胞的毒性,卡罗琳·贝尔托西(Carolyn R。 Bertozzi,2022年诺贝尔化学奖获得者之一)将端炔改为环辛炔,实现了无铜点击化学反应在生物正交化学上的应用,反应如下(其中R代表聚糖或蛋白质, 代表荧光标记基团,可连接环辛炔环上的3或4或5号碳原子):
代表荧光标记基团,可连接环辛炔环上的3或4或5号碳原子):

| A.上述反应的类型为加成反应 |
| B.三键碳与氢原子或烃基之间的相互影响差异较大,使端炔的化学性质较特殊 |
| C.环辛炔中C≡C-C的键角小于180°,稳定性降低,反应活性大于端炔 |
| D.碳原子更多的环炔都能替代环辛炔发生无催化的生物正交化学反应 |
您最近一年使用:0次
解题方法
10 . 现代化学反应中,非常多的反应都需要在分散系中完成,其中因为水的分散能力很强,所以大部分反应需要在水中完成,那么就避免不了需要研究水中的各种平衡以及原理,在水中,我们会有酸碱性,温度,电离与水解,这些都是高中学习探索的重点。可能使用到的数据Ksp(AgCl)=2×10-10,Ksp(AgI)=8.5×10-17,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
(1)下列叙述中,能证明CH3COOH是弱酸的是_______。
(2)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =
=_______ 。
(3)已知25℃,若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=_______ mol/L。在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_______ 性(填“酸”或“碱”或“中”),计算出此时a的值_______ 。(保留两位有效数字)
(1)下列叙述中,能证明CH3COOH是弱酸的是_______。
| A.醋酸易溶于水 |
| B.醋酸溶液的导电能力比盐酸弱 |
| C.常温下,0.010 mol·L-1的醋酸溶液c(H+)=10-3.38 mol·L-1 |
| D.等体积、等浓度的醋酸溶液与NaOH溶液恰好完全反应 |
 =
=(3)已知25℃,若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=
 ,则溶液显
,则溶液显
您最近一年使用:0次