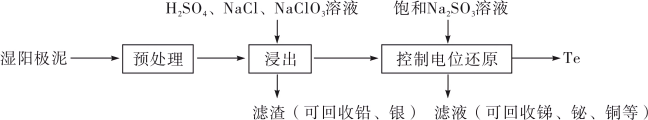
碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)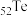 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、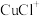 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为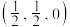 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 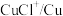 | 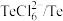 | 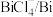 | 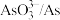 | 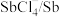 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
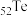 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、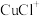 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
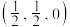 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。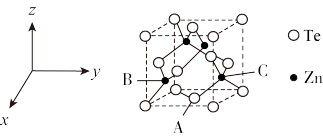
更新时间:2024-05-11 21:57:25
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜。”回答下列问题:
(1)基态Cu原子的电子排布式为_______ ; 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态Cu原子核外电子有_______ 个空间运动状态。
(2)胆矾的化学式为CuSO4·5H2O, 其中SO 的空间构型为
的空间构型为_______
(3)Cu2+能与乙二胺四乙酸根阴离子(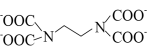 )形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
)形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是_______ ,第一电离能最大的是______ ;C、N原子的轨道杂化类型分别为_____________ 。
(4)Cu的某种含结晶水的氯化物晶体的晶胞结构如图所示。
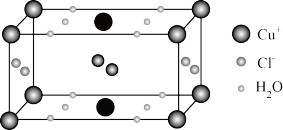
①该晶体的化学式为_____________ 。
②已知晶胞参数为: apm,bpm、 cpm,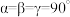 , 设NA为阿伏加德罗常数的值,则该晶体的密度为
, 设NA为阿伏加德罗常数的值,则该晶体的密度为__________ g·cm-3。
(1)基态Cu原子的电子排布式为
(2)胆矾的化学式为CuSO4·5H2O, 其中SO
 的空间构型为
的空间构型为(3)Cu2+能与乙二胺四乙酸根阴离子(
 )形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
)形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是(4)Cu的某种含结晶水的氯化物晶体的晶胞结构如图所示。

①该晶体的化学式为
②已知晶胞参数为: apm,bpm、 cpm,
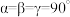 , 设NA为阿伏加德罗常数的值,则该晶体的密度为
, 设NA为阿伏加德罗常数的值,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金建筑和交通等领域应用前景广阔。回答下列有关问题:
(1)基态钛原子的价电子排布式为_______ ;钛(Ti)和锆(Zr)是同一副族的相邻元素,钛和锆的价层电子结构相似,请画出基态锆原子的价电子排布图:_______ 。
(2)二氧化钛(TiO2)是常用的具有较高催化活性和稳定性的光催化剂。在TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2,与CNO-互为等电子体的分子化学式为_______ (写出2个)。TiO2与光气COCl2反应可用于制取四氯化钛,COCl2的空间构型为_______ 。
(3)钛与卤素形成的化合物的熔、沸点如下表所示:
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是_______ 。
(4)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
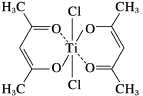
①甲基上的碳原子的杂化类型是_______ 。
②该配合物中含有的化学键有_______ (填标号)。
a离子键 b.σ键 c.金属键 d.π键
(5)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。
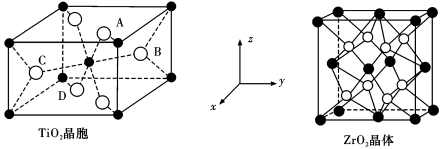
①TiO2晶胞中Ti4+的配位数是_______ 。
②已知二氧化锆晶胞中Zr原子和O原子之间的最短距离为a pm,则二氧化锆晶体的密度为_______ g·cm-3。(列出表达式即可,不用化简,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
(1)基态钛原子的价电子排布式为
(2)二氧化钛(TiO2)是常用的具有较高催化活性和稳定性的光催化剂。在TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2,与CNO-互为等电子体的分子化学式为
(3)钛与卤素形成的化合物的熔、沸点如下表所示:
| TiCl4 | TiBr4 | TiI4 | |
| 熔点/℃ | -24.1 | 38.3 | 155 |
| 沸点/℃ | 136.5 | 233. 5 | 377 |
(4)钛某配合物可用于催化环烯烃聚合,其结构如图所示:

①甲基上的碳原子的杂化类型是
②该配合物中含有的化学键有
a离子键 b.σ键 c.金属键 d.π键
(5)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。

①TiO2晶胞中Ti4+的配位数是
②已知二氧化锆晶胞中Zr原子和O原子之间的最短距离为a pm,则二氧化锆晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为___________ 。
②实际生产中采用铁的氧化物Fe2O3、FeO,使用前用H2和N2的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
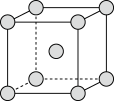
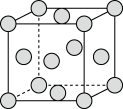
i.两种晶胞所含铁原子个数比为___________ 。
ii.图1晶胞的棱长为apm(1pm=1×10-10cm),则其密度ρ=___________ g·cm-3。
③我国科学家开发出Fe—LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是___ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3。NH3极易溶于水的原因是_____ 。
②反应时,向饱和NaCl溶液中先通入______ 。
③NaHCO3分解得Na2CO3。 空间结构为
空间结构为________ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3的中心原子的杂化轨道类型为___________ 。
②NH3BH3存在配位键,提供空轨道的是___________ 。
③比较熔点:NH3BH3___________ CH3CH3(填“>”或“<”)。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②实际生产中采用铁的氧化物Fe2O3、FeO,使用前用H2和N2的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:


i.两种晶胞所含铁原子个数比为
ii.图1晶胞的棱长为apm(1pm=1×10-10cm),则其密度ρ=
③我国科学家开发出Fe—LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3。NH3极易溶于水的原因是
②反应时,向饱和NaCl溶液中先通入
③NaHCO3分解得Na2CO3。
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
②NH3BH3存在配位键,提供空轨道的是
③比较熔点:NH3BH3
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】环烷酸金属(Cu、Ni、Co、Sn、Zn)盐常作为合成聚氨酯过程中的有效催化剂。回答下列问题:
(1)基态Cu原子的价电子排布____ ,金属Cu晶体采取的是以下____ (填序号)面心立方最密堆积方式。

如图a所示,(●代表Cu原子,○代表O原子),一个Cu2O晶胞中Cu原子的数目为___ 。
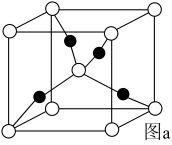
N和Cu形成的化合物的晶胞结构如图所示,该化合物的相对分子质量为M,NA为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是____ g•cm-3。
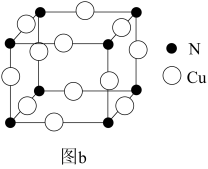
(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有___ 。
A.离子键B.共价键C.配位键D.氢键E.σ键F.π键
(3)Ni、Co的第五电离能:I5(Ni)=73339kJ·mol-1,I5(Co)=7670kJ·mol-1,I5(Ni)<I5(Co),其原因是____ 。橙红色晶体羰基钴[Co2(Co)8]的熔点为52℃,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为___ (填元素符号)。配体CO中σ键与π键数目之比是___ 。
(4)硒化锌晶胞结构如图所示,其晶胞参数为apm。

①相邻的Se2+与Zn2+之间的距离为___ pm。
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标___ 。
(1)基态Cu原子的价电子排布

如图a所示,(●代表Cu原子,○代表O原子),一个Cu2O晶胞中Cu原子的数目为

N和Cu形成的化合物的晶胞结构如图所示,该化合物的相对分子质量为M,NA为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是

(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有
A.离子键B.共价键C.配位键D.氢键E.σ键F.π键
(3)Ni、Co的第五电离能:I5(Ni)=73339kJ·mol-1,I5(Co)=7670kJ·mol-1,I5(Ni)<I5(Co),其原因是
(4)硒化锌晶胞结构如图所示,其晶胞参数为apm。

①相邻的Se2+与Zn2+之间的距离为
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,2p轨道上有2个未成对电子,最外层电子数是内层电子数的3倍。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z基态核外电子排布式为:_______ 。
(2) 的空间构型是
的空间构型是_______ 。
(3)结构简式为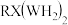 的化合物中R原子的杂化轨道类型为
的化合物中R原子的杂化轨道类型为_______ ;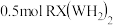 分子中含有
分子中含有 键数目为
键数目为_______ 。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的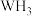 ,可生成
,可生成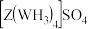 ,下列说法正确的是_______(填字母)。
,下列说法正确的是_______(填字母)。
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
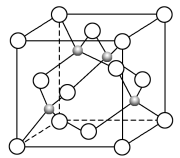
①该晶体的化学式为_______ 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于_______ (填“离子”或“共价”)化合物。
③已知该晶体的密度为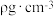 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体中Z原子和Y原子之间的最短距离为
,则该晶体中Z原子和Y原子之间的最短距离为_______  (只写计算式)(Z原子位于体对角线上)。
(只写计算式)(Z原子位于体对角线上)。
(1)Z基态核外电子排布式为:
(2)
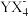 的空间构型是
的空间构型是(3)结构简式为
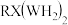 的化合物中R原子的杂化轨道类型为
的化合物中R原子的杂化轨道类型为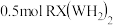 分子中含有
分子中含有 键数目为
键数目为(4)往Z的硫酸盐溶液中通入过量的
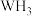 ,可生成
,可生成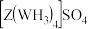 ,下列说法正确的是_______(填字母)。
,下列说法正确的是_______(填字母)。A.在 中 中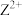 给出孤对电子, 给出孤对电子,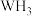 提供空轨道 提供空轨道 |
B.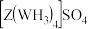 组成元素中第一电离能最大的是氧元素 组成元素中第一电离能最大的是氧元素 |
C.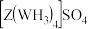 中所含的化学键有离子键、极性键和配位键 中所含的化学键有离子键、极性键和配位键 |
D. 分子内的 分子内的 键角大于 键角大于 分子内的 分子内的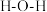 键角 键角 |

①该晶体的化学式为
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于
③已知该晶体的密度为
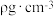 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体中Z原子和Y原子之间的最短距离为
,则该晶体中Z原子和Y原子之间的最短距离为 (只写计算式)(Z原子位于体对角线上)。
(只写计算式)(Z原子位于体对角线上)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
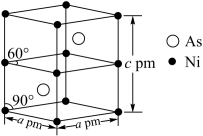
【推荐3】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中含有Fe、As、Ti等元素。回答下列问题:
(1)Fe转化为阳离子时首先失去__ 轨道电子,基态Fe3+核外电子排布式为__ 。
(2)AsH3中心原子杂化类型为__ 。
(3)与As同主族的短周期元素有N、P,一定压强下将AsH3、NH3和PH3的混合气体降温,首先液化的是__ ,理由是___ 。
(4)Ti金属晶体的堆积模型为__ ,配位数为__ ,基态Ti3+中未成对电子数有_ 个。
(5)某砷镍合金的晶胞结构如图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=__ g·cm-3。
(1)Fe转化为阳离子时首先失去
(2)AsH3中心原子杂化类型为
(3)与As同主族的短周期元素有N、P,一定压强下将AsH3、NH3和PH3的混合气体降温,首先液化的是
(4)Ti金属晶体的堆积模型为
(5)某砷镍合金的晶胞结构如图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】根据实验室测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)_____ ;
A.电子天平 B.研钵 C.药匙 D.酒精灯 E.干燥器 F.玻璃棒 G.石棉网 H.蒸发皿 I.坩埚 J.三脚架
除上述仪器外,还需要的仪器是____ ;
(2)某学生实验后得到以下数据:
请写出结晶水x=___ (保留2位小数),实验误差=_____ %(保留2位小数);
从下列选项中选出该学生产生误差的原因可能是(填写字母)____ 。
A.加热前称量时容器未完全干燥 B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
(1)从下列仪器中选出所需仪器(用标号字母填写)
A.电子天平 B.研钵 C.药匙 D.酒精灯 E.干燥器 F.玻璃棒 G.石棉网 H.蒸发皿 I.坩埚 J.三脚架
除上述仪器外,还需要的仪器是
(2)某学生实验后得到以下数据:
加热前的质量(g) | 加热前的质量(g) | ||
W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
第一次 | 15.688 | 17.668 | 16.962 |
第一次 | 15.688 | 17.744 | 17.002 |
从下列选项中选出该学生产生误差的原因可能是(填写字母)
A.加热前称量时容器未完全干燥 B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
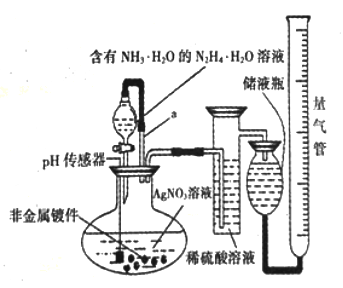
【推荐2】化学镀银法是非金属表面镀银的常用方法。下图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银中的反应如下:
I:4AgNO3+N2H4·H2O=4Ag↓+N2↑+4HNO3+H2O
Ⅱ:NH3·H2O + HNO3=NH4NO3+H2O
Ⅲ:Ag++2 NH3·H2O= [Ag(NH3)2]++2H2O
(1)写出N2H4的电子式______________ 。已知稀硝酸的氧化性强于Ag+,N2H4·H2O中加适量氨水的一个重要目的是控制溶液的pH在8~9之间。简述溶液不能呈酸性的理由___________ 。
(2)带有导管a的分液漏斗叫恒压漏斗,下列关于恒压漏斗在该实验中的作用说法正确的是____ (填选项字母)。
A.防止稀硫酸倒吸进入圆底烧瓶
B.使漏斗中液体顺利流下
C.减小加入液体体积对测量气体体积的误差
D.方便检验装置的气密性
(3)银膜是否均匀致密的关键在于“沉银”速率控制,一般速率越慢,银膜越均匀越致密。简述加入氨水的另外一个目的________ 。
(4)未被还原的Ag+占总银元素质量比(ψ1)叫非还原损耗,被还原但是没有在镀件上附着沉淀的银占总银元素质量比(ψ2)叫还原损耗。实验中用200 mL 0.100 mol/L AgNO3溶液,加过量的N2H4·H2O,测得相关数据如下:
I:非金属镀件镀前质量为20. 000克,镀后质量(已清洗干燥)为21. 728克;
Ⅱ:量气管收集到的气体折算标准状况体积为106. 400 mL。
则ψ1=__________ ;ψ2=____________ 。
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,写出该反应的离子反应方程式:________ 。
化学镀银中的反应如下:
I:4AgNO3+N2H4·H2O=4Ag↓+N2↑+4HNO3+H2O
Ⅱ:NH3·H2O + HNO3=NH4NO3+H2O
Ⅲ:Ag++2 NH3·H2O= [Ag(NH3)2]++2H2O
(1)写出N2H4的电子式
(2)带有导管a的分液漏斗叫恒压漏斗,下列关于恒压漏斗在该实验中的作用说法正确的是
A.防止稀硫酸倒吸进入圆底烧瓶
B.使漏斗中液体顺利流下
C.减小加入液体体积对测量气体体积的误差
D.方便检验装置的气密性
(3)银膜是否均匀致密的关键在于“沉银”速率控制,一般速率越慢,银膜越均匀越致密。简述加入氨水的另外一个目的
(4)未被还原的Ag+占总银元素质量比(ψ1)叫非还原损耗,被还原但是没有在镀件上附着沉淀的银占总银元素质量比(ψ2)叫还原损耗。实验中用200 mL 0.100 mol/L AgNO3溶液,加过量的N2H4·H2O,测得相关数据如下:
I:非金属镀件镀前质量为20. 000克,镀后质量(已清洗干燥)为21. 728克;
Ⅱ:量气管收集到的气体折算标准状况体积为106. 400 mL。
则ψ1=
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,写出该反应的离子反应方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某氯化铁固体样品中含有少量Fe、Al、Fe2O3、Al2O3等杂质,要测定样品中铁元素的质量分数,现称取ag样品,按以下步骤经溶解后配成250mL样品溶液,再进行实验:
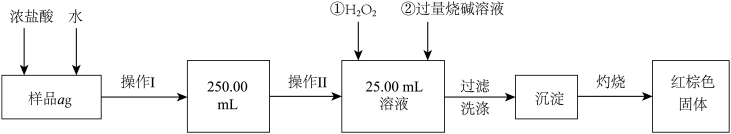
请根据上面流程,回答以下问题:
(1)在溶解样品时需要用到浓盐酸(浓度为36.5%,密度为1.19g/cm3)。该36.5%的浓盐酸的物质的量浓度为___ 。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有___ 、___ (填仪器名称)。操作II量取25.00mL溶液所需仪器___ 。
(3)在25.00mL溶液中加入H2O2的作用是___ ;
(4)加入过量烧碱溶液发生反应的离子方程式为___ 、___ 。
(5)检验沉淀是否已经洗涤干净的操作是___ 。
(6)将沉淀物灼烧、冷却、称量过程中,为了使实验结果准确,必须的操作是___ 。
(7)沉淀的灼烧过程应在___ (填仪器名称)中进行。若灼烧后的固体质量为Wg,则样品中铁元素的质量分数是___ ;若在实验中量取、称量操作准确,最终测量的结果偏大,则造成误差的原因可能是___ 。(写出一种原因即可)

请根据上面流程,回答以下问题:
(1)在溶解样品时需要用到浓盐酸(浓度为36.5%,密度为1.19g/cm3)。该36.5%的浓盐酸的物质的量浓度为
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(3)在25.00mL溶液中加入H2O2的作用是
(4)加入过量烧碱溶液发生反应的离子方程式为
(5)检验沉淀是否已经洗涤干净的操作是
(6)将沉淀物灼烧、冷却、称量过程中,为了使实验结果准确,必须的操作是
(7)沉淀的灼烧过程应在
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备 的工艺流程如图所示。
的工艺流程如图所示。
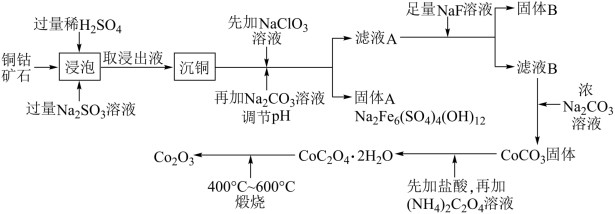
已知:铜钴矿石主要含有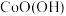 、
、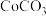 、
、 ,其中还含有一定量的
,其中还含有一定量的 、
、 和
和 等。请回答下列问题:
等。请回答下列问题:
(1)基态 原子的电子排布式是
原子的电子排布式是_______ 。
(2)“浸泡”过程中,可以加快反应速率和提高原料利用率的方法是_______ (写出一种方法即可)。
(3)“浸泡”过程中,加入 溶液的主要作用是
溶液的主要作用是_______ 。
(4)向“沉铜”后的滤液中加入 溶液,写出滤液中的金属离子与
溶液,写出滤液中的金属离子与 反应的离子方程式
反应的离子方程式_______ 。
(5)过滤出的 固体经洗涤后,证明固体已洗净的操作是
固体经洗涤后,证明固体已洗净的操作是_______ 。
(6) 在空气中高温煅烧得到
在空气中高温煅烧得到 的化学方程式是
的化学方程式是_______ 。
(7)一定温度下,向滤液A中加入足量的 溶液可将
溶液可将 、
、 沉淀而除去,若所得滤液B中
沉淀而除去,若所得滤液B中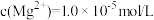 ,则滤液B中
,则滤液B中 为
为_______ 。[已知该温度下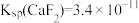 ,
,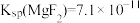 ]
]
 的工艺流程如图所示。
的工艺流程如图所示。
已知:铜钴矿石主要含有
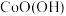 、
、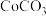 、
、 ,其中还含有一定量的
,其中还含有一定量的 、
、 和
和 等。请回答下列问题:
等。请回答下列问题:(1)基态
 原子的电子排布式是
原子的电子排布式是(2)“浸泡”过程中,可以加快反应速率和提高原料利用率的方法是
(3)“浸泡”过程中,加入
 溶液的主要作用是
溶液的主要作用是(4)向“沉铜”后的滤液中加入
 溶液,写出滤液中的金属离子与
溶液,写出滤液中的金属离子与 反应的离子方程式
反应的离子方程式(5)过滤出的
 固体经洗涤后,证明固体已洗净的操作是
固体经洗涤后,证明固体已洗净的操作是(6)
 在空气中高温煅烧得到
在空气中高温煅烧得到 的化学方程式是
的化学方程式是(7)一定温度下,向滤液A中加入足量的
 溶液可将
溶液可将 、
、 沉淀而除去,若所得滤液B中
沉淀而除去,若所得滤液B中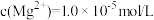 ,则滤液B中
,则滤液B中 为
为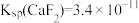 ,
,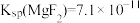 ]
]
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】氧氯化锆 可溶于水,微溶于盐酸,可用作橡胶添加剂、涂料干燥剂、耐火材料等。工业上以锆英砂(主要成分是
可溶于水,微溶于盐酸,可用作橡胶添加剂、涂料干燥剂、耐火材料等。工业上以锆英砂(主要成分是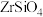 ,不考虑杂质的影响)为原料,用“一酸一碱法”生产
,不考虑杂质的影响)为原料,用“一酸一碱法”生产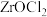 的流程如下图所示:
的流程如下图所示:
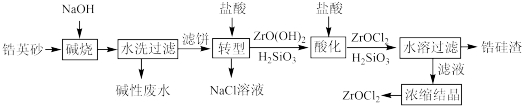
请回答下列问题:
(1)高温碱烧过程生成了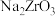 和另一种钠盐,该反应的化学方程式是
和另一种钠盐,该反应的化学方程式是_______ 。
(2)转型操作的目的是_______ 。流程中有两步操作是为了除硅元素,这两步操作的名称分别是_______ 、_______ 。
(3)酸化过程需加入过量盐酸,该操作中发生反应的离子方程式是_______ 。
(4)“沸腾氯化法”是另一种生产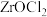 的方法,该方法先将锆英砂和焦炭研磨成粉并混合,在高温的沸腾炉中用氯气将粉末吹起并充分反应生成
的方法,该方法先将锆英砂和焦炭研磨成粉并混合,在高温的沸腾炉中用氯气将粉末吹起并充分反应生成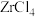 、
、 和CO,分离出的
和CO,分离出的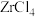 水解即可得到
水解即可得到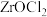 和盐酸。
和盐酸。
①在沸腾炉中用氯气把粉末吹起的目的是_______ 。
②“沸腾氯化法”与“一酸一碱法”相比优点是_______ 。
 可溶于水,微溶于盐酸,可用作橡胶添加剂、涂料干燥剂、耐火材料等。工业上以锆英砂(主要成分是
可溶于水,微溶于盐酸,可用作橡胶添加剂、涂料干燥剂、耐火材料等。工业上以锆英砂(主要成分是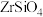 ,不考虑杂质的影响)为原料,用“一酸一碱法”生产
,不考虑杂质的影响)为原料,用“一酸一碱法”生产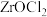 的流程如下图所示:
的流程如下图所示:
请回答下列问题:
(1)高温碱烧过程生成了
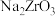 和另一种钠盐,该反应的化学方程式是
和另一种钠盐,该反应的化学方程式是(2)转型操作的目的是
(3)酸化过程需加入过量盐酸,该操作中发生反应的离子方程式是
(4)“沸腾氯化法”是另一种生产
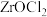 的方法,该方法先将锆英砂和焦炭研磨成粉并混合,在高温的沸腾炉中用氯气将粉末吹起并充分反应生成
的方法,该方法先将锆英砂和焦炭研磨成粉并混合,在高温的沸腾炉中用氯气将粉末吹起并充分反应生成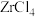 、
、 和CO,分离出的
和CO,分离出的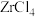 水解即可得到
水解即可得到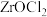 和盐酸。
和盐酸。①在沸腾炉中用氯气把粉末吹起的目的是
②“沸腾氯化法”与“一酸一碱法”相比优点是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅰⅰ.
回答下列问题:
(1)反应之前先将矿石粉碎的目的是___________ 。
(2)步骤③加的试剂为__________ ,此时溶液pH要调到5的目的____________ 。
(3)写出反应④的离子反应方程式___________ 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式______________ 。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是_________ (填操作名称)。

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅰⅰ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是
(2)步骤③加的试剂为
(3)写出反应④的离子反应方程式
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是
您最近一年使用:0次



