北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜。”回答下列问题:
(1)基态Cu原子的电子排布式为_______ ; 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态Cu原子核外电子有_______ 个空间运动状态。
(2)胆矾的化学式为CuSO4·5H2O, 其中SO 的空间构型为
的空间构型为_______
(3)Cu2+能与乙二胺四乙酸根阴离子(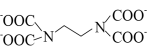 )形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
)形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是_______ ,第一电离能最大的是______ ;C、N原子的轨道杂化类型分别为_____________ 。
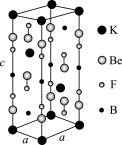
(4)Cu的某种含结晶水的氯化物晶体的晶胞结构如图所示。
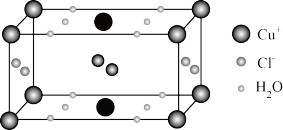
①该晶体的化学式为_____________ 。
②已知晶胞参数为: apm,bpm、 cpm,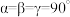 , 设NA为阿伏加德罗常数的值,则该晶体的密度为
, 设NA为阿伏加德罗常数的值,则该晶体的密度为__________ g·cm-3。
(1)基态Cu原子的电子排布式为
(2)胆矾的化学式为CuSO4·5H2O, 其中SO
 的空间构型为
的空间构型为(3)Cu2+能与乙二胺四乙酸根阴离子(
 )形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
)形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是(4)Cu的某种含结晶水的氯化物晶体的晶胞结构如图所示。

①该晶体的化学式为
②已知晶胞参数为: apm,bpm、 cpm,
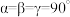 , 设NA为阿伏加德罗常数的值,则该晶体的密度为
, 设NA为阿伏加德罗常数的值,则该晶体的密度为
更新时间:2021-09-12 08:15:08
|
相似题推荐
【推荐1】据Nature Energy报道,最近科研人员研制出一种低浓度锂盐水系电解质溶液,充放电过程中锂离子具有较高的扩散速率,使得锂离子电池 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。
(1)对电极材料组成元素的分析。
①O原子核外电子有___________ 种运动状态。
②Mn元素位于元素周期表的___________ 区。
③基态Ti原子的核外电子排布式为___________ 。
(2)将 和
和 按
按 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。
①该反应的化学方程式为___________ 。
② 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和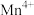 的含量与温度的关系见下表。
的含量与温度的关系见下表。
在上述温度范围内,锰元素平均价态的变化趋势为___________ 。
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂( )。
)。
①Ti的氧化物晶胞结构如图所示,其化学式为___________ 。
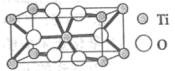
②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(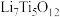 ),则正极的电极反应式为
),则正极的电极反应式为___________ 。
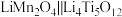 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。(1)对电极材料组成元素的分析。
①O原子核外电子有
②Mn元素位于元素周期表的
③基态Ti原子的核外电子排布式为
(2)将
 和
和 按
按 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。①该反应的化学方程式为
②
 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和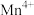 的含量与温度的关系见下表。
的含量与温度的关系见下表。| T/℃ | 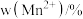 | 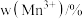 | 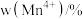 |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂(
 )。
)。①Ti的氧化物晶胞结构如图所示,其化学式为

②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(
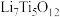 ),则正极的电极反应式为
),则正极的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】据《科学》报道,中国科学家首次利用第V A族元素Bi实现超导体(Bi2Te3/NbSe2 )中分段费米面。回答下列问题:
(1)Bi与As位于同主族,基态As原子的价层电子排布式为_____ ,基态Se原子p能级上共有_________ 个电子。
(2)第二周期元素中,第一电离能介于B、N之间的元素是_________ (填元素符号)。
(3)碲的化合物TeO2、TeO3、H2Te三种物质中, H2Te的中心原子杂化类型为_______ ,分子构型为V形的是________ 。
(4)四氟化铌(NbF4)的熔点为72 °C,它的晶体类型为___________ 。
(5)CdSe是一种重要的半导体材料,其中一种晶体为闪锌矿型结构,晶胞结构如图所示,A点Se原子坐标为( ,
,  ,
, ),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为_____________________ ;已知晶胞参数为anm,则CdSe的密度为_________________ g·cm-3(列出计算表达式, NA表示阿伏加德罗常数的值)。

(1)Bi与As位于同主族,基态As原子的价层电子排布式为
(2)第二周期元素中,第一电离能介于B、N之间的元素是
(3)碲的化合物TeO2、TeO3、H2Te三种物质中, H2Te的中心原子杂化类型为
(4)四氟化铌(NbF4)的熔点为72 °C,它的晶体类型为
(5)CdSe是一种重要的半导体材料,其中一种晶体为闪锌矿型结构,晶胞结构如图所示,A点Se原子坐标为(
 ,
,  ,
, ),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】NiO是一种重要的化工原料,可用于制磁性材料、蓄电池、电子元件等。回答下列问题:
(1)基态Ni原子的价层电子排式为_______ ;基态O原子核外电子占据的最高能级的电子云轮廓图形状为_______ 。
(2)几种氧化物的沸点如表所示:
①表中氧化物之间沸点差异的原因为_______ 。
② 中Si的杂化方式为
中Si的杂化方式为_______ ; 的立体构型为
的立体构型为_______ ;Si、O、S的电负性由大到小的顺序为_______ 。
(3) 、
、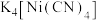 、
、 均为重要的化学试剂。
均为重要的化学试剂。
① 中含有配位键的总数为
中含有配位键的总数为_______ 。
②K、Ni、N、S的第一电离能由大到小的顺序为_______ 。
(4)NiO晶体具有NaCl型立方结构,其晶胞结构如图所示。

①NiO晶胞中 形成的正四面体和正八面体的数目之比为
形成的正四面体和正八面体的数目之比为_______ 。
②若阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为 ,
, 半径为a nm,则
半径为a nm,则 半径为
半径为_______ nm。
(1)基态Ni原子的价层电子排式为
(2)几种氧化物的沸点如表所示:
| 氧化物 |  |  |  |  |
| 沸点/℃ | 2230 | 100 | 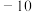 | 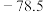 |
①表中氧化物之间沸点差异的原因为
②
 中Si的杂化方式为
中Si的杂化方式为 的立体构型为
的立体构型为(3)
 、
、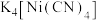 、
、 均为重要的化学试剂。
均为重要的化学试剂。①
 中含有配位键的总数为
中含有配位键的总数为②K、Ni、N、S的第一电离能由大到小的顺序为
(4)NiO晶体具有NaCl型立方结构,其晶胞结构如图所示。

①NiO晶胞中
 形成的正四面体和正八面体的数目之比为
形成的正四面体和正八面体的数目之比为②若阿伏加德罗常数的值为
 ,该晶体的密度为
,该晶体的密度为 ,
, 半径为a nm,则
半径为a nm,则 半径为
半径为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】A、B、C、D、E、F均为周期表中前四周期的元素,且原子序数依次增大。请按要求回答下列问题。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因_______ 。
(2)量子力学把电子在原子核外的一个空间运动状态称为一个_______ ,电子除空间运动状态外,还有一种运动状态叫做_______ 。B是地壳中含量最高的元素,B基态原子的电子空间运动状态有_______ 种。
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关C、D的叙述正确的是_______ 。
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为_______ ,E的晶胞是六方最密堆积结构(如图1),E原子的配位数为_______ ;若E的相对原子质量为M,E原子半径为rcm。该晶胞的空间利用率为_______ (用含r、h的代数式表达,可以不必化简)。_______ (填“是”或否”),该立方体是不是F3B4的晶胞_______ (填“是”或“否”)。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因
| A2H4 | AH3 | |
| 熔点/°C | 2 | -77.8 |
| 沸点/°C | 113.5 | -33.5 |
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| C(或D) | 578 | 1817 | 2745 | 11578 |
| C(或D) | 738 | 1451 | 7733 | 10540 |
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为


您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】金属锂溶于液氨可得到具有高反应活性的金属电子溶液,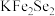 与其作用可制得超导体
与其作用可制得超导体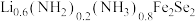 ,进一步可制得超导材料
,进一步可制得超导材料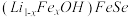 。
。
回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是______ (填标号)
A. B.
B. C.
C.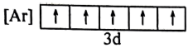 D.
D.
(2)液氨可以发生微弱的电离生成 和
和 ,下列说法错误的是
,下列说法错误的是________
(3)Fe2+可与邻二氮菲形成红色配合物,结构如图所示。元素的电负性从大到小的顺序为______ (填元素符号)。配合物中N原子的VSEPR模型为____________ ;下列对Fe杂化方式推断合理的是______ (填标号)。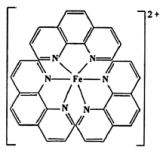
A. B.
B. C.
C. D.
D.
(4)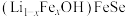 晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是
晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是______ ,铁硒层和锂铁氢氧层之间由极其微弱的氢键相连,该氢键可表示为______ 。已知锂铁氢氧层中锂铁个数之比为4∶1,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为______ g·cm 。
。

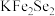 与其作用可制得超导体
与其作用可制得超导体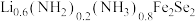 ,进一步可制得超导材料
,进一步可制得超导材料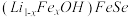 。
。回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
A.
 B.
B. C.
C. D.
D.
(2)液氨可以发生微弱的电离生成
 和
和 ,下列说法错误的是
,下列说法错误的是A.键角: | B.结合质子能力: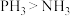 |
C.热稳定性: | D. 与 与 的分子构型及N的化合价均相同 的分子构型及N的化合价均相同 |

A.
 B.
B. C.
C. D.
D.
(4)
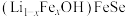 晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是
晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】过渡金属在能源、环境、材料、生命科学等领域发挥着重要作用。
I.研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。
(1)铜的晶胞结构如图所示,与铜原子最近且等距离的铜原子有_______ 个。
(2)碱式硫酸铜(Cu2(OH)2SO4)是农药波尔多液的有效杀菌成分,其中非金属元素电负性由大到小的顺序是_______ ,阴离子SO 中心原子的价层电子对数目为
中心原子的价层电子对数目为_______ (列出计算式)。
II.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
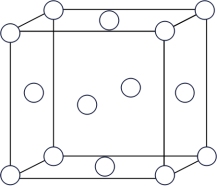
(3)普鲁士蓝俗称铁蓝,是含有铁元素的一种化合物,可以解铊中毒,结构如图所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为_______ ,又知该晶体中铁元素有+2价和十3价两种,则Fe3+与Fe2+的个数比为_______ 。
III.TiO2-aNb是常见的光学活性物质。
(4)基态Ti原子的电子所占据的最高能层符号为_______ 。
(5)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______ g/cm3。
②图乙TiO2-aNb晶体中a=_______ 。
I.研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。
(1)铜的晶胞结构如图所示,与铜原子最近且等距离的铜原子有

(2)碱式硫酸铜(Cu2(OH)2SO4)是农药波尔多液的有效杀菌成分,其中非金属元素电负性由大到小的顺序是
 中心原子的价层电子对数目为
中心原子的价层电子对数目为II.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(3)普鲁士蓝俗称铁蓝,是含有铁元素的一种化合物,可以解铊中毒,结构如图所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为

III.TiO2-aNb是常见的光学活性物质。
(4)基态Ti原子的电子所占据的最高能层符号为
(5)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为
②图乙TiO2-aNb晶体中a=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(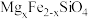 )。回答下列问题:
)。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。橄榄石中,各元素电负性由大到小的顺序为___________ 。
(2)已知一些物质的熔点数据如下表:
① 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是___________ 。
②分析同族元素的氯化物 、
、 、
、 熔点变化趋势的原因
熔点变化趋势的原因___________ 。 的空间结构为
的空间结构为___________ ,其中 的轨道杂化形式为
的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有___________ 个 。该物质化学式为
。该物质化学式为___________ ,B-B最近距离为___________ 。
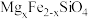 )。回答下列问题:
)。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
 与
与 均为第三周期元素,
均为第三周期元素, 熔点明显高于
熔点明显高于 ,原因是
,原因是②分析同族元素的氯化物
 、
、 、
、 熔点变化趋势的原因
熔点变化趋势的原因 的空间结构为
的空间结构为 的轨道杂化形式为
的轨道杂化形式为(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有
 。该物质化学式为
。该物质化学式为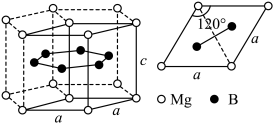
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
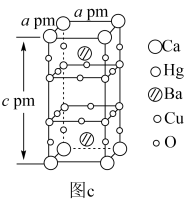
【推荐2】超导材料和超导技术是2世纪最伟大的发现之一,有着广阔的应用前景。我国科学家发现了一种新型的超导体材料 ,由
,由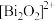 和
和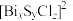 交替堆叠构成。其中A层是由
交替堆叠构成。其中A层是由 无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。
无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。

(1)画出基态S的价电子排布图_______ 。
(2)写出A层离子的化学式_______ 。A层各元素的第一电离能由大到小的顺序为_______ 。
(3)“依布硒”( )具有良好的抗炎活性。下列说法正确的是
)具有良好的抗炎活性。下列说法正确的是_______ 。
a.Se采用sp3的方式杂化
b.分子中各个C原子的杂化方式不同
c.分子中既含有极性共价键,又含有非极性共价键
d.分子中 和
和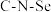 的键角相同
的键角相同
(4)H2O和H2S都是分子晶体,熔沸点较高的是_______ ,原因是_______ 。
(5)83Bi是第_______ 周期VA族元素, 是一种极少数不溶性的钠盐,其阴离子的立体构型为
是一种极少数不溶性的钠盐,其阴离子的立体构型为_______ 。
(6)汞钡铜氧晶体通过掺杂Ca2+可以获得具有更高临界温度的超导材料,如图c所示。其密度为_______  (列式表示、设NA为阿伏加德罗常数的值)。
(列式表示、设NA为阿伏加德罗常数的值)。
 ,由
,由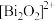 和
和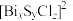 交替堆叠构成。其中A层是由
交替堆叠构成。其中A层是由 无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。
无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。
(1)画出基态S的价电子排布图
(2)写出A层离子的化学式
(3)“依布硒”(
 )具有良好的抗炎活性。下列说法正确的是
)具有良好的抗炎活性。下列说法正确的是a.Se采用sp3的方式杂化
b.分子中各个C原子的杂化方式不同
c.分子中既含有极性共价键,又含有非极性共价键
d.分子中
 和
和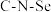 的键角相同
的键角相同(4)H2O和H2S都是分子晶体,熔沸点较高的是
(5)83Bi是第
 是一种极少数不溶性的钠盐,其阴离子的立体构型为
是一种极少数不溶性的钠盐,其阴离子的立体构型为(6)汞钡铜氧晶体通过掺杂Ca2+可以获得具有更高临界温度的超导材料,如图c所示。其密度为
 (列式表示、设NA为阿伏加德罗常数的值)。
(列式表示、设NA为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】非线性光学材料氟代硼铍酸钾晶体(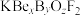 )具有重大战略价值,我国科学家利用BeO、
)具有重大战略价值,我国科学家利用BeO、 和
和 合成了
合成了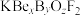 ,晶体中每个硼原子与三个氧原子配位形成平面三角形
,晶体中每个硼原子与三个氧原子配位形成平面三角形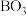 基团,其晶胞如图所示(氧原子略去)。回答下列问题:
基团,其晶胞如图所示(氧原子略去)。回答下列问题:
(1)基态 的电子轨道表示式为
的电子轨道表示式为_______ ;下列氟原子激发态中能量最高的是_______ (填字母)。
a. b.
b.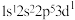 c.
c.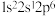 d.
d.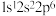
(2)Be和B均易形成配位化合物,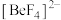 中含有的配位键数目为
中含有的配位键数目为_______ , 中阴离子的空间结构为
中阴离子的空间结构为_______ 。
(3) 是硼酸的酸性氧化物,硼酸具有如图的片层状结构,1mol硼酸中含有氢键的物质的量为
是硼酸的酸性氧化物,硼酸具有如图的片层状结构,1mol硼酸中含有氢键的物质的量为_______ mol,加热时硼酸溶解度增大的原因是_______ 。

(4)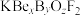 中
中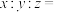
_______ ,设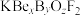 的摩尔质量为
的摩尔质量为 ,其中晶胞参数分别为
,其中晶胞参数分别为 和
和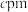 ,且
,且 ,则该晶体的密度为
,则该晶体的密度为_______  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
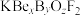 )具有重大战略价值,我国科学家利用BeO、
)具有重大战略价值,我国科学家利用BeO、 和
和 合成了
合成了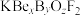 ,晶体中每个硼原子与三个氧原子配位形成平面三角形
,晶体中每个硼原子与三个氧原子配位形成平面三角形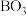 基团,其晶胞如图所示(氧原子略去)。回答下列问题:
基团,其晶胞如图所示(氧原子略去)。回答下列问题:
(1)基态
 的电子轨道表示式为
的电子轨道表示式为a.
 b.
b.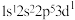 c.
c.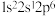 d.
d.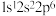
(2)Be和B均易形成配位化合物,
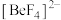 中含有的配位键数目为
中含有的配位键数目为 中阴离子的空间结构为
中阴离子的空间结构为(3)
 是硼酸的酸性氧化物,硼酸具有如图的片层状结构,1mol硼酸中含有氢键的物质的量为
是硼酸的酸性氧化物,硼酸具有如图的片层状结构,1mol硼酸中含有氢键的物质的量为
(4)
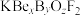 中
中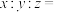
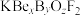 的摩尔质量为
的摩尔质量为 ,其中晶胞参数分别为
,其中晶胞参数分别为 和
和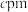 ,且
,且 ,则该晶体的密度为
,则该晶体的密度为 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】氮元素形成的化合物种类众多,用途广泛。根据信息回答下列问题。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为________________ 。
②上述涉及的元素H、B 、C、N、O中电负性最大的是_____ (填元素符号)。
(2)BF3、NH3和PH3分子中键角由大到小的顺序为_____ 。
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=__________________ 。
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:
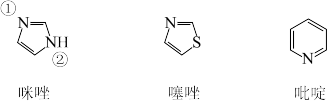
①上述三种物质中,沸点最高的是_____ (填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为_____________ 。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是_____ (填“①”或“②” )号氮原子。
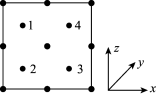
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为________ 。
(6)某铁氮化合物晶体的晶胞结构如图所示。
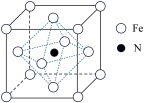
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_____ 。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g·cm-3(列出计算式即可)。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为
②上述涉及的元素H、B 、C、N、O中电负性最大的是
(2)BF3、NH3和PH3分子中键角由大到小的顺序为
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:

①上述三种物质中,沸点最高的是
②吡啶中氮原子的杂化轨道的空间构型为
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(
 ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为
(6)某铁氮化合物晶体的晶胞结构如图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为__________ ,该电子层具有的原子轨道数为______ .
②LiBH4由Li+和BH 构成,BH
构成,BH 的立体构型是
的立体构型是______ ,B原子的杂化轨道类型是_______ .
③Li、B元素的电负性由小到大的顺序为_______________________ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________ H-(填“>”“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
M是________ 族元素.
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是________ g·cm-3.(仅写表达式,不计算)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为
②LiBH4由Li+和BH
 构成,BH
构成,BH 的立体构型是
的立体构型是③Li、B元素的电负性由小到大的顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1 451 | 7 733 | 10 540 | 13 630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】东晋《华阳国志·南中志》卷四中关于白铜的记载—云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)基态Ni原子的价电子排布图为_______ ;3d能级上的未成对电子数为_______ 。
(2)单质铜及镍都是由_______ 键形成的晶体;元素铜与镍的第二电离能分别为: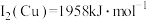 、
、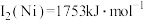 ,
,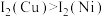 的原因是
的原因是_______ 。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。

①1 mol丁二酮肟分子中含有σ键的数目为_______ mol。
②2丁二酮肟镍分子中碳原子的杂化轨道类型为_______ 。
(4)Ni的晶胞结构如图所示,晶体中镍原子的配位数是_______ ;若Ni的原子半径为d pm,Ni的密度计算表达式是_______ g/cm3;Ni原子空间利用率的计算表达式是_______ 。(Ni的相对原子量用Mr表示)
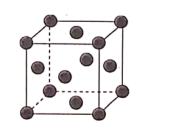
(1)基态Ni原子的价电子排布图为
(2)单质铜及镍都是由
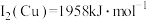 、
、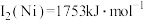 ,
,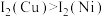 的原因是
的原因是(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。

①1 mol丁二酮肟分子中含有σ键的数目为
②2丁二酮肟镍分子中碳原子的杂化轨道类型为
(4)Ni的晶胞结构如图所示,晶体中镍原子的配位数是

您最近一年使用:0次



