名校
1 . 查阅资料可知:Bi位于周期表的第VA族, 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:
①向稀硫酸酸化的 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。
②继续滴加适量草酸 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。
下列说法正确的是
 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:①向稀硫酸酸化的
 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。②继续滴加适量草酸
 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。下列说法正确的是
| A.Bi的基态原子中只含一个未成对电子 |
B.由操作①现象可知酸性条件下氧化性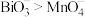 |
C.操作②中每生成标准状况下 ,反应转移1mol电子 ,反应转移1mol电子 |
D.向稀硫酸酸化的 中加入草酸,溶液会变为紫红色 中加入草酸,溶液会变为紫红色 |
您最近一年使用:0次
今日更新
|
2次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
解题方法
2 . 现代化学反应中,非常多的反应都需要在分散系中完成,其中因为水的分散能力很强,所以大部分反应需要在水中完成,那么就避免不了需要研究水中的各种平衡以及原理,在水中,我们会有酸碱性,温度,电离与水解,这些都是高中学习探索的重点。可能使用到的数据Ksp(AgCl)=2×10-10,Ksp(AgI)=8.5×10-17,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
(1)下列叙述中,能证明CH3COOH是弱酸的是_______。
(2)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =
=_______ 。
(3)已知25℃,若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=_______ mol/L。在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_______ 性(填“酸”或“碱”或“中”),计算出此时a的值_______ 。(保留两位有效数字)
(1)下列叙述中,能证明CH3COOH是弱酸的是_______。
| A.醋酸易溶于水 |
| B.醋酸溶液的导电能力比盐酸弱 |
| C.常温下,0.010 mol·L-1的醋酸溶液c(H+)=10-3.38 mol·L-1 |
| D.等体积、等浓度的醋酸溶液与NaOH溶液恰好完全反应 |
 =
=(3)已知25℃,若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=
 ,则溶液显
,则溶液显
您最近一年使用:0次
解题方法
3 . 草酸(H2C2O4)、草酸铵[(NH4)2C2O4]是重要的化合物。回答下列问题:
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:_______________ (装置可重复利用)。装置F中发生的化学反应方程式为_______________ 。
②能证明草酸晶体分解产物中有CO的现象是_______________ 。
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为 。该反应中,还原剂为
。该反应中,还原剂为______________ (填化学式),若称取mg草酸晶体(H2C2O4·2H2O)粗产品,配成100mL溶液于锥形瓶中,加入V mL a mol·L-1KMnO4溶液,恰好完全反应,则该草酸晶体的纯度为______________ %[M(H2C2O4·2H2O)=126g·mol-1]。
(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:______________ (填化学式)。
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示:_______________ ;“高温分解”需控制的最低温度为_______________ (经测定290~890℃过程中产生的气体只有CO2)。
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:
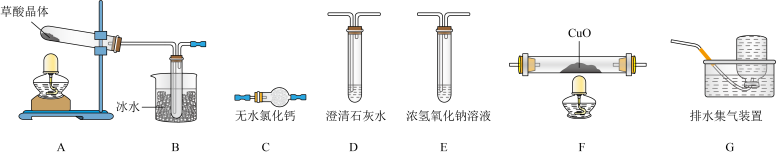
②能证明草酸晶体分解产物中有CO的现象是
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为
 。该反应中,还原剂为
。该反应中,还原剂为(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:
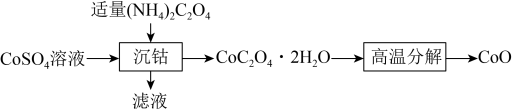
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示: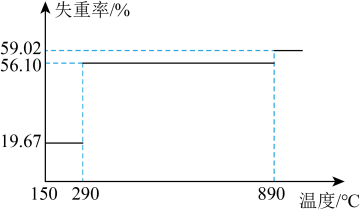
您最近一年使用:0次
解题方法
4 . 磷的单质及其化合物在生产、生活中具有广泛应用。回答下列问题:
(1)基态磷原子价电子排布式为___________ ,核外电子占据的最高能级的电子云轮廓图为___________ 形。
(2)第三周期元素中第一电离能介于硅和磷之间的元素为___________ (填元素符号),离子半径:
___________ (填“>”“<”或“=”) 。
。
(3) 固体属于
固体属于___________ 晶体,键能: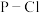
___________ (填“>”“<”或“=”) ,
, 、
、 中键角较大的是
中键角较大的是___________ 。
(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为 。
。 中磷原子的杂化方式为
中磷原子的杂化方式为___________ 。
②白磷晶体中,距离一个 最近的
最近的 个数为
个数为___________ 。
③该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态磷原子价电子排布式为
(2)第三周期元素中第一电离能介于硅和磷之间的元素为

 。
。(3)
 固体属于
固体属于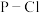
 ,
, 、
、 中键角较大的是
中键角较大的是(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为
 。
。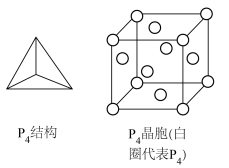
 中磷原子的杂化方式为
中磷原子的杂化方式为②白磷晶体中,距离一个
 最近的
最近的 个数为
个数为③该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
5 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(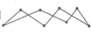 ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=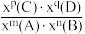 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。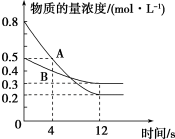
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=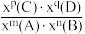 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
名校
解题方法
6 . 铁及其化合物在生产生活中应用非常广泛。回答下列问题:
(1)根据价电子排布规律,铁元素位于元素周期表的_______ 区,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.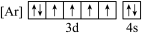 b.
b.
c.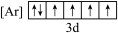 d.
d.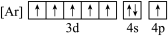
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝),[Fe(CN)6]4-中σ键数目为_______ ,Fe2+的杂化方式为_______ (填标号)。
a.sp2 b.sp3 c.d2sp3 d.dsp3
已知可溶性氰化物如KCN有剧毒,但普鲁士蓝无毒,请从结构角度解释原因:_______ 。
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为Fe2++3phen═[Fe(phen)3]2+。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是_______ 。
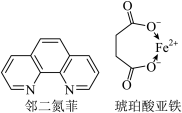
a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)无水FeCl3共价性较强,在气态时以二聚体形式存在: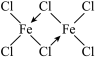 ;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图
;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图_______ 。
(1)根据价电子排布规律,铁元素位于元素周期表的
a.
 b.
b.
c.
 d.
d.
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝),[Fe(CN)6]4-中σ键数目为
a.sp2 b.sp3 c.d2sp3 d.dsp3
已知可溶性氰化物如KCN有剧毒,但普鲁士蓝无毒,请从结构角度解释原因:
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为Fe2++3phen═[Fe(phen)3]2+。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是

a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)无水FeCl3共价性较强,在气态时以二聚体形式存在:
 ;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图
;Fe3+的强酸盐水解会得到黄色的[Fe(OH)(H2O)5]2+及其二聚体[Fe2(OH)2(H2O)8]4+,请画出该二聚体的结构示意图
您最近一年使用:0次
解题方法
7 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
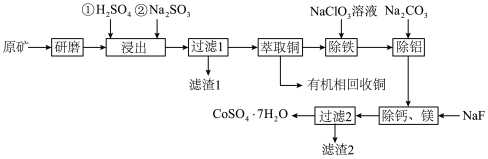
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知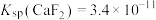 ,
,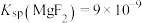 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中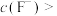
___________  。
。
(6)由“过滤2”后的母液得到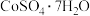 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
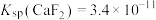 ,
,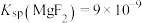 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中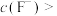
 。
。(6)由“过滤2”后的母液得到
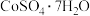 的操作是
的操作是
您最近一年使用:0次
名校
解题方法
8 . 甲基叔戊基醚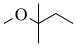 (TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇
(TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇 (简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应(
(简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应( 为2-甲基-1-丁烯的简写,不考虑其他副反应):
为2-甲基-1-丁烯的简写,不考虑其他副反应):
反应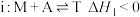
反应ii: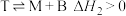
反应iii:
(1)磷钼酸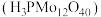 可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第VIB族,核外电子排布与
可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第VIB族,核外电子排布与 相似。
相似。
①基态钼原子的价层电子排布式为_______ 。
②完成化学方程式: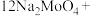
_______ 
(2)比较
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)我国学者团队对制备TAME反应的催化剂进行了研究。研究衣明:用不同浓度(13%)的磷钼酸浸渍催化剂,浓度越大催化剂催化活性越好。用浓度分别为 的磷钼酸浸渍催化剂进行了三组实验,得到
的磷钼酸浸渍催化剂进行了三组实验,得到 随时间
随时间 的变化曲线如图所示。
的变化曲线如图所示。
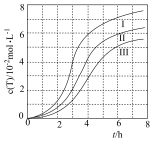
①用 的磷钼酸浸渍时,在
的磷钼酸浸渍时,在 内,
内, 的平均生成速率为
的平均生成速率为_______ 。
②下列仿关说法正确的有_______ 。
A.三组实验中,反应速率都随反应进程一直增大
B.平衡后加入惰性溶剂四氢呋喃稀释, 减小
减小
C.催化剂可加快化学反应速率,提高甲醇的平衡转化率
D.降低温度,反应 和ii的正、逆反应速率都减小
和ii的正、逆反应速率都减小
E.达到平衡后,加入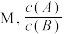 不变
不变
(4)研究团队继续研究其他条件不变时,不同醇烯比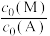 (甲醇
(甲醇 与烯烃
与烯烃 的起始物质的量浓度之比)对平衡的影响,当
的起始物质的量浓度之比)对平衡的影响,当 起始浓度
起始浓度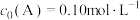 时,测得平衡时
时,测得平衡时 和
和 的
的 随
随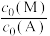 的变化曲线如图。
的变化曲线如图。
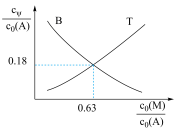
①曲线 呈现如图所示变化的原因是
呈现如图所示变化的原因是_______ 。
②当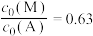 时,计算反应I的平衡常数
时,计算反应I的平衡常数_______ (写出计算过程)。
 (TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇
(TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇 (简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应(
(简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应( 为2-甲基-1-丁烯的简写,不考虑其他副反应):
为2-甲基-1-丁烯的简写,不考虑其他副反应):反应
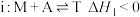
反应ii:
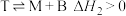
反应iii:

(1)磷钼酸
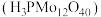 可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第VIB族,核外电子排布与
可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第VIB族,核外电子排布与 相似。
相似。①基态钼原子的价层电子排布式为
②完成化学方程式:
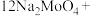

(2)比较

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)我国学者团队对制备TAME反应的催化剂进行了研究。研究衣明:用不同浓度(13%)的磷钼酸浸渍催化剂,浓度越大催化剂催化活性越好。用浓度分别为
 的磷钼酸浸渍催化剂进行了三组实验,得到
的磷钼酸浸渍催化剂进行了三组实验,得到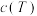 随时间
随时间 的变化曲线如图所示。
的变化曲线如图所示。
①用
 的磷钼酸浸渍时,在
的磷钼酸浸渍时,在 内,
内, 的平均生成速率为
的平均生成速率为②下列仿关说法正确的有
A.三组实验中,反应速率都随反应进程一直增大
B.平衡后加入惰性溶剂四氢呋喃稀释,
 减小
减小C.催化剂可加快化学反应速率,提高甲醇的平衡转化率
D.降低温度,反应
 和ii的正、逆反应速率都减小
和ii的正、逆反应速率都减小E.达到平衡后,加入
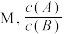 不变
不变(4)研究团队继续研究其他条件不变时,不同醇烯比
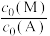 (甲醇
(甲醇 与烯烃
与烯烃 的起始物质的量浓度之比)对平衡的影响,当
的起始物质的量浓度之比)对平衡的影响,当 起始浓度
起始浓度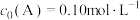 时,测得平衡时
时,测得平衡时 和
和 的
的 随
随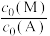 的变化曲线如图。
的变化曲线如图。
①曲线
 呈现如图所示变化的原因是
呈现如图所示变化的原因是②当
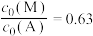 时,计算反应I的平衡常数
时,计算反应I的平衡常数
您最近一年使用:0次
2024-03-31更新
|
528次组卷
|
2卷引用:广东省广州市第六十五中学2023-2024学年高三下学期期初综合训练化学试题
名校
解题方法
9 . 回答下列问题。
(1)Fujta等学者开展了在Cu催化剂上进行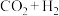 合成甲醇机理的研究。机理如下:
合成甲醇机理的研究。机理如下:___________ 。
(2)科学家设计了一种新的 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如下:
的难储存问题,装置如下:___________ 。
②b电极上的电极反应式为___________ ,如果将电解质溶液换为KOH溶液,对合成甲醇造成的不良后果是___________ 。
(3)常温下,向NaOH溶液中逐渐通入 气体,溶液中由水电离的
气体,溶液中由水电离的 随着
随着 通入体积的变化曲线如图所示:
通入体积的变化曲线如图所示:___________ 。
②比较pH:b___________ d(填“>”“<”或“=”)。
③向a、b、c、d四点溶液中加入少量等质量的 固体后,溶液漂白性最强的点是
固体后,溶液漂白性最强的点是___________ 。
(4)向含有 、
、 、
、 、
、 四种离子的溶液中加入少量
四种离子的溶液中加入少量 固体后,这四种离子中离子数目肯定增加的是
固体后,这四种离子中离子数目肯定增加的是___________ 。
(1)Fujta等学者开展了在Cu催化剂上进行
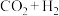 合成甲醇机理的研究。机理如下:
合成甲醇机理的研究。机理如下: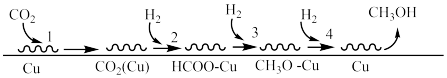
(2)科学家设计了一种新的
 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如下:
的难储存问题,装置如下: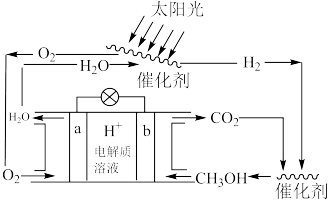
②b电极上的电极反应式为
(3)常温下,向NaOH溶液中逐渐通入
 气体,溶液中由水电离的
气体,溶液中由水电离的 随着
随着 通入体积的变化曲线如图所示:
通入体积的变化曲线如图所示:
②比较pH:b
③向a、b、c、d四点溶液中加入少量等质量的
 固体后,溶液漂白性最强的点是
固体后,溶液漂白性最强的点是(4)向含有
 、
、 、
、 、
、 四种离子的溶液中加入少量
四种离子的溶液中加入少量 固体后,这四种离子中离子数目肯定增加的是
固体后,这四种离子中离子数目肯定增加的是
您最近一年使用:0次
10 . 某小组探究SO2在盐酸中分别与铜单质和铜离子的反应,从电极反应角度分析物质氧化性和还原性的变化规律。
I.探究SO2在盐酸中与Cu2+的反应
用如下装置(夹持、加热仪器略)制备SO2,将SO2通入0.6 mol·L-1 CuSO4溶液。通SO2一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入SO2,C中溶液变棕黄色。
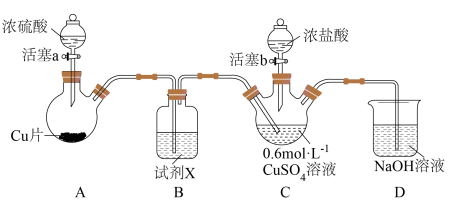
(1)装置A中反应的化学方程式为___________ ,B中试剂X是___________ 。
(2)资料:CuCl难溶于水,在水溶液中存在平衡:CuCl(白色)+2Cl- [CuCl3]2-。补充实验证实了棕黄色溶液中含[CuCl3]2-,实验方案为
[CuCl3]2-。补充实验证实了棕黄色溶液中含[CuCl3]2-,实验方案为___________ 。
(3)SO2与CuSO4溶液反应生成SO 和Cu+的电极反应式为:
和Cu+的电极反应式为:
氧化反应:___________ ;
还原反应:Cu2++e-=Cu+。
根据电极反应式,分析加入浓盐酸前后实验现象有差异的可能原因___________ 。
(4)综上分析,SO2在盐酸中与Cu2+反应生成[CuCl3]2-的离子方程式为___________ 。
Ⅱ.探究SO2在盐酸中与Cu单质的反应
将装置C中CuSO4溶液替换成Cu片和Na2SO4溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
(5)经检验黑色固体是Cu2S,SO2在盐酸中与Cu单质反应的离子方程式为___________ 。
(6)为了进一步探究影响铜单质还原性的因素,进行了如下实验:
实验ii中,Cu片附近溶液变棕黄色。b是___________ 。
综合上述实验可知,还原反应中,降低生成物浓度,氧化剂的氧化性增强;氧化反应中,降低生成物浓度,还原剂的还原性增强。
I.探究SO2在盐酸中与Cu2+的反应
用如下装置(夹持、加热仪器略)制备SO2,将SO2通入0.6 mol·L-1 CuSO4溶液。通SO2一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入SO2,C中溶液变棕黄色。

(1)装置A中反应的化学方程式为
(2)资料:CuCl难溶于水,在水溶液中存在平衡:CuCl(白色)+2Cl-
 [CuCl3]2-。补充实验证实了棕黄色溶液中含[CuCl3]2-,实验方案为
[CuCl3]2-。补充实验证实了棕黄色溶液中含[CuCl3]2-,实验方案为(3)SO2与CuSO4溶液反应生成SO
 和Cu+的电极反应式为:
和Cu+的电极反应式为:氧化反应:
还原反应:Cu2++e-=Cu+。
根据电极反应式,分析加入浓盐酸前后实验现象有差异的可能原因
(4)综上分析,SO2在盐酸中与Cu2+反应生成[CuCl3]2-的离子方程式为
Ⅱ.探究SO2在盐酸中与Cu单质的反应
将装置C中CuSO4溶液替换成Cu片和Na2SO4溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
(5)经检验黑色固体是Cu2S,SO2在盐酸中与Cu单质反应的离子方程式为
(6)为了进一步探究影响铜单质还原性的因素,进行了如下实验:
| 序号 | 实验装置图 | 试剂Y | 电压表 |
| i | 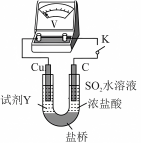 | H2SO4溶液 | 指针几乎不偏转 |
| ii | a | 指针明显偏转 | |
| iii | a+b | 指针偏转幅度更大 |
综合上述实验可知,还原反应中,降低生成物浓度,氧化剂的氧化性增强;氧化反应中,降低生成物浓度,还原剂的还原性增强。
您最近一年使用:0次
2024-03-21更新
|
579次组卷
|
4卷引用:北京市中国人民大学附属中学2023-2024学年高三下学期开学考试化学试题



