解题方法
1 . 非洛地平具有扩张动脉、降低血压的作用,可用于治疗高血压。一种合成路线如下: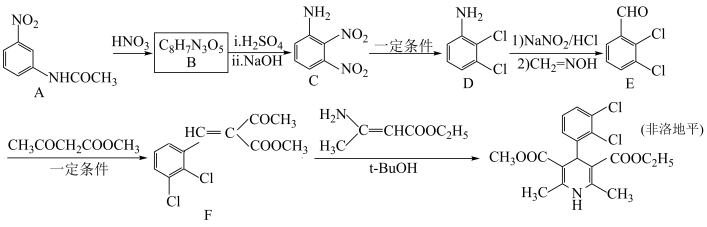
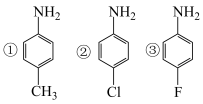
(1)已知氨基的N原子上电子云密度越大,碱性越强;卤素为吸电子基,甲基为推电子基。下列有机物碱性由强到弱排序为
(3)非洛地平中含氧官能团是
(4)E→F的化学方程式为
(5)在A的芳香族同分异构体中,同时含
 、-CHO、-OOCH结构的有
、-CHO、-OOCH结构的有(6)以苯甲醇和
 为原料合成
为原料合成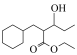 ,设计合成路线
,设计合成路线
您最近一年使用:0次
7日内更新
|
115次组卷
|
3卷引用:2024届河南省百所名校仿真模拟大联考三模考试理综试题-高中化学
名校
2 . 工业上用 处理氨氮水的原理如图所示。
处理氨氮水的原理如图所示。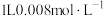 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(
混合,测得溶液中氨去除率、总氮( 和
和 的总和)残余率与
的总和)残余率与 投入量(用x表示)的关系如图所示。下列说法错误的是
投入量(用x表示)的关系如图所示。下列说法错误的是
 处理氨氮水的原理如图所示。
处理氨氮水的原理如图所示。
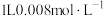 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(
混合,测得溶液中氨去除率、总氮( 和
和 的总和)残余率与
的总和)残余率与 投入量(用x表示)的关系如图所示。下列说法错误的是
投入量(用x表示)的关系如图所示。下列说法错误的是
A.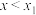 时, 时, 主要被氧化为 主要被氧化为 |
B.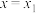 时,生成的 时,生成的 的物质的量为 的物质的量为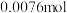 |
C.生成硝氮的离子方程式: |
D. 时,分批加入 时,分批加入 可以降低总氮残余率 可以降低总氮残余率 |
您最近一年使用:0次
真题
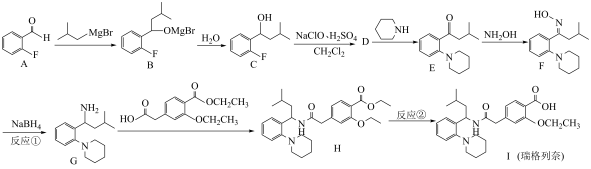
3 . 瑞格列奈的制备。_______ 。
(2)反应①的反应类型为_______。
(3)反应②的试剂和条件是_______ 。
(4)D的分子式是 ,画出D的结构简式
,画出D的结构简式_______ 。
(5)化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式_______ 。
i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为 。
。
(6)G对映异构体分离后才能发生下一步反应
①G中有_______ 个手性碳 D.
D. 
(7)用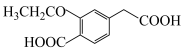 与G可直接制取H。但产率变低,请分析原因
与G可直接制取H。但产率变低,请分析原因_______ 。
(8)以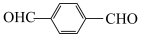 和
和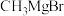 合成
合成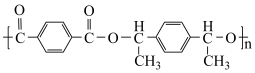
_______ 。
(2)反应①的反应类型为_______。
| A.还原反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(3)反应②的试剂和条件是
(4)D的分子式是
 ,画出D的结构简式
,画出D的结构简式(5)化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式
i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为
 。
。(6)G对映异构体分离后才能发生下一步反应
①G中有
②已知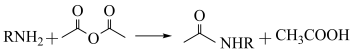 ,用
,用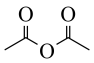 和谷氨酸可制备
和谷氨酸可制备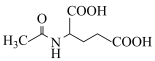 ,该物质可用于分离对映异构体。谷氨酸的结构简式为:
,该物质可用于分离对映异构体。谷氨酸的结构简式为:
 D.
D. 
(7)用
 与G可直接制取H。但产率变低,请分析原因
与G可直接制取H。但产率变低,请分析原因(8)以
 和
和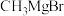 合成
合成
您最近一年使用:0次
4 . 金属镍及其化合物在工业、科研等领域应用广泛。回答下列问题:
(1)基态Ni²⁺的价层电子轨道表示式为___________ ,与Ni同周期且基态原子未成对电子数相同的有___________ (填元素符号)。
(2)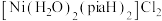 是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中
是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中 的配位数为
的配位数为___________ ,在配合物中,两个“piaH”与 分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是
分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是___________ (用“α”“β”“γ”表示)。 被氧化为
被氧化为 ,成为
,成为 。已知
。已知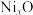 的摩尔质量为69.1 g⋅mol
的摩尔质量为69.1 g⋅mol ,则标明Ni价态的化学式为
,则标明Ni价态的化学式为___________ (示例: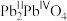 ),
),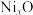 晶体中镍离子的占有率为
晶体中镍离子的占有率为___________ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。NiAs晶体结构如图甲所示,其晶胞俯视图如图乙所示。A点原子的分数坐标为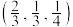 ,则B点原子的分数坐标为
,则B点原子的分数坐标为___________ ,A、B两点间距离为___________ pm。
(1)基态Ni²⁺的价层电子轨道表示式为
(2)
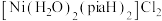 是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中
是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中 的配位数为
的配位数为 分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是
分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是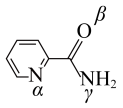
 被氧化为
被氧化为 ,成为
,成为 。已知
。已知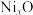 的摩尔质量为69.1 g⋅mol
的摩尔质量为69.1 g⋅mol ,则标明Ni价态的化学式为
,则标明Ni价态的化学式为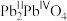 ),
),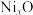 晶体中镍离子的占有率为
晶体中镍离子的占有率为(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。NiAs晶体结构如图甲所示,其晶胞俯视图如图乙所示。A点原子的分数坐标为
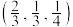 ,则B点原子的分数坐标为
,则B点原子的分数坐标为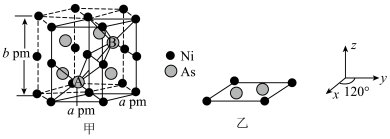
您最近一年使用:0次
名校
5 . 高纯MgO具有优良的电绝缘性、高导热性等,常被用作绝缘材料填料、高温耐热材料。由白云石[主要成分为 ,含少量
,含少量 、
、 、
、 等杂质]制备高纯MgO和副产品
等杂质]制备高纯MgO和副产品 的一种流程如下:
的一种流程如下:
(1)请写出基态Ca原子的价电子排布式___________ 。
(2)步骤“煅烧1”中, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)“铵浸”时,含钙化合物被浸取,含镁化合物部分水化生成 (
(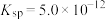 )。若铵浸液中
)。若铵浸液中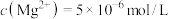 ,则其pH=
,则其pH=___________ ;滤饼“水化反应”后,将体系冷却到与铵浸液相同温度,得到主要含有 的悬浊液,其中
的悬浊液,其中
___________ 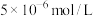 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(4)“沉钙”时主要发生反应的离子方程式为___________ 。
(5)“碳化反应”时,镁化合物转化为可溶于水的___________ (填化学式,下同),滤渣的主要成分为___________ 。
(6)“热解”时生成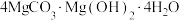 (碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
(碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质]制备高纯MgO和副产品
等杂质]制备高纯MgO和副产品 的一种流程如下:
的一种流程如下: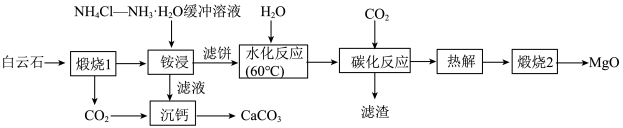
(1)请写出基态Ca原子的价电子排布式
(2)步骤“煅烧1”中,
 发生反应的化学方程式为
发生反应的化学方程式为(3)“铵浸”时,含钙化合物被浸取,含镁化合物部分水化生成
 (
(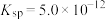 )。若铵浸液中
)。若铵浸液中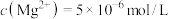 ,则其pH=
,则其pH= 的悬浊液,其中
的悬浊液,其中
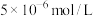 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(4)“沉钙”时主要发生反应的离子方程式为
(5)“碳化反应”时,镁化合物转化为可溶于水的
(6)“热解”时生成
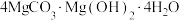 (碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
(碱式碳酸铁)沉淀,煅烧碱式碳酸镁比煅烧氢氧化镁所得MgO活性更强,平均粒径更小,比表面积更大,可能的原因是
您最近一年使用:0次
名校
解题方法
6 . 用磷铁渣(含Fe、FeP、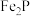 及少量杂质)制备磷酸铁晶体(
及少量杂质)制备磷酸铁晶体( )的工艺流程如下:
)的工艺流程如下:___________ 。
(2)“浸取”时,硝酸浓度过高会较多分解,化学方程式是___________ 。
(3)废气中含有 、NO,直接排放产生的危害主要有
、NO,直接排放产生的危害主要有___________ (写出两项),加入活性炭的目的是吸附氮氧化物;若用NaOH溶液吸收,物质的量比为 的
的 、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为
、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为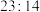 ,其化学式是
,其化学式是___________ 。
(4)若HNO₃的还原产物为NO,与1molFe2P完全反应而生成的NO有___________ mol。
(5)实验室完成操作X中用到的玻璃仪器有:烧杯、___________ 。
(6)“调pH”时,碱性过高产物中含铁量会增大,其原因有可能为___________ 。
(7)最终产品应洗涤,检验是否洗净的试剂是___________ 。
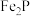 及少量杂质)制备磷酸铁晶体(
及少量杂质)制备磷酸铁晶体( )的工艺流程如下:
)的工艺流程如下:
(2)“浸取”时,硝酸浓度过高会较多分解,化学方程式是
(3)废气中含有
 、NO,直接排放产生的危害主要有
、NO,直接排放产生的危害主要有 的
的 、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为
、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为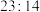 ,其化学式是
,其化学式是(4)若HNO₃的还原产物为NO,与1molFe2P完全反应而生成的NO有
(5)实验室完成操作X中用到的玻璃仪器有:烧杯、
(6)“调pH”时,碱性过高产物中含铁量会增大,其原因有可能为
(7)最终产品应洗涤,检验是否洗净的试剂是
您最近一年使用:0次
真题
解题方法
7 . 氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可通过氯化反应制备。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下: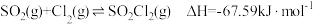 。
。
①若正反应的活化能为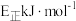 ,则逆反应的活化能
,则逆反应的活化能
_______  (用含
(用含 正的代数式表示)。
正的代数式表示)。
②恒容密闭容器中按不同进料比充入 和其
和其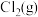 ,测定
,测定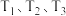 温度下体系达平衡时的
温度下体系达平衡时的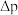 (
(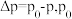 为体系初始压强,
为体系初始压强,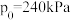 ,P为体系平衡压强),结果如图。
,P为体系平衡压强),结果如图。_______ ,判断依据为_______ 。M点 的转化率为
的转化率为_______ , 温度下用分压表示的平衡常数
温度下用分压表示的平衡常数
_______  。
。
③下图曲线中能准确表示 温度下
温度下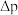 随进料比变化的是
随进料比变化的是_______ (填序号)。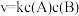 ,其中
,其中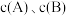 分别为各反应中对应反应物的浓度,k为速率常数(
分别为各反应中对应反应物的浓度,k为速率常数(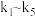 分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,
分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,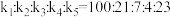 。
。
① 时,
时,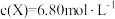 ,且
,且 内
内 ,反应进行到
,反应进行到 时,
时,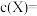
_______  。
。
② 时,
时,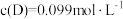 ,若
,若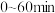 产物T的含量可忽略不计,则此时
产物T的含量可忽略不计,则此时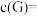
_______ 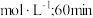 后,随T的含量增加,
后,随T的含量增加,
_______ (填“增大”“减小”或“不变”)。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
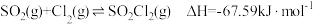 。
。①若正反应的活化能为
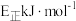 ,则逆反应的活化能
,则逆反应的活化能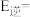
 (用含
(用含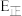 正的代数式表示)。
正的代数式表示)。②恒容密闭容器中按不同进料比充入
 和其
和其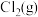 ,测定
,测定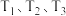 温度下体系达平衡时的
温度下体系达平衡时的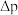 (
(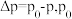 为体系初始压强,
为体系初始压强,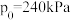 ,P为体系平衡压强),结果如图。
,P为体系平衡压强),结果如图。
 的转化率为
的转化率为 温度下用分压表示的平衡常数
温度下用分压表示的平衡常数
 。
。③下图曲线中能准确表示
 温度下
温度下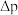 随进料比变化的是
随进料比变化的是

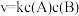 ,其中
,其中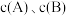 分别为各反应中对应反应物的浓度,k为速率常数(
分别为各反应中对应反应物的浓度,k为速率常数(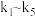 分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,
分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,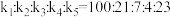 。
。①
 时,
时,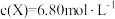 ,且
,且 内
内 ,反应进行到
,反应进行到 时,
时,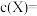
 。
。②
 时,
时,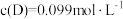 ,若
,若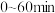 产物T的含量可忽略不计,则此时
产物T的含量可忽略不计,则此时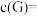
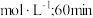 后,随T的含量增加,
后,随T的含量增加,
您最近一年使用:0次
8 . 硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施_______ (写出一条,合理即可)。
(2)滤渣1经过处理可作为制备水玻璃( 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式_______ 。
(3)加入试剂除铁前,滤液1中的阳离子除了 、
、 外还有的阳离子是
外还有的阳离子是_______ (填离子符号)。滤渣2主要成分为 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理_______ 。
(4)向滤液1中加入的试剂可以是 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因_______ 。
(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于_______ (保留小数点一位)。
(6)某兴趣小组为了测定晶体中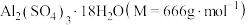 的质量分数,进行如下实验:
的质量分数,进行如下实验:
①准确称取1.00g晶体样品,溶于一定量水中;
②滴入 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。
则晶体中 的质量分数是
的质量分数是_______ 。
 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施
(2)滤渣1经过处理可作为制备水玻璃(
 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式(3)加入试剂除铁前,滤液1中的阳离子除了
 、
、 外还有的阳离子是
外还有的阳离子是 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理(4)向滤液1中加入的试剂可以是
 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于
(6)某兴趣小组为了测定晶体中
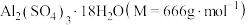 的质量分数,进行如下实验:
的质量分数,进行如下实验:①准确称取1.00g晶体样品,溶于一定量水中;
②滴入
 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。则晶体中
 的质量分数是
的质量分数是
您最近一年使用:0次
名校
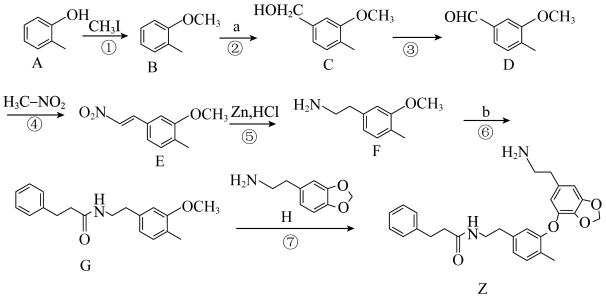
9 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(Ⅰ)的一种合成路线如下:
(1)化合物A的名称为___________ ,碳原子的杂化方式为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物a的一种用途___________ 。
(3)化合物C中含有的官能团名称为___________ ,请写出C转化为D的化学方程式___________ ,反应类型为___________ 。
(4)b能与碳酸氢钠溶液反应生成气体。芳香化合物X为b的同分异构体,能发生水解反应又能发生银镜反应,核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1,X的结构简式为___________ (写出一种)。
(5)参照上述路线,以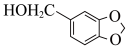 与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图_______ 。
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物a的一种用途
(3)化合物C中含有的官能团名称为
(4)b能与碳酸氢钠溶液反应生成气体。芳香化合物X为b的同分异构体,能发生水解反应又能发生银镜反应,核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1,X的结构简式为
(5)参照上述路线,以
 与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
与流程中某些试剂为原料(其他无机试剂任选),合成流程中的H,请写出合成路线图
您最近一年使用:0次
10 . 能源是制约国家发展进程的因素之一。二甲醚等被称为21世纪的绿色能源,工业上制备二甲醚原理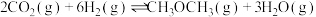 ,分别用Ir、Ce作催化剂,进行相同的时间后,测得的
,分别用Ir、Ce作催化剂,进行相同的时间后,测得的 的转化率
的转化率 随反应温度的变化情况如图所示。下列说法不正确的是
随反应温度的变化情况如图所示。下列说法不正确的是
 ,分别用Ir、Ce作催化剂,进行相同的时间后,测得的
,分别用Ir、Ce作催化剂,进行相同的时间后,测得的 的转化率
的转化率 随反应温度的变化情况如图所示。下列说法不正确的是
随反应温度的变化情况如图所示。下列说法不正确的是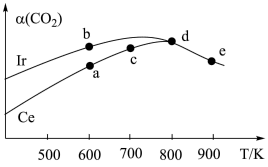
A.已知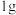 二甲醚气体完全燃烧生成稳定的氧化物放出的热量为 二甲醚气体完全燃烧生成稳定的氧化物放出的热量为 ,二甲醚燃烧热的热化学方程式 ,二甲醚燃烧热的热化学方程式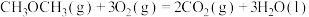 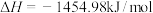 |
| B.二甲醚碱性燃料电池与乙醇碱性燃料电池,两种燃料所含共价键类型不同,断键时所需能量不同 |
C.反应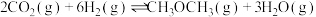 的 的 , ,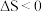 |
D.分别用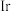 、 、 作催化剂时, 作催化剂时,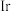 活化能降低更多 活化能降低更多 |
您最近一年使用:0次



