1 . 室温下用 溶液吸收
溶液吸收 的一种脱硫工艺流程如下图所示。
的一种脱硫工艺流程如下图所示。

(1)流程中各种离子相关的大小或数学关系如下,回答下列问题:
a. 溶液中,c(OH—)
溶液中,c(OH—)___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
b.当“①吸收”后的吸收液中 时,pH=
时,pH=___________ (填整数)。(已知:
 ,
, )
)
c.“②沉淀”分离后的滤液中,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)写出“②沉淀”发生主要反应的离子方程式___________ 。(已知:

 、
、
 )
)
(3)写出“③氧化”中生成石膏(
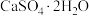 )的化学方程式
)的化学方程式___________ 。
(4)“①吸收”后的溶液为
 和
和
 混合物,可以用下图所示的电解法进行再生,获得较纯净的
混合物,可以用下图所示的电解法进行再生,获得较纯净的
 ,从而循环利用。
,从而循环利用。

在阴极室,再生过程分为两步,分别写出离子方程式:
电极反应:___________ 。
后续反应:___________ 。
(5)焦亚硫酸钠(
 ),其在医药、橡胶、印染、食品等方面应用广泛,可通过
),其在医药、橡胶、印染、食品等方面应用广泛,可通过
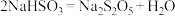 原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的
原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的
 和
和
 混合物分离。
混合物分离。

电解后,___________ 室(填“a或b”)的 浓度增加,从而循环利用,另一个室的
浓度增加,从而循环利用,另一个室的 浓度增加,将该室溶液进行脱水可得到
浓度增加,将该室溶液进行脱水可得到 。
。
 溶液吸收
溶液吸收 的一种脱硫工艺流程如下图所示。
的一种脱硫工艺流程如下图所示。
(1)流程中各种离子相关的大小或数学关系如下,回答下列问题:
a.
 溶液中,c(OH—)
溶液中,c(OH—) (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。b.当“①吸收”后的吸收液中
 时,pH=
时,pH=
 ,
, )
)c.“②沉淀”分离后的滤液中,

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)写出“②沉淀”发生主要反应的离子方程式

 、
、 )
)(3)写出“③氧化”中生成石膏(
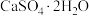 )的化学方程式
)的化学方程式(4)“①吸收”后的溶液为
 和
和 混合物,可以用下图所示的电解法进行再生,获得较纯净的
混合物,可以用下图所示的电解法进行再生,获得较纯净的 ,从而循环利用。
,从而循环利用。
在阴极室,再生过程分为两步,分别写出离子方程式:
电极反应:
后续反应:
(5)焦亚硫酸钠(
 ),其在医药、橡胶、印染、食品等方面应用广泛,可通过
),其在医药、橡胶、印染、食品等方面应用广泛,可通过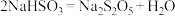 原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的
原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的 和
和 混合物分离。
混合物分离。
电解后,
 浓度增加,从而循环利用,另一个室的
浓度增加,从而循环利用,另一个室的 浓度增加,将该室溶液进行脱水可得到
浓度增加,将该室溶液进行脱水可得到 。
。
您最近一年使用:0次
名校
解题方法
2 . 废旧磷酸铁锂( )电池的正极材料中主要含有
)电池的正极材料中主要含有 、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂(
、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂( ),以实现资源的回收利用。
),以实现资源的回收利用。

已知:25℃时,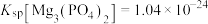 ,
,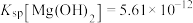 。
。
回答下列问题:
(1)为了提高废料的浸出效果,可采取的措施是_______ (回答一项即可)。
(2)已知滤渣①中含 ,“浸出”过程中有
,“浸出”过程中有 生成,则“浸出”时发生的主要反应的离子方程式为
生成,则“浸出”时发生的主要反应的离子方程式为_______ 。工业生产中选择 而不用双氧水的优点是
而不用双氧水的优点是_______ 。
(3)滤液①中仍有少量的 ,则“除磷”时发生反应的化学方程式为
,则“除磷”时发生反应的化学方程式为_______ 。
(4)“除铁铝”中须控制溶液的pH<8.8,滤渣③的主要成分是_______ (填化学式)。若省略该过程会导致_______ 。
(5)“沉锂”后可水洗除去 表面的杂质,得到纯度较高的
表面的杂质,得到纯度较高的 ,判断
,判断 洗净的方法是
洗净的方法是_______ 。
 )电池的正极材料中主要含有
)电池的正极材料中主要含有 、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂(
、Al、石墨以及少量难溶性的杂质,为了减少环境污染、缓解资源短缺,通过下图流程制备碳酸锂( ),以实现资源的回收利用。
),以实现资源的回收利用。
已知:25℃时,
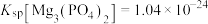 ,
,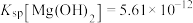 。
。回答下列问题:
(1)为了提高废料的浸出效果,可采取的措施是
(2)已知滤渣①中含
 ,“浸出”过程中有
,“浸出”过程中有 生成,则“浸出”时发生的主要反应的离子方程式为
生成,则“浸出”时发生的主要反应的离子方程式为 而不用双氧水的优点是
而不用双氧水的优点是(3)滤液①中仍有少量的
 ,则“除磷”时发生反应的化学方程式为
,则“除磷”时发生反应的化学方程式为(4)“除铁铝”中须控制溶液的pH<8.8,滤渣③的主要成分是
(5)“沉锂”后可水洗除去
 表面的杂质,得到纯度较高的
表面的杂质,得到纯度较高的 ,判断
,判断 洗净的方法是
洗净的方法是
您最近一年使用:0次
2023-10-30更新
|
496次组卷
|
4卷引用:湖北省百校联盟2023-2024学年高三上学期10月联考化学试题
3 . 湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4,还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、Al3+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下图:
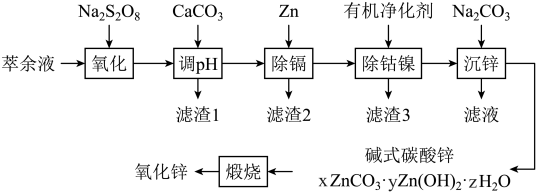
已知:25℃时,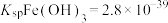 ,
, 。
。
回答下列问题:
(1)“氧化”时,所用氧化剂Na2S2O8阴离子结构为“ ”,则其中硫元素化合价为
”,则其中硫元素化合价为___________ ,其氧化Fe2+的离子方程式为___________ ,其阴离子结构片段“ ”中的所有原子
”中的所有原子___________ (填“是”或“不是”)在一条直线上。
(2)“调pH”时,为了加快反应速率,不宜采取的措施为___________
a.将CaCO3粉碎研细 b.不断搅拌 c.适当降低温度
所得“滤渣I”中除含有MnO2、CaSO4和Al(OH)3,还含有___________ 。
(3)“除钴镍”时,有机净化剂的基本组分为大分子聚合物,其净化原理可表示为
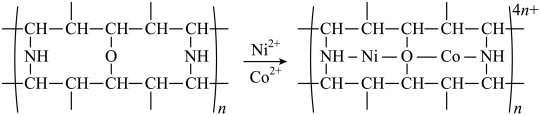
该有机大分子聚合物属于___________ (填“线型”或“网状”)结构。净化反应中,提供孤电子对的原子为___________ (填元素符号)。
(4)“沉锌”时,得到的碱式碳酸锌[xZnCO3·yZn(OH)2·zH2O]摩尔质量为341g/mol。取51.15g碱式碳酸锌固体进行充分煅烧,将产生的气体全部通入到足量Ba(OH)2溶液中,所得沉淀经过滤、洗涤、干燥后称量,其质量为29.55g;碱式碳酸锌煅烧后的固体纯净物质量为36.45g,则x∶y∶z=___________ 。已知“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为___________ 。

已知:25℃时,
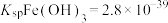 ,
, 。
。回答下列问题:
(1)“氧化”时,所用氧化剂Na2S2O8阴离子结构为“
 ”,则其中硫元素化合价为
”,则其中硫元素化合价为 ”中的所有原子
”中的所有原子(2)“调pH”时,为了加快反应速率,不宜采取的措施为
a.将CaCO3粉碎研细 b.不断搅拌 c.适当降低温度
所得“滤渣I”中除含有MnO2、CaSO4和Al(OH)3,还含有
(3)“除钴镍”时,有机净化剂的基本组分为大分子聚合物,其净化原理可表示为

该有机大分子聚合物属于
(4)“沉锌”时,得到的碱式碳酸锌[xZnCO3·yZn(OH)2·zH2O]摩尔质量为341g/mol。取51.15g碱式碳酸锌固体进行充分煅烧,将产生的气体全部通入到足量Ba(OH)2溶液中,所得沉淀经过滤、洗涤、干燥后称量,其质量为29.55g;碱式碳酸锌煅烧后的固体纯净物质量为36.45g,则x∶y∶z=
您最近一年使用:0次
解题方法
4 . 下列实验现象及得出的结论均正确的是
| 选项 | 实验现象 | 结论 |
| A | 等浓度的 溶液的pH比NaF溶液的小 溶液的pH比NaF溶液的小 |  |
| B | 向漂白粉中滴入醋酸,产生黄绿色气体 | 醋酸具有还原性 |
| C | 向酸化的 溶液中加入过量的稀 溶液中加入过量的稀 ,溶液变黄,再加入淀粉KI溶液,溶液变蓝 ,溶液变黄,再加入淀粉KI溶液,溶液变蓝 | 氧化性: |
| D | 向两支试管中分别加入 溶液,分别滴入相同浓度相同体积的NaCl和KI,只有后者有沉淀 溶液,分别滴入相同浓度相同体积的NaCl和KI,只有后者有沉淀 | 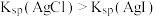 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 以湿法炼锌厂所产的钴锰渣(主要成分为 Co2O3、CoO、NiO、MnO2,含少量 Fe2O3、ZnO、CuO、CaO 等)为原料回收制备 CoC2O4 的工艺如下:

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体_______ ,说出该气体的一种用途_______ 。
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为_______ 。
(3)试分析Cu2+主要以_______ [填“CuS”或“Cu(OH)2”]形式除去。
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为_______ mol (用含 a、b 的式子表示)。
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。
①直接用于分离钴镍的萃取剂是_______ 。
②指出分离钴镍的合适pH范围为_______ (填标号)。
A.3~4 B.4~5 C.5~6 D.6~7

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为
(3)试分析Cu2+主要以
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。

①直接用于分离钴镍的萃取剂是
②指出分离钴镍的合适pH范围为
A.3~4 B.4~5 C.5~6 D.6~7
您最近一年使用:0次
解题方法
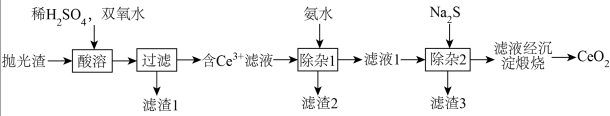
6 . 稀土抛光粉 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
已知:25℃时, ,
,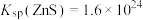 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
(1)“酸溶”时,需控制80℃水浴加热,若温度过高浸出率降低的原因是_____ 。 发生反应的离子方程式为
发生反应的离子方程式为_____ 。
(2)“滤渣1”的主要成分为_____ 。
(3)“除杂1”中,加入氨水控制 范围为
范围为_____ ,溶液中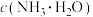
_____  (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为_____ 。
(4) 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为_____ ,晶胞密度为_____  。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
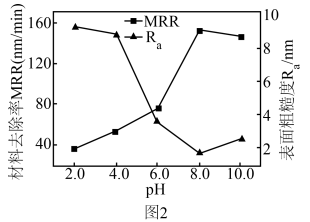
(5)纳米 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为_____ ,在较低 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为_____ 。
 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
已知:25℃时,
 ,
,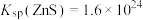 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:| 金属氢氧化物 |  |  |  | 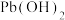 |  |
开始沉淀的 | 2.3 | 3.5 | 6.4 | 7.2 | 6.2 |
完全沉淀的 | 3.2 | 4.6 | 9.0 | 9.1 | 8.2 |
 发生反应的离子方程式为
发生反应的离子方程式为(2)“滤渣1”的主要成分为
(3)“除杂1”中,加入氨水控制
 范围为
范围为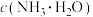
 (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为(4)
 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为 。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
) 
(5)纳米
 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为
您最近一年使用:0次
名校
解题方法
7 . 氧化镍( 和
和 )是制备二次电池的重要材料,实验室以粗镍板(单质
)是制备二次电池的重要材料,实验室以粗镍板(单质 ,含少量
,含少量 ,
, 杂质)为原料模拟工业制备氧化镍的流程如图所示:
杂质)为原料模拟工业制备氧化镍的流程如图所示:

相关数据如下:
回答下列问题:
(1)粗镍粉碎的作用是_______ 。
(2)溶浸时有 生成,单质镍生成
生成,单质镍生成 发生的离子反应方程式为
发生的离子反应方程式为_______ 。
(3)用氨水调节 约为5除去
约为5除去_______ ,充分反应后需加热煮沸后过滤,加热的目的是_______ 。
(4)加入饱和 溶液前需先调节
溶液前需先调节 至4.0左右,原因是
至4.0左右,原因是_______ ;滤渣2主要成分为_______ 。
(5)滤液2可以返回_______ 工序继续使用, 热分解为
热分解为 的方程式为
的方程式为_______ ;
 和
和 )是制备二次电池的重要材料,实验室以粗镍板(单质
)是制备二次电池的重要材料,实验室以粗镍板(单质 ,含少量
,含少量 ,
, 杂质)为原料模拟工业制备氧化镍的流程如图所示:
杂质)为原料模拟工业制备氧化镍的流程如图所示:
相关数据如下:
| 难溶电解质或离子 |  |  |  |  |  |
 或沉淀完全的 或沉淀完全的 | 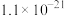 | 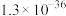 |  |  |  |
(1)粗镍粉碎的作用是
(2)溶浸时有
 生成,单质镍生成
生成,单质镍生成 发生的离子反应方程式为
发生的离子反应方程式为(3)用氨水调节
 约为5除去
约为5除去(4)加入饱和
 溶液前需先调节
溶液前需先调节 至4.0左右,原因是
至4.0左右,原因是(5)滤液2可以返回
 热分解为
热分解为 的方程式为
的方程式为
您最近一年使用:0次
8 . 25℃时,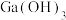 、
、 和
和 的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示
的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示 、
、 和
和 的浓度负对数(
的浓度负对数(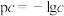 ),pOH表示
),pOH表示 的浓度负对数[
的浓度负对数[ ]。已知:离子浓度小于
]。已知:离子浓度小于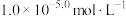 时沉淀完全;
时沉淀完全;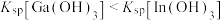 。下列说法正确的是
。下列说法正确的是

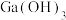 、
、 和
和 的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示
的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示 、
、 和
和 的浓度负对数(
的浓度负对数(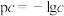 ),pOH表示
),pOH表示 的浓度负对数[
的浓度负对数[ ]。已知:离子浓度小于
]。已知:离子浓度小于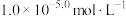 时沉淀完全;
时沉淀完全;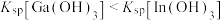 。下列说法正确的是
。下列说法正确的是
A.II线代表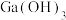 |
| B.I、II、III线段两两相交 |
C. 恰好完全沉淀时溶液的pOH为4.6 恰好完全沉淀时溶液的pOH为4.6 |
D.向 和 和 均为1 均为1 的混合液中滴加NaOH溶液, 的混合液中滴加NaOH溶液,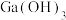 先沉淀 先沉淀 |
您最近一年使用:0次
名校
解题方法
9 . 活性氧化锌(ZnO)常用于医药、涂料、陶瓷等。某科研小组以锌废料(主要成分是ZnSO4和ZnO,含少量的Fe、Cu、Pb、As等元素以及油污)为原料制备活性氧化锌及回收其他金属元素,流程如图。

已知几种金属离子生成氢氧化物的 如下表:
如下表:
回答下列问题:
(1) 的原子结构示意图为
的原子结构示意图为 。
。 中铁的化合价为
中铁的化合价为_______ 。
(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是_______ 。
(3)a的范围为_______ 。“除铁”的离子方程式为_______ 。
(4)金属M的化学式为_______ 。
(5)①“活性炭”表现的性质是_______ (填字母)。
A.氧化性 B.还原性 C.吸附性
②“沉锌”的滤液采用_______ 、_______ ,过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
(6)“高温焙烧”过程中发生反应的化学方程式为_______ 。

已知几种金属离子生成氢氧化物的
 如下表:
如下表:| 金属离子 | 开始沉淀的 | 完全沉淀的 |
 | 1.5 | 3.7 |
 | 7.9 | 10.0 |
 | 6.3 | 9.7 |
 | 7.4 | 9.4 |
(1)
 的原子结构示意图为
的原子结构示意图为 。
。 中铁的化合价为
中铁的化合价为(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是
(3)a的范围为
(4)金属M的化学式为
(5)①“活性炭”表现的性质是
A.氧化性 B.还原性 C.吸附性
②“沉锌”的滤液采用
(6)“高温焙烧”过程中发生反应的化学方程式为
您最近一年使用:0次
2023-09-06更新
|
75次组卷
|
2卷引用:江西省赣州中学2023-2024学年高二上学期开学考试化学试题
10 . 常温下,某研究小组设计如下流程探究粗盐中的硫酸钠杂质的转化:
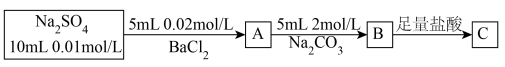
已知:溶液混合时体积变化忽略不计, ,
,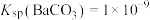 。下列说法
。下列说法不正确 的是

已知:溶液混合时体积变化忽略不计,
 ,
,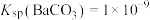 。下列说法
。下列说法| A.在A中有白色沉淀生成 |
B.在B溶液中: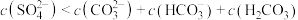 |
C.A→B的过程中 全部转化为 全部转化为 |
D.B→C的过程中 全部溶解,沉淀消失 全部溶解,沉淀消失 |
您最近一年使用:0次



