1 . 已知:Ksp(BaSO4)=1.1×10-10,Ksp(CaSO4)=4.9×10-5,若要除去粗盐溶液中的 ,下列说法中,
,下列说法中,不正确 的是
 ,下列说法中,
,下列说法中,| A.沉淀剂的选择要考虑阴离子的种类 |
B.钡盐除 比钙盐更好 比钙盐更好 |
C.为使 沉淀完全,沉淀剂应加至稍过量 沉淀完全,沉淀剂应加至稍过量 |
D.加入足够多沉淀剂后, 浓度可以降至0 浓度可以降至0 |
您最近一年使用:0次
2 . 下列事实与水解反应无关 的是
| A.常温下相同浓度溶液的pH大小:Na2S(aq)>(NH4)2S(aq) |
| B.纯碱溶液去除油污的能力强弱:热纯碱液>冷纯碱液 |
| C.除去工业废水中的Hg2+:向废水中加入FeS固体 |
| D.配制FeCl3溶液:将FeCl3固体溶于浓盐酸,再稀释至所需浓度 |
您最近一年使用:0次
2023-11-15更新
|
489次组卷
|
4卷引用:北京市朝阳区2023-2024学年高三上学期期中考试化学试题
3 . 利用平衡移动原理,分析一定温度下 在不同
在不同 的
的 体系中的可能产物。
体系中的可能产物。
已知:i.图1中曲线表示 体系中各含碳粒子的物质的量分数与
体系中各含碳粒子的物质的量分数与 的关系。
的关系。
ii.2中曲线Ⅰ的离子浓度关系符合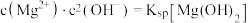 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合 [注:起始
[注:起始 ,不同
,不同 下
下 由图1得到]。
由图1得到]。
 在不同
在不同 的
的 体系中的可能产物。
体系中的可能产物。已知:i.图1中曲线表示
 体系中各含碳粒子的物质的量分数与
体系中各含碳粒子的物质的量分数与 的关系。
的关系。ii.2中曲线Ⅰ的离子浓度关系符合
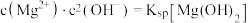 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合 [注:起始
[注:起始 ,不同
,不同 下
下 由图1得到]。
由图1得到]。
A.由图1, |
B.由图2,初始状态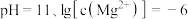 ,无沉淀生成 ,无沉淀生成 |
C.由图2,初始状态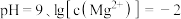 ,平衡后溶液中存在 ,平衡后溶液中存在 |
D.由图1和图2,初始状态 、 、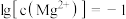 ,发生反应: ,发生反应: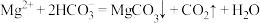 |
您最近一年使用:0次
2023-06-28更新
|
9461次组卷
|
28卷引用:2023年高考北京卷化学真题
2023年高考北京卷化学真题(已下线)2023年北京卷高考真题变式题(选择题11-14)北京市清华大学附属中学2023-2024学年高三上学期12月统练(六)化学试题北京市清华大学附属中学朝阳学校2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市铁路第二中学2023-2024学年高三上学期期中考试化学试题北京市第三中学2023-2024学年高二上学期期中练习化学试题北京市2023-2024学年北京三中高二(上)期中化学试卷 (已下线)北京市第四中学2023-2024学年高二上学期期末考试化学试题北京市海淀区教师进修学校附属实验学校2023-2024学年高二上学期12 月月考化学练习北京市中国人民大学附属中学2023-2024学年高三下学期一模模拟化学试题(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题江苏省常州市联盟学校2023-2024学年高三上学期10月学情调研化学试题(已下线)第32讲难溶电解质的溶解平衡(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)福建省厦门市 第一中学2023-2024上学期高三上学期12月考化学试题河北省石家庄二中实验学校2023-2024学年高二上学期12月月考化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)山东省滕州市第一中学2023-2024学年高二上学期12月月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省鸡西实验中学2023-2024学年高三上学期期末考试化学试题(已下线)选择题6-10
名校
解题方法
4 . 钨精矿分解渣可回收制备氧化铁和碳酸锰。在70~80℃时,钨精矿分解渣用盐酸浸取,浸出液中主要金属离子为 、
、 、
、 ,还含有少量
,还含有少量 、
、 等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。
等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。 时,生成氢氧化物沉淀的
时,生成氢氧化物沉淀的 。
。
ⅱ、
(1)浸出液加入硫酸铵后,采取的分离操作是___________ 。
(2)沉淀1的主要成分是___________ 。
(3)已知,煅烧后的Fe2O3不溶于水和稀硝酸。粗氧化铁中除Fe2O3外,还含有的物质是___________ 。
(4)结合化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
(5)滤液3中含有 和
和 ,加入
,加入 主要沉淀出
主要沉淀出 的原因可能是
的原因可能是___________ 。
(6)碳酸锰含量测定。
步骤1:准确称取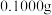 碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含
碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含 和
和 )加热至220℃~240℃,无小气泡冒出后,冷却至室温。
)加热至220℃~240℃,无小气泡冒出后,冷却至室温。
步骤2:用 硫酸亚铁铵
硫酸亚铁铵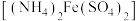 标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为
标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为 。
。
已知:ⅰ、 能与
能与 络合形成稳定的
络合形成稳定的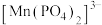 。
。
ⅱ、 的沸点为203℃。
的沸点为203℃。
①写出 将
将 氧化为
氧化为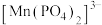 ,同时生成
,同时生成 的离子方程式
的离子方程式___________ 。
②碳酸锰样品中锰的质量分数为___________ 。
 、
、 、
、 ,还含有少量
,还含有少量 、
、 等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。
等。浸出液进一步制备氧化铁和碳酸锰的部分工艺流程如下。
 时,生成氢氧化物沉淀的
时,生成氢氧化物沉淀的 。
。| 氢氧化物 |  |  |  |  |
| 开始沉淀时 | 1.5 | 3.3 | 4.4 | 7.8 |
| 完全沉淀时 | 2.8 | 4.6 | 6.4 | 8.8 |
| 物质 |  |  |  |  |  |
 |  | 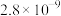 |  | 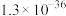 | 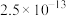 |
(2)沉淀1的主要成分是
(3)已知,煅烧后的Fe2O3不溶于水和稀硝酸。粗氧化铁中除Fe2O3外,还含有的物质是
(4)结合化学用语解释
 溶液呈碱性的原因
溶液呈碱性的原因(5)滤液3中含有
 和
和 ,加入
,加入 主要沉淀出
主要沉淀出 的原因可能是
的原因可能是(6)碳酸锰含量测定。
步骤1:准确称取
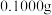 碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含
碳酸锰样品于锥形瓶中,加入适量高磷混酸(主要含 和
和 )加热至220℃~240℃,无小气泡冒出后,冷却至室温。
)加热至220℃~240℃,无小气泡冒出后,冷却至室温。步骤2:用
 硫酸亚铁铵
硫酸亚铁铵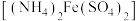 标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为
标准溶液滴定,消耗硫酸亚铁铵标准溶液体积为 。
。已知:ⅰ、
 能与
能与 络合形成稳定的
络合形成稳定的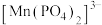 。
。ⅱ、
 的沸点为203℃。
的沸点为203℃。①写出
 将
将 氧化为
氧化为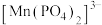 ,同时生成
,同时生成 的离子方程式
的离子方程式②碳酸锰样品中锰的质量分数为
您最近一年使用:0次
2023-04-29更新
|
440次组卷
|
3卷引用:北京市丰台区2023届高三下学期二模考试化学试题
名校
解题方法
5 . 镁基储氢材料MgH2具有储氢量高、成本低廉等优点,发展前景广阔。
Ⅰ.MgH2热分解放出H2
MgH2(s) Mg(s)+H2(g) ΔH=+75kJ/mol
Mg(s)+H2(g) ΔH=+75kJ/mol
该反应的能量变化如图。

(1)E1=_____ 。
(2)提高H2平衡产率的措施有_____ (答2条)。
Ⅱ.MgH2水解制备H2
(3)MgH2与H2O反应制备H2的化学方程式是_____ 。
(4)MgH2与H2O反应时,最初生成H2的速率很快,但随后变得很缓慢,原因是_____ 。
(5)MgCl2、NiCl2、CuCl2等盐溶液能提升MgH2的水解性能。1mol/L的几种盐溶液对MgH2水解制备H2的性能曲线如图。

已知:ⅰ.
ⅱ.MgH2在MCl2(M代表Mg、Ni、Cu)溶液中水解的示意图如图。

①NiCl2溶液制备H2的性能优于MgCl2溶液,原因是_____ 。
②MgH2在MgCl2溶液中制备H2的性能不如在NiCl2溶液中优异,但使用MgCl2溶液利于发展“镁-氢”循环经济,原因是_____ 。
③CuCl2溶液制备H2的性能不如NiCl2溶液,可能的原因是_____ 。
Ⅰ.MgH2热分解放出H2
MgH2(s)
 Mg(s)+H2(g) ΔH=+75kJ/mol
Mg(s)+H2(g) ΔH=+75kJ/mol该反应的能量变化如图。

(1)E1=
(2)提高H2平衡产率的措施有
Ⅱ.MgH2水解制备H2
(3)MgH2与H2O反应制备H2的化学方程式是
(4)MgH2与H2O反应时,最初生成H2的速率很快,但随后变得很缓慢,原因是
(5)MgCl2、NiCl2、CuCl2等盐溶液能提升MgH2的水解性能。1mol/L的几种盐溶液对MgH2水解制备H2的性能曲线如图。

已知:ⅰ.
| 物质 | Mg(OH)2 | Ni(OH)2 | Cu(OH)2 |
| Ksp | 5.6×10-12 | 5.5×10-16 | 2.2×10-20 |

①NiCl2溶液制备H2的性能优于MgCl2溶液,原因是
②MgH2在MgCl2溶液中制备H2的性能不如在NiCl2溶液中优异,但使用MgCl2溶液利于发展“镁-氢”循环经济,原因是
③CuCl2溶液制备H2的性能不如NiCl2溶液,可能的原因是
您最近一年使用:0次
2023-03-31更新
|
685次组卷
|
4卷引用:北京市西城区2023届一模考试化学试题
名校
解题方法
6 . 用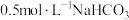 溶液滴定
溶液滴定 溶液,加入的碳酸氢钠溶液体积与溶液pH变化曲线如图所示,其中
溶液,加入的碳酸氢钠溶液体积与溶液pH变化曲线如图所示,其中 时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的
时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的 溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述错误的是
溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述错误的是

已知: ,
, 。
。
A.a点的混合溶液, |
| B.a→b的过程中,水的电离程度不断增大 |
C.总反应的化学方程式: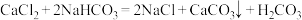 |
D.b点的混合溶液,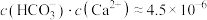 |
您最近一年使用:0次
2023-02-17更新
|
1381次组卷
|
8卷引用:2023年北京卷高考真题变式题(选择题11-14)
(已下线)2023年北京卷高考真题变式题(选择题11-14)湖南省浏阳市第一中学2023届高三第六次月考化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)辽宁省部分学校2022-2023学年高三下学期三模化学试题 辽宁省辽东南协作校2023届高三下学期第三次模拟考试化学试题河南省信阳高级中学2023-2024学年高三上学期11月一模考试化学试题新疆乌鲁木齐市2024届高三第一次质量监测化学试题四川省绵阳中学2023届高三三诊模拟考试理综-化学试题
名校
解题方法
7 . 红矾钠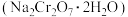 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。

已知:i. 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
(1)Ⅰ中, 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:_______ 。
(2)Ⅱ中,加入NaOH调节pH至_______ (填字母序号)。
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中, 氧化
氧化 沉淀的化学方程式为
沉淀的化学方程式为_______ 。
(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高, 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是_______ 。
(5)Ⅳ中,加入 的作用是
的作用是_______ (结合平衡移动原理解释)。
(6)为了测定获得红矾钠( )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为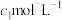 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)
①滴定终点的现象为_______ 。
②所得 (摩尔质量为
(摩尔质量为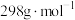 )的纯度的表达式为
)的纯度的表达式为_______ (用质量分数表示)。
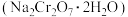 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
已知:i.
 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 4.3 | 5.6 |
 | 7.1 | 9.2 |
 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:(2)Ⅱ中,加入NaOH调节pH至
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中,
 氧化
氧化 沉淀的化学方程式为
沉淀的化学方程式为(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高,
 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是(5)Ⅳ中,加入
 的作用是
的作用是(6)为了测定获得红矾钠(
 )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为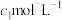 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)①滴定终点的现象为
②所得
 (摩尔质量为
(摩尔质量为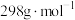 )的纯度的表达式为
)的纯度的表达式为
您最近一年使用:0次
2023-01-06更新
|
926次组卷
|
9卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十一中学2022-2023学年高二上学期期末考试化学试题北京一七一中学2023-2024学年高二上学期12月阶段性诊断化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题福建师范大学附属中学2022-2023学年高二下学期开学考试(期末考)化学试卷
名校
8 . 将铜片与足量浓盐酸混合加热,铜片溶解,有气泡产生,溶液呈无色。已知: Cu++3Cl- CuCl
CuCl (无色) K=5.0×105; Ksp(CuCl)=1.2×10-6,下 列说法错误的是
(无色) K=5.0×105; Ksp(CuCl)=1.2×10-6,下 列说法错误的是
 CuCl
CuCl (无色) K=5.0×105; Ksp(CuCl)=1.2×10-6,下 列说法错误的是
(无色) K=5.0×105; Ksp(CuCl)=1.2×10-6,下 列说法错误的是| A.铜片表面产生的气体为H2 |
| B.金属活泼性顺序是有一定前提条件的 |
| C.将反应后的溶液稀释,无沉淀产生 |
| D.铜不与稀盐酸反应主要因c(Cl-)不够大 |
您最近一年使用:0次
2022-05-11更新
|
434次组卷
|
5卷引用:北京市第一七一中学2022届高三下学期三模化学试题
北京市第一七一中学2022届高三下学期三模化学试题福建省泉州市2022届高三下学期质量检测(五)化学试题(已下线)专题04 氧化还原反应-2022年高考真题模拟题分项汇编江西省吉安市第三中学2022-2023学年高二上学期1月期末考试化学试题云南师范大学附属中学2023-2024学年高二上学期1月期末化学试题
9 . 某小组对FeCl3溶液与Cu粉混合后再加KSCN溶液的实验进行如下研究。
①向2mL 0.1mol/L FeCl3溶液中加入过量Cu粉,充分反应后,溶液变蓝。2天后,溶液变为浅蓝色,有白色不溶物生成。
②取①中浅蓝色的上层清液,滴加KSCN溶液,溶液变红,出现白色浑浊。振荡后白色浑浊物增多,红色褪去。经检验,白色不溶物是CuSCN。
③向2mL 0.1mol/LCuSO4溶液中滴加KSCN溶液,未观察到白色浑浊。放置24小时后,出现白色不溶物。
已知:CuCl和CuSCN均为白色不溶固体
下列说法不正确 的是
①向2mL 0.1mol/L FeCl3溶液中加入过量Cu粉,充分反应后,溶液变蓝。2天后,溶液变为浅蓝色,有白色不溶物生成。
②取①中浅蓝色的上层清液,滴加KSCN溶液,溶液变红,出现白色浑浊。振荡后白色浑浊物增多,红色褪去。经检验,白色不溶物是CuSCN。
③向2mL 0.1mol/LCuSO4溶液中滴加KSCN溶液,未观察到白色浑浊。放置24小时后,出现白色不溶物。
已知:CuCl和CuSCN均为白色不溶固体
下列说法
| A.①中产生白色不溶物的可能原因是Cu+Cu2++2Cl-=2CuCl↓ |
| B.由③可知②中白色浑浊不是Cu2+与SCN-直接反应生成的 |
| C.②中红色褪去的原因是Fe3+被完全消耗了 |
| D.实验表明:Ksp(CuSCN)<Ksp(CuCl) |
您最近一年使用:0次
2022-04-10更新
|
1425次组卷
|
12卷引用:北京市西城区2022届高三一模化学试题
北京市西城区2022届高三一模化学试题(已下线)北京市第四中学2022-2023学年高三上学期阶段测试2化学试题北京市第八中学2022-2023 学年高三上学期12 月月考化学试题北京市海淀区教师进修学校附属实验学校2023-2024学年高二上学期12 月月考化学练习北京市首都师大附中2023-2024学年高二上学期期末考试化学试卷北京首都师范大学附属中学2023-2024学年高三下学期考前热身化学试题湖南省隆回县第一中学2022届高三下学期第二次模拟考试化学试题湖南省邵阳市洞口县第一中学2021-2022学年高三下学期四月月考化学试题(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2023年高考化学一轮复习考点微专题福建省厦门第一中学2022-2023学年高三上学期12月月考化学试题福建省厦门第一中学海沧校区2023-2024学年高三上学期9月月考化学试题
名校
解题方法
10 . 从印刷电路板的腐蚀废液(主要含CuCl2、FeCl3、FeCl2等)中回收FeCl3、制备CuSO4·5H2O的流程如下。_______ 。
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中 浓度过小,原因是
浓度过小,原因是_______ (用离子方程式表示),不能得到硝酸铜晶体。
②粗液中 浓度较大,但由于
浓度较大,但由于_______ ,不能得到硝酸铜晶体。
(3)测量粗品 中铁(含
中铁(含 、
、 )的含量,评定纯度等级。
)的含量,评定纯度等级。
Ⅰ.用水溶解一定质量粗品,加入稀 和
和 溶液,加热。
溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至溶液 。过滤、洗涤,得到红褐色沉淀。
。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀 溶解红褐色沉淀,滴入
溶解红褐色沉淀,滴入 溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知: 完全沉淀的pH为6.7,
完全沉淀的pH为6.7, 完全沉淀的pH为2.8
完全沉淀的pH为2.8
①Ⅰ中将 氧化为
氧化为 的离子方程式是
的离子方程式是_______ 。
②试剂X是_______ 。
(4)电解:在不同电压、不同pH(pH<7)条件下电解 溶液,研究
溶液,研究 溶液的再生条件。
溶液的再生条件。
( ,
, )
)
①iii中产生 的原因有
的原因有 、
、_______ 。
② 溶液再生的合适条件是
溶液再生的合适条件是_______ (填实验序号)。
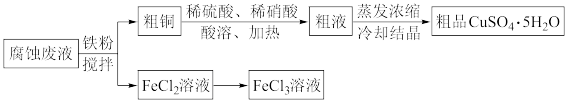
(2)粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
①相对于Cu2+,粗液中
 浓度过小,原因是
浓度过小,原因是②粗液中
 浓度较大,但由于
浓度较大,但由于(3)测量粗品
 中铁(含
中铁(含 、
、 )的含量,评定纯度等级。
)的含量,评定纯度等级。Ⅰ.用水溶解一定质量粗品,加入稀
 和
和 溶液,加热。
溶液,加热。Ⅱ.待溶液冷却后,加入试剂X至溶液
 。过滤、洗涤,得到红褐色沉淀。
。过滤、洗涤,得到红褐色沉淀。Ⅲ.用稀
 溶解红褐色沉淀,滴入
溶解红褐色沉淀,滴入 溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。已知:
 完全沉淀的pH为6.7,
完全沉淀的pH为6.7, 完全沉淀的pH为2.8
完全沉淀的pH为2.8①Ⅰ中将
 氧化为
氧化为 的离子方程式是
的离子方程式是②试剂X是
(4)电解:在不同电压、不同pH(pH<7)条件下电解
 溶液,研究
溶液,研究 溶液的再生条件。
溶液的再生条件。| 序号 | 电压 |  | 阴极现象 | 阳极产物 |
| i |  | a | 无气泡,少量金属析出 | 无 ,有 ,有 |
| ii |  | b | 较多气泡,极少量金属析出 | 无 ,有 ,有 |
| iii |  | a | 少量气泡,少量金属析出, | 有 ,有 ,有 |
 ,
, )
)①iii中产生
 的原因有
的原因有 、
、②
 溶液再生的合适条件是
溶液再生的合适条件是
您最近一年使用:0次
2022-04-01更新
|
522次组卷
|
5卷引用:北京市朝阳区2022届高三一模化学试题
北京市朝阳区2022届高三一模化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市广渠门中学2023-2024学年高二下学期期中考试化学试题湖南省邵阳市新宁县第一中学2021-2022学年高三下学期期中考试化学试题福建省福州高级中学2023-2024学年高三第二次阶段考试化学试题



