解题方法
1 . 镍钛钯废靶材含钛55%、镍25%、钯18%和杂质铝2%。从镍钛钯废靶材回收有关金属的工艺流程如下:

已知:I.常温下,钛与钯均不溶于盐酸。
II.PdCl 在溶液中存在配位平衡:PdCl
在溶液中存在配位平衡:PdCl (aq)
(aq) PdCl4(aq)+2Cl-(aq) △H>0
PdCl4(aq)+2Cl-(aq) △H>0
回答下列问题:
(1)“调pH”除铝、钛时,pH对溶液中金属离子质量浓度影响如下表,根据表中数据判断除铝、钛时pH应调节至_______ 为宜。
(2)“酸溶”所得溶液,经电积可得单质镍,电积沉镍装置如图所示。电积装置中,交换膜b应为_______ 离子交换膜(填“阳”或“阴”)。电解时浓缩室溶液体积保持不变,当浓缩室得到1L 0.6mol·L-1的盐酸时,阴极得到Ni的质量小于14.75g,其原因为_______ 。

(3)“氧化浸出”时,钯(Pd)被氧化生成配位离子PdCl 的离子方程式为
的离子方程式为_______ 。
(4)“沉钯”时,温度保持在55~65℃,温度不易过高,其原因除防止铵盐分解外,还有_______ 。“沉钯”时,铵盐最好选用_______ (填化学式),有利于钯的沉淀。
(5)氯钯酸铵[(NH4)2PdCl6]在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在_______ 操作中循环使用(填操作单元名称)。

已知:I.常温下,钛与钯均不溶于盐酸。
II.PdCl
 在溶液中存在配位平衡:PdCl
在溶液中存在配位平衡:PdCl (aq)
(aq) PdCl4(aq)+2Cl-(aq) △H>0
PdCl4(aq)+2Cl-(aq) △H>0回答下列问题:
(1)“调pH”除铝、钛时,pH对溶液中金属离子质量浓度影响如下表,根据表中数据判断除铝、钛时pH应调节至
| pH | 溶液中金属离子质量浓度(mg·L-1) | ||
| Al3+ | Ni2+ | Ti4+ | |
| 1.1 | 6100 | 7780 | 46 |
| 2.1 | 5960 | 7430 | 3 |
| 3.4 | 212 | 6080 | 1 |
| 4.2 | 125 | 5870 | 1 |
| 5.2 | 107 | 3720 | 1 |
(2)“酸溶”所得溶液,经电积可得单质镍,电积沉镍装置如图所示。电积装置中,交换膜b应为

(3)“氧化浸出”时,钯(Pd)被氧化生成配位离子PdCl
 的离子方程式为
的离子方程式为(4)“沉钯”时,温度保持在55~65℃,温度不易过高,其原因除防止铵盐分解外,还有
(5)氯钯酸铵[(NH4)2PdCl6]在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在
您最近一年使用:0次
解题方法
2 . CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成分为CoO、Co2O3,还含有Al2O3、ZnO 等杂质) 为原料制备CoCO3的一种工艺流程如下:
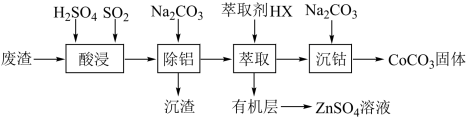
已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“酸浸”时加快溶解的方法有_______ (写出一种)。
(2)写出“酸浸”时发生氧化还原反应的化学方程式_______ 。
(3)“除铝”过程中需要调节溶液pH 的范围为_______ ,形成沉渣时发生反应的离子方程式为_______ 。
(4)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_______ 。
(5)“沉钴”后经过滤、洗涤、干燥可得CoCO3固体,其中洗涤沉淀的方法是_______ 。
(6)当Co2+沉淀完全时[c(Co2+)≤1×10-5mol·L-1],溶液中c(CO )至少应大于
)至少应大于_______ 。
(7)在空气中煅烧CoCO3生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴的氧化物的化学式为_______ 。

已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(2)写出“酸浸”时发生氧化还原反应的化学方程式
(3)“除铝”过程中需要调节溶液pH 的范围为
(4)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是(5)“沉钴”后经过滤、洗涤、干燥可得CoCO3固体,其中洗涤沉淀的方法是
(6)当Co2+沉淀完全时[c(Co2+)≤1×10-5mol·L-1],溶液中c(CO
 )至少应大于
)至少应大于(7)在空气中煅烧CoCO3生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴的氧化物的化学式为
您最近一年使用:0次
名校
解题方法
3 . 废催化剂(含WO3、Al2O3、MoO3、FeO)为原料制备(NH4)2WO4的工艺流程如图所示。

已知:①钠化焙烧后钨钼的存在形态为WO 和MoO
和MoO ;
;
②MoS 在化学反应中主要表现S2-的性质,受热易分解生成MoS3和S2-,其中MoS3易溶于热水和Na2S溶液中;
在化学反应中主要表现S2-的性质,受热易分解生成MoS3和S2-,其中MoS3易溶于热水和Na2S溶液中;
③pH=2~3时,WO 会聚合成(H2W12O40)6-。
会聚合成(H2W12O40)6-。
回答下列问题:
(1)“钠化焙烧”时WO3发生反应的化学方程式为____ 。
(2)浸出液的主要成分有NaAlO2、____ 、____ ;浸出渣的主要成分为____ 。
(3)将石灰乳加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=4×10-7,当溶液中WO 恰好沉淀完全(离子浓度等于10-5mol·L-1)时,溶液中c(OH-)=
恰好沉淀完全(离子浓度等于10-5mol·L-1)时,溶液中c(OH-)=____ 。
(4)如图为“硫化除钼”过程中,各物质的去除率与温度的关系。加入硫化剂NaHS溶液可将钼最终转化为MoS ,加入的除钼剂中含有Cu2+,其中Cu2+的作用是
,加入的除钼剂中含有Cu2+,其中Cu2+的作用是____ ;温度升高,除铝率升高而除钼率降低的原因是____ 。

(5)叔胺(R3N)萃取钨的过程中,胺与硫酸形成胺盐[(R3NH)2SO4]后才能萃取金属配合阴离子,反应方程式如下:5(R3NH)2SO4+2(H2W12O40)6-+2H+=2(R3NH)5H(H2W12O40)+5SO 。加入氨水进行反萃取时,发生的反应无化合价变化,其化学方程式为
。加入氨水进行反萃取时,发生的反应无化合价变化,其化学方程式为____ 。

已知:①钠化焙烧后钨钼的存在形态为WO
 和MoO
和MoO ;
;②MoS
 在化学反应中主要表现S2-的性质,受热易分解生成MoS3和S2-,其中MoS3易溶于热水和Na2S溶液中;
在化学反应中主要表现S2-的性质,受热易分解生成MoS3和S2-,其中MoS3易溶于热水和Na2S溶液中;③pH=2~3时,WO
 会聚合成(H2W12O40)6-。
会聚合成(H2W12O40)6-。回答下列问题:
(1)“钠化焙烧”时WO3发生反应的化学方程式为
(2)浸出液的主要成分有NaAlO2、
(3)将石灰乳加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=4×10-7,当溶液中WO
 恰好沉淀完全(离子浓度等于10-5mol·L-1)时,溶液中c(OH-)=
恰好沉淀完全(离子浓度等于10-5mol·L-1)时,溶液中c(OH-)=(4)如图为“硫化除钼”过程中,各物质的去除率与温度的关系。加入硫化剂NaHS溶液可将钼最终转化为MoS
 ,加入的除钼剂中含有Cu2+,其中Cu2+的作用是
,加入的除钼剂中含有Cu2+,其中Cu2+的作用是
(5)叔胺(R3N)萃取钨的过程中,胺与硫酸形成胺盐[(R3NH)2SO4]后才能萃取金属配合阴离子,反应方程式如下:5(R3NH)2SO4+2(H2W12O40)6-+2H+=2(R3NH)5H(H2W12O40)+5SO
 。加入氨水进行反萃取时,发生的反应无化合价变化,其化学方程式为
。加入氨水进行反萃取时,发生的反应无化合价变化,其化学方程式为
您最近一年使用:0次
2022-05-08更新
|
1223次组卷
|
3卷引用:黑龙江省绥化市普通高中2022届高三模拟联合考试理综化学试题
名校
解题方法
4 . 铂是重要的催化剂和吸氢材料,广泛用于新能源和化工行业。一种以电解精炼铜的阳极泥(含Pt、Au、Ag及少量有机物)为原料生产海绵Pt及Au的工艺流程如下:

回答下列问题:
(1)“焙烧”的主要目的是_______ ,“操作I”为_______ 。
(2)已知“滤液I”主要含HAuCl4、H2PtCl6,且二者均为强酸。HAuCl4中金元素化合价为_______ 。
(3)“沉金”的化学反应方程式为。_______ 。
(4)“沉铂”中生成(NH4)2PtCl6,结合“沉铂”过程中的平衡移动原理解释升高温度,(NH4)2PtCl6沉淀率升高的主要原因_______ 。
(5)“灼烧”时发生分解反应的化学方程式为_______ 。

回答下列问题:
(1)“焙烧”的主要目的是
(2)已知“滤液I”主要含HAuCl4、H2PtCl6,且二者均为强酸。HAuCl4中金元素化合价为
(3)“沉金”的化学反应方程式为。
(4)“沉铂”中生成(NH4)2PtCl6,结合“沉铂”过程中的平衡移动原理解释升高温度,(NH4)2PtCl6沉淀率升高的主要原因
(5)“灼烧”时发生分解反应的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 利用镍边角料、电镀厂的阴极镍挂柱(含铁、铜杂质)生产硫酸镍的工艺流程如图所示。

下列说法错误的是

| 沉淀 |  |  |  |  |  |  |  |
 |  |  |  |  |  | 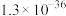 |  |
| A.“酸溶”时,应该先加入一定量的硝酸,待固体完全溶解后再按剂量加入硫酸 |
| B.“中和”、第一次“过滤”的主要目的是除铁元素 |
C.硫化剂X可以是 |
| D.“酸溶”时镍表面会有“氢气膜”,硝酸可将镍表面吸附的氢转化为水,提高“酸溶”速率 |
您最近一年使用:0次
2022-05-05更新
|
991次组卷
|
3卷引用:山东省济南市2022届高三第二次模拟化学试题
6 . 对废催化剂进行回收可有效利用金属资源,某含银废催化剂主要含Ag、α-Al2O3(α-Al2O3为载体,不溶于硝酸)及少量MgO、SiO2、K2O、Fe2O3等,一种回收制备高纯银粉工艺的部分流程如下:

回答下列问题:
(1)银与稀硝酸反应的离子方程式是_______ ,废渣的主要成分是_______ ,酸浸时,硝酸加入量及反应温度对银浸取率的影响如图,根据图中数据分析,该工艺宜选用硝酸的加入量和温度是_______ 。

(2)“还原”中有无毒气体生成,氧化剂与还原剂物质的量之比是_______ ,“溶解”得到的溶解液里Ag元素以[Ag(NH3)2]+存在,若用H2O2代替N2H4•H2O完成还原过程,发生反应的离子方程式是_______ 。
(3)粗银中银的质量分数w的测定:取mg粗银样品用硝酸溶解,以铁铵矾[NH4Fe(SO4)2•12H2O]为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。已知:①AgSCN是白色沉淀, ;②浓硝酸可氧化AgSCN。滴定终点的现象是
;②浓硝酸可氧化AgSCN。滴定终点的现象是_______ ,w=_______ %,若测得w>100%,可能的原因是_______ 。

回答下列问题:
(1)银与稀硝酸反应的离子方程式是

(2)“还原”中有无毒气体生成,氧化剂与还原剂物质的量之比是
(3)粗银中银的质量分数w的测定:取mg粗银样品用硝酸溶解,以铁铵矾[NH4Fe(SO4)2•12H2O]为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。已知:①AgSCN是白色沉淀,
 ;②浓硝酸可氧化AgSCN。滴定终点的现象是
;②浓硝酸可氧化AgSCN。滴定终点的现象是
您最近一年使用:0次
名校
解题方法
7 . 镍是一种硬而有延展性并具有铁磁性的金属,它能够高度磨光和抗腐蚀,工业上用红土镍矿[主要成分为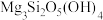 、
、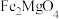 、NiO、
、NiO、 、
、 ]为原料,采用硫酸铵焙烧法选择性提取镍并回收副产物黄铵铁矾[化学式可表示为
]为原料,采用硫酸铵焙烧法选择性提取镍并回收副产物黄铵铁矾[化学式可表示为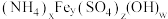 ,摩尔质量为
,摩尔质量为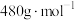 ]的工艺流程如图所示:
]的工艺流程如图所示:

已知:
①
②
(1)除铁时加入的 的用量高于理论用量的原因是
的用量高于理论用量的原因是_______ 。(写出2点)
(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与 反应生成
反应生成 该反应的化学方程式为
该反应的化学方程式为_______ ;“浸渣”的主要成分除含有铁元素的化合物外还有_______ (填化学式)。
(3)该工艺条件下, 生成
生成 沉淀,
沉淀, 生成
生成 或黄铵铁矾沉淀,开始沉淀和沉淀完全时的pH如下表:
或黄铵铁矾沉淀,开始沉淀和沉淀完全时的pH如下表:
若残留在浸出液中的铁完全转化为黄铵铁矾除去,“除铁”时通入 调节溶液pH的范围是
调节溶液pH的范围是_______ 。
(4)“沉镍”时pH调为8.0,滤液中 浓度约为
浓度约为_______ mo/L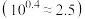 。
。
(5)由所得滤液获得 晶体时,常用无水乙醇代替蒸馏水作洗涤剂,原因是
晶体时,常用无水乙醇代替蒸馏水作洗涤剂,原因是_______ (写出2点)
(6)对黄铵铁巩进行热分解实验,其结果如下图所示,则黄铵铁矾的化学式为_______ 。(已知:黄铵铁矾在300℃前分解释放的物质为 ,300-575℃之间只有
,300-575℃之间只有 和
和 放出,此时残留固体只存在Fe、O、S三种元素,670℃以上得到的是纯净的红棕色粉末)。
放出,此时残留固体只存在Fe、O、S三种元素,670℃以上得到的是纯净的红棕色粉末)。

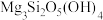 、
、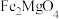 、NiO、
、NiO、 、
、 ]为原料,采用硫酸铵焙烧法选择性提取镍并回收副产物黄铵铁矾[化学式可表示为
]为原料,采用硫酸铵焙烧法选择性提取镍并回收副产物黄铵铁矾[化学式可表示为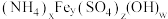 ,摩尔质量为
,摩尔质量为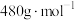 ]的工艺流程如图所示:
]的工艺流程如图所示:
已知:
①

②

(1)除铁时加入的
 的用量高于理论用量的原因是
的用量高于理论用量的原因是(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与
 反应生成
反应生成 该反应的化学方程式为
该反应的化学方程式为(3)该工艺条件下,
 生成
生成 沉淀,
沉淀, 生成
生成 或黄铵铁矾沉淀,开始沉淀和沉淀完全时的pH如下表:
或黄铵铁矾沉淀,开始沉淀和沉淀完全时的pH如下表:| 沉淀物 |  |  | 黄铵铁矾 |
| 开始沉淀时的pH | 7.1 | 2.7 | 1.3 |
沉淀完全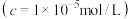 时的pH 时的pH | 9.2 | 3.7 | 2.3 |
 调节溶液pH的范围是
调节溶液pH的范围是(4)“沉镍”时pH调为8.0,滤液中
 浓度约为
浓度约为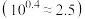 。
。(5)由所得滤液获得
 晶体时,常用无水乙醇代替蒸馏水作洗涤剂,原因是
晶体时,常用无水乙醇代替蒸馏水作洗涤剂,原因是(6)对黄铵铁巩进行热分解实验,其结果如下图所示,则黄铵铁矾的化学式为
 ,300-575℃之间只有
,300-575℃之间只有 和
和 放出,此时残留固体只存在Fe、O、S三种元素,670℃以上得到的是纯净的红棕色粉末)。
放出,此时残留固体只存在Fe、O、S三种元素,670℃以上得到的是纯净的红棕色粉末)。
您最近一年使用:0次
2022-05-05更新
|
501次组卷
|
2卷引用:辽宁省大连市2022届高三第一次模拟考试化学试题
名校
解题方法
8 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s) CaO(s)+CO2(g) △H1=+178.30kJ/mol
CaO(s)+CO2(g) △H1=+178.30kJ/mol
②CaO(s)+SO2(g)+0.5O2(g) CaSO4(s) △H2=-501.92kJ/mol
CaSO4(s) △H2=-501.92kJ/mol
③CO(g)+0.5O2(g) CO2(g) △H3
CO2(g) △H3
④CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol
CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol
(1)温度升高,反应①的化学平衡常数____ (填“增大”“减小”或“不变”)。
(2)△H3=____ kJ/mol。
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:____ 。
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去。
(4)将煤打成煤浆加入电解槽的目的是____ 。
(5)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:____ 。
FeS2+·OH=Fe3++SO +H2O+_____。
+H2O+_____。
(6)对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;____ 。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)
 CaO(s)+CO2(g) △H1=+178.30kJ/mol
CaO(s)+CO2(g) △H1=+178.30kJ/mol②CaO(s)+SO2(g)+0.5O2(g)
 CaSO4(s) △H2=-501.92kJ/mol
CaSO4(s) △H2=-501.92kJ/mol③CO(g)+0.5O2(g)
 CO2(g) △H3
CO2(g) △H3④CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol
CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol(1)温度升高,反应①的化学平衡常数
(2)△H3=
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去。
(4)将煤打成煤浆加入电解槽的目的是
(5)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
FeS2+·OH=Fe3++SO
 +H2O+_____。
+H2O+_____。(6)对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;
您最近一年使用:0次
名校
9 . 半导体芯片行业是金属靶材的主要应用领域之一。利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:

已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③氧化性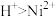
④室温: ;
;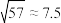
(1)“酸浸”时镍发生反应的化学方程式为_______ 。
(2)铂在王水中生成二元强酸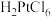 ,其中Pt元素的化合价为
,其中Pt元素的化合价为_______ ,该反应的离子方程式为_______ 。
(3)设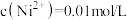 “调pH”应控制的pH范围是
“调pH”应控制的pH范围是_______ 。
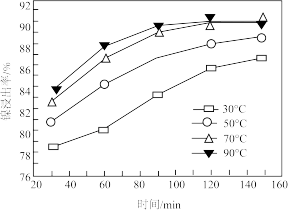
(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是_______ 。
(5)沉铂过程中,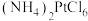 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释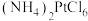 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因_______ 。
(6)在“沉铂”过程中,若向 的溶液里加入等体积的
的溶液里加入等体积的 溶液,使
溶液,使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度最小值为
溶液的浓度最小值为_______ mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。

已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 ( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
③氧化性
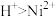
④室温:
 ;
;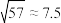
(1)“酸浸”时镍发生反应的化学方程式为
(2)铂在王水中生成二元强酸
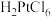 ,其中Pt元素的化合价为
,其中Pt元素的化合价为(3)设
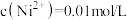 “调pH”应控制的pH范围是
“调pH”应控制的pH范围是(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是

(5)沉铂过程中,
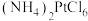 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因(6)在“沉铂”过程中,若向
 的溶液里加入等体积的
的溶液里加入等体积的 溶液,使
溶液,使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度最小值为
溶液的浓度最小值为(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。
| A.蒸馏水 | B.浓盐酸 | C.氯化铵溶液 | D.王水 |
您最近一年使用:0次
2022-04-29更新
|
1502次组卷
|
4卷引用:广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题
广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题湖南省衡山县岳云中学2021-2022学年高三下学期期中考试化学试卷(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)(已下线)2022年全国乙卷高考变式题(非选择题)
2022高三·全国·专题练习
解题方法
10 . 已知NH4VO3在pH=7~8时溶解度最小。某工厂利用钒铬渣提取液(主要成分为NaVO3和Na2CrO4)制备Na2CrO4和NH4VO3晶体,流程如图:
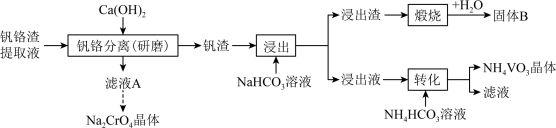
不同温度下相关物质的溶解度
(1)关于“钒铬分离”过程,下列说法正确的是____ 。
(2)从滤液A中获取Na2CrO4晶体时,应采用的结晶方法为____ ;残留的含铬废水不能直接排放,处理时需要经过“酸化→还原→沉降”三个步骤,用Na2SO3溶液还原时,还原产物为Cr3+,则反应的离子方程式____ ;为了使c(Cr3+)不高于1×10-6mol·L-1,“沉降”时应调节pH____ [该温度下Cr(OH)3的Ksp近似为1×10-30]。
(3)“浸出”过程中生成NaVO3的离子方程式为____ 。

不同温度下相关物质的溶解度
| NaVO3 | Na2CrO4 | Ca3(VO4)2 | CaCrO4 | |
| 20℃ | 19.3 | 84.0 | 0.1 | 5.5 |
| 40℃ | 22.5 | 96.5 | 0.09 | 2.49 |
| 60℃ | 26.3 | 102 | 0.09 | 1.3 |
| A.研磨可防止生成的沉淀覆在Ca(OH)2表面,提高Ca(OH)2利用率 |
| B.研磨减小了所得钒渣的粒径,提高了后续步骤中钒渣的浸出率 |
| C.相对于20℃、40℃,工业上更宜选用60℃ |
| D.该过程发生了氧化还原反应 |
(3)“浸出”过程中生成NaVO3的离子方程式为
您最近一年使用:0次



