工业上两次转化法从天青石矿(主要成分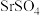 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。
(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品 。滤液中
。滤液中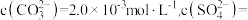
_________  。[已知:
。[已知: ]
]
②酸化:用稀盐酸浸泡粗品 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为_________ (催化剂氯化铵参与了 与盐酸生成
与盐酸生成 的反应)。
的反应)。
③除杂。
ⅰ)除铁、铝:向 粗溶液中加入少量的
粗溶液中加入少量的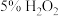 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在_________ 范围内,充分搅拌,过滤。
已知:相关金属离子生成氢氧化物沉淀的 如下表所示,
如下表所示, 为7.8时
为7.8时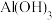 沉淀开始溶解。
沉淀开始溶解。
ⅱ)除钙:取ⅰ中滤液,逐滴加入适量稀 溶液。
溶液。
请补充完整去除 的后续实验操作:
的后续实验操作:_________ ,得到较纯净的 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,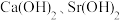 的溶解度分别为
的溶解度分别为 、
、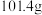 。
。
(2)二次转化。向 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。
①写出沉淀过程中发生反应的化学方程式:_________ 。
②锶转化率随温度的变化如图所示。当反应温度大于 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是_________ 。

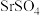 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品
 。滤液中
。滤液中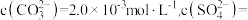
 。[已知:
。[已知: ]
]②酸化:用稀盐酸浸泡粗品
 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为 与盐酸生成
与盐酸生成 的反应)。
的反应)。③除杂。
ⅰ)除铁、铝:向
 粗溶液中加入少量的
粗溶液中加入少量的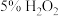 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在已知:相关金属离子生成氢氧化物沉淀的
 如下表所示,
如下表所示, 为7.8时
为7.8时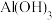 沉淀开始溶解。
沉淀开始溶解。| 物质 |  |  | 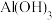 |  | 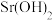 |
开始沉淀 | 1.9 | 7.0 | 3.4 | - | - |
完全沉淀 | 3.2 | 9.0 | 4.7 | 12 | - |
 溶液。
溶液。请补充完整去除
 的后续实验操作:
的后续实验操作: 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,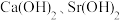 的溶解度分别为
的溶解度分别为 、
、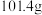 。
。(2)二次转化。向
 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。①写出沉淀过程中发生反应的化学方程式:
②锶转化率随温度的变化如图所示。当反应温度大于
 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是
更新时间:2022-11-12 12:23:42
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】完成下列问题
(1)已知某温度下有如下三个反应:
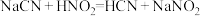


①则该温度下HF、HCN和 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是___________
②已知:乙二酸( ,可简写为
,可简写为 ),俗称草酸;25℃
),俗称草酸;25℃
 ,
,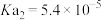 ,25℃
,25℃ ,请写出少量草酸(
,请写出少量草酸( )与NaF溶液反应的化学方程式:
)与NaF溶液反应的化学方程式:___________ 。
(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
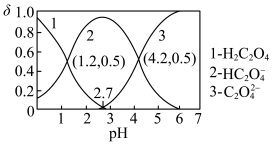
①如果所得溶液溶质为 ,则该溶液显
,则该溶液显___________ (填“酸性”、“碱性”或“中性”),其电离方程式为___________ ;
②如果所得溶液溶质为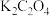 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为___________ ;
③当所得溶液 时,溶液中
时,溶液中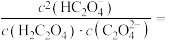
___________ ;
(3)已知25℃草酸钙的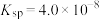 ,碳酸钙的
,碳酸钙的 。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入
。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入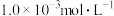 的草酸钾溶液10mL,
的草酸钾溶液10mL,___________ 产生草酸钙沉淀(填“能”或“否”)。
(1)已知某温度下有如下三个反应:
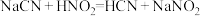


①则该温度下HF、HCN和
 三种弱酸的电离常数由大到小的顺序是
三种弱酸的电离常数由大到小的顺序是②已知:乙二酸(
 ,可简写为
,可简写为 ),俗称草酸;25℃
),俗称草酸;25℃
 ,
,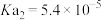 ,25℃
,25℃ ,请写出少量草酸(
,请写出少量草酸( )与NaF溶液反应的化学方程式:
)与NaF溶液反应的化学方程式:(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中
 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
①如果所得溶液溶质为
 ,则该溶液显
,则该溶液显②如果所得溶液溶质为
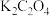 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为③当所得溶液
 时,溶液中
时,溶液中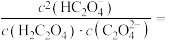
(3)已知25℃草酸钙的
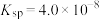 ,碳酸钙的
,碳酸钙的 。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入
。回答下列问题:25℃时向10mL碳酸钙的饱和溶液中逐滴加入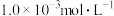 的草酸钾溶液10mL,
的草酸钾溶液10mL,
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高难挥发)有一定关系。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:__ 。
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:__ 。
Ca5(PO4)3OH(s)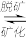 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO (aq)+OH-(aq)
(aq)+OH-(aq)
(3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
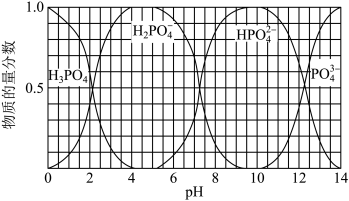
①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是___ 。
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是__ (填序号)。
a.Na2HPO4溶液显碱性,原因是HPO 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+)+c(H+)=c(H2PO )+2c(HPO
)+2c(HPO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
c.c(Na+)=c(H2PO )+c(HPO
)+c(HPO )+c(PO
)+c(PO )+c(H3PO4)
)+c(H3PO4)
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是__ 。
②该可乐样品中磷酸的含量为__ g/L(H3PO4摩尔质量为98g/mol)。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:
Ca5(PO4)3OH(s)
 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO (aq)+OH-(aq)
(aq)+OH-(aq) (3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。

①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是
a.Na2HPO4溶液显碱性,原因是HPO
 的水解程度大于其电离程度
的水解程度大于其电离程度b.c(Na+)+c(H+)=c(H2PO
 )+2c(HPO
)+2c(HPO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)c.c(Na+)=c(H2PO
 )+c(HPO
)+c(HPO )+c(PO
)+c(PO )+c(H3PO4)
)+c(H3PO4)(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是
②该可乐样品中磷酸的含量为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】下表1是常温下几种弱酸的电离平衡上述(Ka)和弱碱的电离平衡常数(Kb),表2时常温下几种难(微)溶物的溶度积常数(Ksp)
请回答下面问题:
(1)上述四种酸中,酸性最强的是______________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是______ (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)HCOONH4的水溶液呈_______ (选填“酸性”、“中性”、“碱性”),写出HCOONH4水解的离子反应方程式____________ 。
(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为___ 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,最终 SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中CO32-物质的量浓度应_____________ mol·L-1。
表1 | |
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HIO3 | 1.7×10-1 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3•H2O | 1.8×10-5 |
表2 | |
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
请回答下面问题:
(1)上述四种酸中,酸性最强的是
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)HCOONH4的水溶液呈
(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,最终 SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中CO32-物质的量浓度应
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
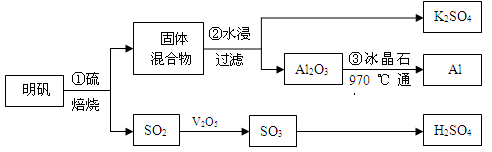
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为:____________ 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________ 。
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是__________ 。
(4)步骤③电解的化学方程式是_______________ ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:____________________________ 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是___________________________ 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为___________________ 吨(列出计算表达式)。

已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为:
(2)步骤②中,为提高浸出率,可采取的措施有
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是
(4)步骤③电解的化学方程式是
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:
已知:
(1)CaCO3与盐酸反应的离子方程式___________ 。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________ ,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________ 。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______ 。
(5)蒸发结晶要保持在160℃的原因是__________ 。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________ 。
②计算上述样品中CaCl2·2H2O的质量分数为_______ 。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________ ;__________ 。
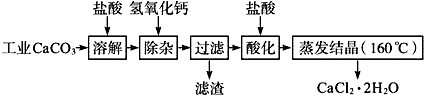
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为
(3)过滤时需用的比玻璃器有
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③
(5)蒸发结晶要保持在160℃的原因是
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有
②计算上述样品中CaCl2·2H2O的质量分数为
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被_______ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如图:
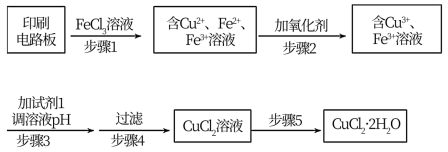
①步骤1中反应的离子方程式是_______ 。
②步骤2所加的氧化剂最适宜的是_______ 。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为_______ [Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是_______ (写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料__ (填“Cu”或“C”)。并写出电极反应式____ 。

(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2
 2Cu+SO2
2Cu+SO2湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如图:

①步骤1中反应的离子方程式是
②步骤2所加的氧化剂最适宜的是
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料

您最近一年使用:0次



