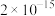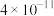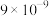名校
解题方法
1 . 随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)为原料提取硒,设计的流程如下:

【资料卡片】控制电位在0.740~1.511 V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2,以达到硒与杂质金属的分离。请回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图,最佳温度是_______ 。

(2)“氧化酸浸”中,Se转化成H2SeO3(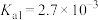 ),H2SeO3的化学名称为
),H2SeO3的化学名称为_______ ,该反应的离子方程式为:_______ 。
(3)已知:ClO2浓度过高时容易爆炸,工业上制备ClO2的工艺有:
盐酸法:
双氧水法: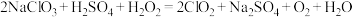
请根据以上信息完成填空:双氧水法相比盐酸法的优点有①反应需要的酸度条件较低,对设备腐蚀影响较小;②_______ 。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等。
①净化后的溶液中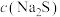 达到
达到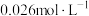 ,此时溶液中的
,此时溶液中的 的最大值为
的最大值为_______  ,精硒中基本不含铜。[
,精硒中基本不含铜。[ ]
]
②硒代硫酸钠酸化生成硒的离子方程式为_______ 。
(5)H2SeO4在水溶液中的电离方程式如下: ,
, 。已知
。已知 H2SeO4溶液的pH为x,则
H2SeO4溶液的pH为x,则
_______ (写出含x的表达式)。

【资料卡片】控制电位在0.740~1.511 V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2,以达到硒与杂质金属的分离。请回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图,最佳温度是

(2)“氧化酸浸”中,Se转化成H2SeO3(
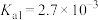 ),H2SeO3的化学名称为
),H2SeO3的化学名称为(3)已知:ClO2浓度过高时容易爆炸,工业上制备ClO2的工艺有:
盐酸法:

双氧水法:
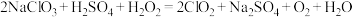
请根据以上信息完成填空:双氧水法相比盐酸法的优点有①反应需要的酸度条件较低,对设备腐蚀影响较小;②
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等。
①净化后的溶液中
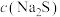 达到
达到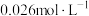 ,此时溶液中的
,此时溶液中的 的最大值为
的最大值为 ,精硒中基本不含铜。[
,精硒中基本不含铜。[ ]
]②硒代硫酸钠酸化生成硒的离子方程式为
(5)H2SeO4在水溶液中的电离方程式如下:
 ,
, 。已知
。已知 H2SeO4溶液的pH为x,则
H2SeO4溶液的pH为x,则
您最近一年使用:0次
解题方法
2 . 金属钼(Mo)及其化合物在合金工业中起着重要的作用,生产中常常以辉钼矿(主要成分为 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
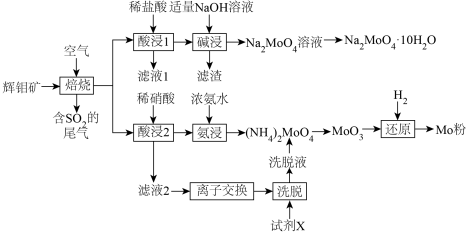
已知:①Mo的常见价态有+4、+6价。
②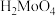 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。
③氧气不足时,焙烧产物中可能混有 与
与 反应生成的
反应生成的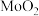 。
。
回答下列问题:
(1)焙烧的产物中Mo元素主要以 、
、 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式______________________ 。
(2)与酸浸1相比,酸浸2使用稀硝酸的优点是___________ ,但是缺点是造成 的污染。
的污染。
(3)滤渣的成分主要是___________ 。碱浸时应控制pH不宜过大,原因是______________ 。
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为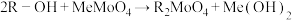 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为___________ 。
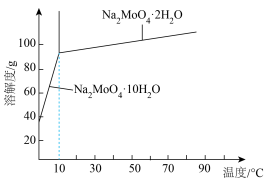
(5)钼酸钠某些晶体的溶解度曲线如图,获得 的操作为蒸发浓缩、
的操作为蒸发浓缩、___________ 、过滤、洗涤。
(6)工业上还有电氧化法 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
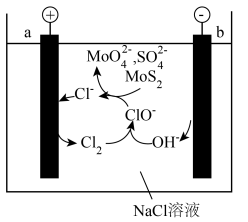
每生成0.1mol 时,外电路转移的电子数为
时,外电路转移的电子数为___________ (阿伏加德罗常数的值用 表示)
表示)
(7) 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为___________ 。滴定终点的现象为___________ 。
取m g  (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL, 的百分含量为
的百分含量为___________ (写出表达式即可)。
 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
已知:①Mo的常见价态有+4、+6价。
②
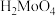 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。③氧气不足时,焙烧产物中可能混有
 与
与 反应生成的
反应生成的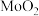 。
。回答下列问题:
(1)焙烧的产物中Mo元素主要以
 、
、 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式(2)与酸浸1相比,酸浸2使用稀硝酸的优点是
 的污染。
的污染。(3)滤渣的成分主要是
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为
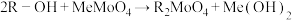 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为(5)钼酸钠某些晶体的溶解度曲线如图,获得
 的操作为蒸发浓缩、
的操作为蒸发浓缩、
(6)工业上还有电氧化法
 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
每生成0.1mol
 时,外电路转移的电子数为
时,外电路转移的电子数为 表示)
表示)(7)
 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为 |  | PbS | 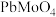 | |
 | 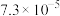 |  | 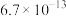 | 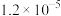 |
| 颜色 | 白色 | 亮黄色 | 黑色 | 白色 |
 (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL, 的百分含量为
的百分含量为
您最近一年使用:0次
3 . 从炼钢粉尘(主要含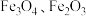 和
和 )中提取锌的流程如下:
)中提取锌的流程如下:
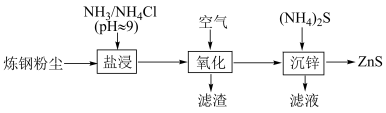
“盐浸”过程 转化为
转化为 ,并有少量
,并有少量 和
和 浸出。下列说法错误的是
浸出。下列说法错误的是
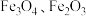 和
和 )中提取锌的流程如下:
)中提取锌的流程如下:
“盐浸”过程
 转化为
转化为 ,并有少量
,并有少量 和
和 浸出。下列说法错误的是
浸出。下列说法错误的是A.“盐浸”过程若浸液 下降,需补充 下降,需补充 |
B.“滤渣”的主要成分为 |
C.“沉锌”过程发生反应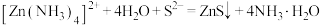 |
D.应合理控制 用量,以便滤液循环使用 用量,以便滤液循环使用 |
您最近一年使用:0次
2023-11-16更新
|
3691次组卷
|
6卷引用:2023年福建省高考化学试卷
2023年福建省高考化学试卷辽宁省沈阳市东北育才学校高中部2023-2024学年高三上学期第三次模拟考试 化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江苏省南菁高中、常州市第一中学2023-2024学年高二下学期3月月考化学试题中国人民大学附属中学2023-2024学年高三下学期化学练习6山东省青岛第二中学2023-2024学年高二下学期月考化学试卷
解题方法
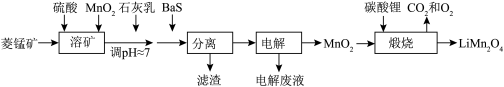
4 . 由菱锰矿(主要成分为 ,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料
,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料 的工艺流程如下:
的工艺流程如下:
已知:①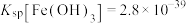 ,
,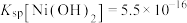 ,
,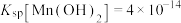 ,
, ,
, 。
。
②当溶液中离子浓度小于 时,可视为沉淀完全。
时,可视为沉淀完全。
③ 可溶于水。
可溶于水。
(1)基态锰原子的核外电子排布式为_______ 。
(2)加入少量 的目的是氧化
的目的是氧化 ,实际生产中不用
,实际生产中不用 替代
替代 的原因是
的原因是_______ 。
(3)溶矿反应完成后,先向反应后溶液中加入石灰乳至溶液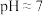 ,再加
,再加 进一步除去
进一步除去 。加石灰乳调节溶液pH时,不直接将
。加石灰乳调节溶液pH时,不直接将 沉淀完全为
沉淀完全为 的原因是
的原因是_______ 。
(4)若分离后的溶液中 ,要使
,要使 完全除尽,则需控制
完全除尽,则需控制 的范围为
的范围为_______ ;生产中也可用_______ (填化学式)代替 除去
除去 ,同时增加
,同时增加 产量。
产量。
(5)电解废液中可循环利用的物质是_______ (填化学式)
(6)煅烧时,生成 的化学方程式为
的化学方程式为_______ 。
 ,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料
,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料 的工艺流程如下:
的工艺流程如下:
已知:①
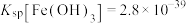 ,
,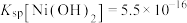 ,
,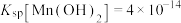 ,
, ,
, 。
。②当溶液中离子浓度小于
 时,可视为沉淀完全。
时,可视为沉淀完全。③
 可溶于水。
可溶于水。(1)基态锰原子的核外电子排布式为
(2)加入少量
 的目的是氧化
的目的是氧化 ,实际生产中不用
,实际生产中不用 替代
替代 的原因是
的原因是(3)溶矿反应完成后,先向反应后溶液中加入石灰乳至溶液
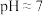 ,再加
,再加 进一步除去
进一步除去 。加石灰乳调节溶液pH时,不直接将
。加石灰乳调节溶液pH时,不直接将 沉淀完全为
沉淀完全为 的原因是
的原因是(4)若分离后的溶液中
 ,要使
,要使 完全除尽,则需控制
完全除尽,则需控制 的范围为
的范围为 除去
除去 ,同时增加
,同时增加 产量。
产量。(5)电解废液中可循环利用的物质是
(6)煅烧时,生成
 的化学方程式为
的化学方程式为
您最近一年使用:0次
解题方法
5 . 实验室以天青石精矿(主要含 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料制取
)为原料制取 ,其实验流程如图所示:
,其实验流程如图所示:

(1)室温下,反应 达到平衡,则反应的平衡常数为(结果保留至0.1)
达到平衡,则反应的平衡常数为(结果保留至0.1)_____ 。[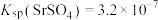 ,
, ]
]
(2)已知常温下, ,
,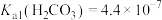 ,
,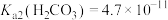 。
。
①常温下,0.1
 溶液中
溶液中
_____ (填“>”“<”或“=”) 。
。
②常温下,实测某人血液中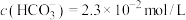 ,
, ,则人体血液呈
,则人体血液呈_____ 性。
③浸取天青石精矿时,向 溶液中加入适量浓氨水的目的是
溶液中加入适量浓氨水的目的是_____ 。
(3)“沉淀"过程中除得到 外,还得到一种可循环利用的物质,该物质为
外,还得到一种可循环利用的物质,该物质为_____ 。
(4)“浸取Ⅰ”的条件是温度在60~70℃,搅拌、反应3小时,温度过高将会导致 的转化率下降,其原因是
的转化率下降,其原因是_____ 。
(5)将 与煤粉按照一定比例混合后高温煅烧得到一种黑灰(SrS),写出其反应的化学方程式:(写出一个即可)
与煤粉按照一定比例混合后高温煅烧得到一种黑灰(SrS),写出其反应的化学方程式:(写出一个即可)_____ 。
(6)检验“沉淀”步骤中是否沉淀完全的方法:_____ 。
 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料制取
)为原料制取 ,其实验流程如图所示:
,其实验流程如图所示:
(1)室温下,反应
 达到平衡,则反应的平衡常数为(结果保留至0.1)
达到平衡,则反应的平衡常数为(结果保留至0.1)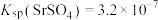 ,
, ]
](2)已知常温下,
 ,
,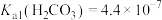 ,
,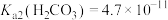 。
。①常温下,0.1

 溶液中
溶液中
 。
。②常温下,实测某人血液中
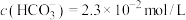 ,
, ,则人体血液呈
,则人体血液呈③浸取天青石精矿时,向
 溶液中加入适量浓氨水的目的是
溶液中加入适量浓氨水的目的是(3)“沉淀"过程中除得到
 外,还得到一种可循环利用的物质,该物质为
外,还得到一种可循环利用的物质,该物质为(4)“浸取Ⅰ”的条件是温度在60~70℃,搅拌、反应3小时,温度过高将会导致
 的转化率下降,其原因是
的转化率下降,其原因是(5)将
 与煤粉按照一定比例混合后高温煅烧得到一种黑灰(SrS),写出其反应的化学方程式:(写出一个即可)
与煤粉按照一定比例混合后高温煅烧得到一种黑灰(SrS),写出其反应的化学方程式:(写出一个即可)(6)检验“沉淀”步骤中是否沉淀完全的方法:
您最近一年使用:0次
名校
解题方法
6 . Cr(OH)3可用于油漆颜料及羊毛处理。工业上以高铁铬铁矿(主要成分为Cr2O3,含Fe2O3、SiO2、Al2O3等杂质)为原料生产Cr(OH)3和金属Al的工艺流程如图。

已知:
I.“焙烧”过程中,Cr2O3、SiO2、Al2O3,分别反应转化为Na2CrO4、Na2SiO3、NaAl(OH)4。
II.若溶液中相关离子的物质的量浓度为c,则常温时,lgc与溶液pH的关系如图所示(当溶液中的某离子浓度小于10-5,则认为该离子在溶液中几乎不存在)。

III. 。
。
IV. 曾简写为
曾简写为 。
。
回答下列问题:
(1)“焙烧”时,粉碎矿石的目的是___________ , 的电子式为
的电子式为___________ 。
(2)“水浸”后滤渣主要成分为___________ (填化学式),“水浸”后浸出液呈___________ (填“酸性”“碱性”或“中性”)。
(3)“调节 ”步骤中,调节的
”步骤中,调节的 范围为
范围为___________ ,含硅微粒与 发生反应的离子方程式是
发生反应的离子方程式是___________ , 与
与 相比,结合氢离子能力较强的是
相比,结合氢离子能力较强的是___________ (填微粒化学式)。
(4)常温下,图像上 点对应的溶液
点对应的溶液
___________ 。
(5)加入 “析铬”时,
“析铬”时, 被还原的离子方程式为
被还原的离子方程式为___________ 。

已知:
I.“焙烧”过程中,Cr2O3、SiO2、Al2O3,分别反应转化为Na2CrO4、Na2SiO3、NaAl(OH)4。
II.若溶液中相关离子的物质的量浓度为c,则常温时,lgc与溶液pH的关系如图所示(当溶液中的某离子浓度小于10-5,则认为该离子在溶液中几乎不存在)。

III.
 。
。IV.
 曾简写为
曾简写为 。
。回答下列问题:
(1)“焙烧”时,粉碎矿石的目的是
 的电子式为
的电子式为(2)“水浸”后滤渣主要成分为
(3)“调节
 ”步骤中,调节的
”步骤中,调节的 范围为
范围为 发生反应的离子方程式是
发生反应的离子方程式是 与
与 相比,结合氢离子能力较强的是
相比,结合氢离子能力较强的是(4)常温下,图像上
 点对应的溶液
点对应的溶液
(5)加入
 “析铬”时,
“析铬”时, 被还原的离子方程式为
被还原的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 利用某冶锌工厂的工业废料[除ZnO和少量Fe2O3外,还含有铋(Bi)、锗(Ge)的氧化物]制取几种金属化合物的工业流程如图:
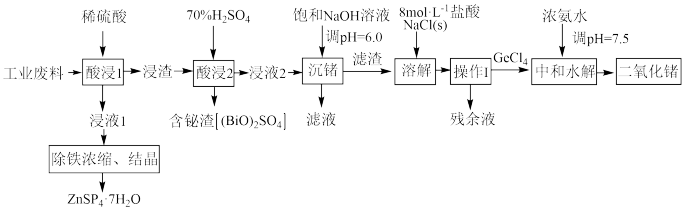
已知:①该工艺条件下,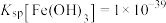 ,
, 。
。
② 的熔点为-49.5℃,沸点为84℃,其在水中或酸的稀溶液中易水解。
的熔点为-49.5℃,沸点为84℃,其在水中或酸的稀溶液中易水解。
请回答下列问题:
(1)基态锗原子的价层电子排布式为___________ 。
(2)“酸浸1”步骤中有利于提高浸取率的措施有___________ (答两点)。
(3)“浸液1”中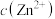 约为
约为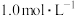 ,则除
,则除 时应控制pH的范围为
时应控制pH的范围为___________ (已知:当溶液中某离子浓度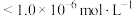 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(4)“酸浸2”时铋的氧化物( )发生反应的化学方程式为
)发生反应的化学方程式为___________ 。
(5)固态 为
为___________ 晶体,“操作Ⅰ”分离获得液态 所使用的装置为
所使用的装置为___________ (填标号)。
A. B.
B.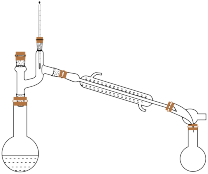 C.
C.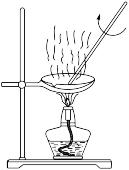
为了提高 的纯度,在所选装置的基础上进行改进,方法是
的纯度,在所选装置的基础上进行改进,方法是___________ 。
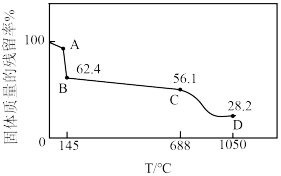
(6)隔绝空气加热 固体,固体质量的残留率与温度的关系如图所示。已知C→D的过程中产生两种气体,写出该过程的化学方程式
固体,固体质量的残留率与温度的关系如图所示。已知C→D的过程中产生两种气体,写出该过程的化学方程式___________ 。

已知:①该工艺条件下,
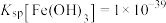 ,
, 。
。②
 的熔点为-49.5℃,沸点为84℃,其在水中或酸的稀溶液中易水解。
的熔点为-49.5℃,沸点为84℃,其在水中或酸的稀溶液中易水解。请回答下列问题:
(1)基态锗原子的价层电子排布式为
(2)“酸浸1”步骤中有利于提高浸取率的措施有
(3)“浸液1”中
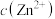 约为
约为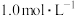 ,则除
,则除 时应控制pH的范围为
时应控制pH的范围为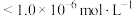 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(4)“酸浸2”时铋的氧化物(
 )发生反应的化学方程式为
)发生反应的化学方程式为(5)固态
 为
为 所使用的装置为
所使用的装置为A.
 B.
B. C.
C.
为了提高
 的纯度,在所选装置的基础上进行改进,方法是
的纯度,在所选装置的基础上进行改进,方法是(6)隔绝空气加热
 固体,固体质量的残留率与温度的关系如图所示。已知C→D的过程中产生两种气体,写出该过程的化学方程式
固体,固体质量的残留率与温度的关系如图所示。已知C→D的过程中产生两种气体,写出该过程的化学方程式
您最近一年使用:0次
2023-10-13更新
|
279次组卷
|
2卷引用:重庆市2024届高三上学期第二次质量检测化学试题
解题方法
8 . 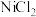 是一种重要催化剂。某科研小组以废弃催化剂(主要成分为
是一种重要催化剂。某科研小组以废弃催化剂(主要成分为 ,还含有
,还含有 等)为原料制备
等)为原料制备 晶体的工艺流程如图所示。
晶体的工艺流程如图所示。

一些难溶电解质的溶度积常数( )如下表:
)如下表:
回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为________ 。 的配合物
的配合物 存在的化学键有
存在的化学键有________ (填标号)。
a.非极性键 b.配位键 c.金属键 d.极㤦键 e.离子键
(2)滤渣1中主要有 和
和________ 。
(3)若 为
为 ,其作用是
,其作用是________ (用离子方程式表示)。 实称用量远大于理论用量,可能的原因是
实称用量远大于理论用量,可能的原因是________ 。滤液2中 ,为确保其中
,为确保其中 ,需调节
,需调节 的范围是
的范围是________ (已知: )。
)。
(4)“氟化除杂”时发现溶液酸度过高,会导致 和
和 沉淀不完全,从化学平衡移动的角度分析,其原因是
沉淀不完全,从化学平衡移动的角度分析,其原因是________ 。
(5)“沉镍”过程生成碱式碳酸镍 。为测定该沉淀的组成,称取纯净干燥沉淀样品
。为测定该沉淀的组成,称取纯净干燥沉淀样品 ,隔绝空气加热,该化合物的热重曲线如图所示,
,隔绝空气加热,该化合物的热重曲线如图所示, 以上固体质量不再变化。通过计算确定该沉淀的化学式为
以上固体质量不再变化。通过计算确定该沉淀的化学式为________ 。

(6)将所得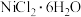 与
与 混合加热可制备无水
混合加热可制备无水 并得到两种酸性气体,反应的化学方程式为
并得到两种酸性气体,反应的化学方程式为________ 。
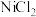 是一种重要催化剂。某科研小组以废弃催化剂(主要成分为
是一种重要催化剂。某科研小组以废弃催化剂(主要成分为 ,还含有
,还含有 等)为原料制备
等)为原料制备 晶体的工艺流程如图所示。
晶体的工艺流程如图所示。
一些难溶电解质的溶度积常数(
 )如下表:
)如下表:难溶电解质 |
|
|
|
|
|
|
|
|
|
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 的配合物
的配合物 存在的化学键有
存在的化学键有a.非极性键 b.配位键 c.金属键 d.极㤦键 e.离子键
(2)滤渣1中主要有
 和
和(3)若
 为
为 ,其作用是
,其作用是 实称用量远大于理论用量,可能的原因是
实称用量远大于理论用量,可能的原因是 ,为确保其中
,为确保其中 ,需调节
,需调节 的范围是
的范围是 )。
)。(4)“氟化除杂”时发现溶液酸度过高,会导致
 和
和 沉淀不完全,从化学平衡移动的角度分析,其原因是
沉淀不完全,从化学平衡移动的角度分析,其原因是(5)“沉镍”过程生成碱式碳酸镍
 。为测定该沉淀的组成,称取纯净干燥沉淀样品
。为测定该沉淀的组成,称取纯净干燥沉淀样品 ,隔绝空气加热,该化合物的热重曲线如图所示,
,隔绝空气加热,该化合物的热重曲线如图所示, 以上固体质量不再变化。通过计算确定该沉淀的化学式为
以上固体质量不再变化。通过计算确定该沉淀的化学式为
(6)将所得
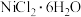 与
与 混合加热可制备无水
混合加热可制备无水 并得到两种酸性气体,反应的化学方程式为
并得到两种酸性气体,反应的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 将废旧锌锰电池进行回收处理以实现资源的再生利用,初步处理后的废料中含有MnO2、MnOOH Zn(OH)2、及Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:(已知: Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH大于5.5时易被氧化)。下列说法正确的是


| A.Mn原子的基态电子排布图为[Ar]3d54s2 |
| B.“酸浸”步骤中的离子反应方程式为Fe+MnO2+4H+=Fe2++Mn2++2H2O |
| C.“净化”时通入O2是为了氧化Fe2+,加入MnCO3时必须控制pH小于5.5 |
| D.“电解”时的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+ |
您最近一年使用:0次
名校
解题方法
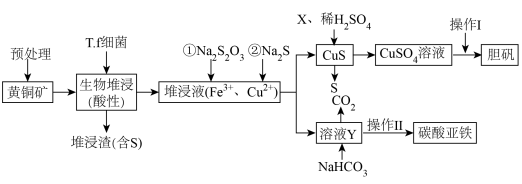
10 . 工业上,处理低品位黄铜矿( 含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
已知:①硫杆菌(T.f细菌)在 为
为 范围内可保持活性。
范围内可保持活性。
②金属离子沉淀的 如下表。
如下表。
回答下列问题:
(1) 中各元素均显常见价态且铜显最高价,则铁显
中各元素均显常见价态且铜显最高价,则铁显___________ 价;预处理的内容包括矿石的筛选、___________ 。
(2)生物堆浸(在空气环境中)过程中,溶液的 范围应控制在
范围应控制在___________ 较好;生物堆浸主要涉及两个反应:①___________ (写离子方程式),②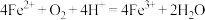 。
。
(3)堆浸液中加入 固体会还原
固体会还原 得到溶液
得到溶液 ,该反应
,该反应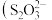 被氧化为
被氧化为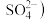 的氧化剂与还原剂物质的量之比为
的氧化剂与还原剂物质的量之比为___________ ,X是常用的绿色氧化剂,如 、
、___________ 。
(4)“操作I”是___________ 、过滤、洗涤、干燥。
(5)写出生成 的化学方程式:
的化学方程式:___________ 。
 含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
已知:①硫杆菌(T.f细菌)在
 为
为 范围内可保持活性。
范围内可保持活性。②金属离子沉淀的
 如下表。
如下表。 |  |  | |
开始沉淀时的 | 1.5 | 4.2 | 6.3 |
完全沉淀时的 | 2.8 | 6.7 | 8.3 |
(1)
 中各元素均显常见价态且铜显最高价,则铁显
中各元素均显常见价态且铜显最高价,则铁显(2)生物堆浸(在空气环境中)过程中,溶液的
 范围应控制在
范围应控制在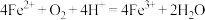 。
。(3)堆浸液中加入
 固体会还原
固体会还原 得到溶液
得到溶液 ,该反应
,该反应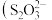 被氧化为
被氧化为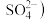 的氧化剂与还原剂物质的量之比为
的氧化剂与还原剂物质的量之比为 、
、(4)“操作I”是
(5)写出生成
 的化学方程式:
的化学方程式:
您最近一年使用:0次