用某铜矿(主要含CuS、FeO)制备 的一种工艺流程如图:
的一种工艺流程如图:
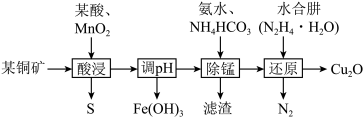
已知:①常温下,
②常温下,金属离子浓度小于 时,认为沉淀完全;
时,认为沉淀完全;
③水合肼溶液呈碱性。
请回答下列问题:
(1)基态O的电子排布图为______ 。
(2)“酸浸”时加入的某酸常选择______ (填化学式),加入酸溶解后,再加入 发生的主要离子方程式为
发生的主要离子方程式为______ 。
(3)根据表格数据,调节pH的最大值为______ ,此时溶液中 的浓度为
的浓度为______ 。
(4)用化学用语表示水合肼溶液呈碱性的原因:______ 。
(5)“还原”前Cu元素以 的形式存在,写出还原过程中的离子方程式:
的形式存在,写出还原过程中的离子方程式:______ 。
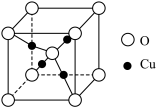
(6) 立方晶胞结构如图所示,则
立方晶胞结构如图所示,则 的配位数为
的配位数为______ ;若该氧化物的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
______  (列出计算式)。
(列出计算式)。
 的一种工艺流程如图:
的一种工艺流程如图:
已知:①常温下,
金属氢氧化物 |
|
|
|
|
开始沉淀的pH | 1.9 | 7.5 | 5.0 | 8.8 |
沉淀完全的pH | 3.2 | 9.7 | 6.5 | 10.4 |
 时,认为沉淀完全;
时,认为沉淀完全;③水合肼溶液呈碱性。
请回答下列问题:
(1)基态O的电子排布图为
(2)“酸浸”时加入的某酸常选择
 发生的主要离子方程式为
发生的主要离子方程式为(3)根据表格数据,调节pH的最大值为
 的浓度为
的浓度为(4)用化学用语表示水合肼溶液呈碱性的原因:
(5)“还原”前Cu元素以
 的形式存在,写出还原过程中的离子方程式:
的形式存在,写出还原过程中的离子方程式:(6)
 立方晶胞结构如图所示,则
立方晶胞结构如图所示,则 的配位数为
的配位数为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
 (列出计算式)。
(列出计算式)。
更新时间:2024-04-03 17:42:24
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业上以软锰矿(主要成分为 ,还含有少量
,还含有少量 等)和辉铜矿(主要成分为
等)和辉铜矿(主要成分为 ,还含有少量
,还含有少量 等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。
等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。 萃取
萃取 的原理为
的原理为 (
( 为有机相)。
为有机相)。
回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是___________ (答出一条即可);已知浸出渣中含有单质S,写出“酸浸”时 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(2)“萃取”后的溶液中 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度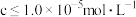 时,可认为已除尽,已知“调
时,可认为已除尽,已知“调 除镍”时应控制溶液
除镍”时应控制溶液 的最小值是1.8,最大值是5.8,则
的最小值是1.8,最大值是5.8,则
___________ [已知 ,该溶液中
,该溶液中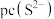 和
和 的关系为
的关系为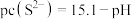 ;忽略溶液体积变化]。
;忽略溶液体积变化]。
(3)写出“碳化沉锰”过程中发生反应的离子方程式:___________ 。
(4)试剂X为___________ (填化学式);“系列操作”包括___________ 、过滤、洗涤和干燥。
(5) 在空气中加热分解时,每一步所得固体为纯净物,
在空气中加热分解时,每一步所得固体为纯净物,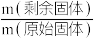 随温度变化如图所示。
随温度变化如图所示。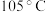 时,剩余固体的化学式为
时,剩余固体的化学式为___________ 。
②写出温度高于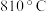 时反应的化学方程式:
时反应的化学方程式:___________ 。
 ,还含有少量
,还含有少量 等)和辉铜矿(主要成分为
等)和辉铜矿(主要成分为 ,还含有少量
,还含有少量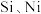 等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。
等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。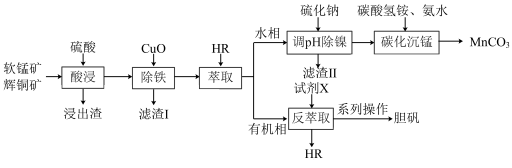
 萃取
萃取 的原理为
的原理为 (
( 为有机相)。
为有机相)。回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是
 与
与 反应的离子方程式:
反应的离子方程式:(2)“萃取”后的溶液中
 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度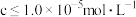 时,可认为已除尽,已知“调
时,可认为已除尽,已知“调 除镍”时应控制溶液
除镍”时应控制溶液 的最小值是1.8,最大值是5.8,则
的最小值是1.8,最大值是5.8,则
 ,该溶液中
,该溶液中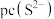 和
和 的关系为
的关系为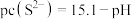 ;忽略溶液体积变化]。
;忽略溶液体积变化]。(3)写出“碳化沉锰”过程中发生反应的离子方程式:
(4)试剂X为
(5)
 在空气中加热分解时,每一步所得固体为纯净物,
在空气中加热分解时,每一步所得固体为纯净物,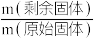 随温度变化如图所示。
随温度变化如图所示。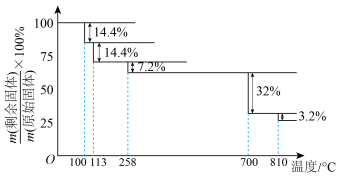
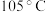 时,剩余固体的化学式为
时,剩余固体的化学式为②写出温度高于
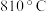 时反应的化学方程式:
时反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
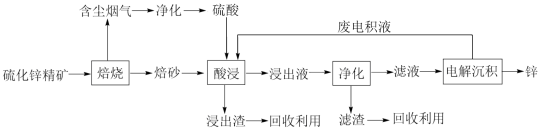
回答下列问题:
(1)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:_______ ;“含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的 =
=_______ 。[已知:Ka1(H2SO3)=l。4×10-2;Ka2(H2SO3)=6.0×10-8]
(2)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为_______ (填化学式),分离“滤液”'“滤渣”的操作名称为_______ 。
(3)在该流程中可循环使用的物质是Zn和_______ (填化学式)。
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是_______ (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=_______ 。[已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]
(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2+ Zn+(1+
Zn+(1+ )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
[ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为_______ 。

回答下列问题:
(1)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:
 =
=(2)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为
(3)在该流程中可循环使用的物质是Zn和
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq)
 CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2+
 Zn+(1+
Zn+(1+ )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
[ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
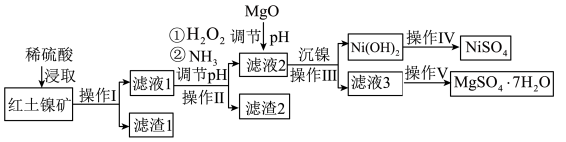
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;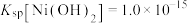 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入 的作用是
的作用是___________ (用离子反应方程式表示)。
(2)操作Ⅱ为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是___________ 。
(3)“滤液1”中是否存在 ,可用
,可用___________ 检验。
(4)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________  。
。
(5)操作V是___________ 、过滤、洗涤。
(6) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为___________ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;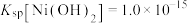 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全(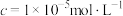 )时的pH )时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入
 的作用是
的作用是(2)操作Ⅱ为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(3)“滤液1”中是否存在
 ,可用
,可用(4)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(5)操作V是
(6)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y、Z为短周期元素,它们的单质在通常情况下均为无色气体。X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列问题:
(1)写出X的基态原子的价电子排布式_________________ ;
(2)比较X、Y两元素基态原子的第一电离能大小:X__________ Y(填“>”、“<”或“=”),理由是________ ;
(3)W、X两元素能写出一种常见气体M,每个M分子中含有10个电子,M分子中心原子的杂化方式为_________ ;WX两种元素还能写出一种常见阳离子N,每个N中也含有10个电子,但在N与M中所含化学键的键角大小不同,其原因是__________ ;
(4)Z2+可与M分子在谁溶液中形成[Z(M)4]2+,其中M分子和Z2+通过__________ -结合;
(5)单质Z的警报结构如图所示,已知两个最近的Z原子距离为a,Z的相对原子质量用Mr表示,则该晶体密度为_______________ (只列计算式)。
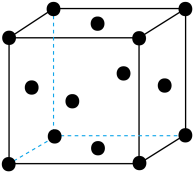
(1)写出X的基态原子的价电子排布式
(2)比较X、Y两元素基态原子的第一电离能大小:X
(3)W、X两元素能写出一种常见气体M,每个M分子中含有10个电子,M分子中心原子的杂化方式为
(4)Z2+可与M分子在谁溶液中形成[Z(M)4]2+,其中M分子和Z2+通过
(5)单质Z的警报结构如图所示,已知两个最近的Z原子距离为a,Z的相对原子质量用Mr表示,则该晶体密度为

您最近一年使用:0次
【推荐2】氨是重要的化工原料,我国目前氨的生产能力居世界首位。回答下列问题:
(1)下图为在某催化剂表面合成氨反应机理。

NH3的 VSEPR模型为___________ , 反应 的△H=
的△H=__________ kJ∙mol−1。
(2)近年来,电化学催化氮气还原合成氨的催化剂研究取得了较大发展。
①图 1所示过程中,总反应方程式为___________ 。


②TiO2通过氮掺杂反应生成TiO2−aNb,如图所示,图中1 TiO2−aNb晶体中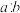 =
= ___________ 。
(3)在不同压强下,以两种不同组成进料,反应达平衡时氨的物质的量分数与温度的计算结果如下图所示。进料组成Ⅰ:
 进料组成Ⅱ:
进料组成Ⅱ: (物质i的物质的量分数:
(物质i的物质的量分数: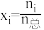 )
)

①P₁___________ 16MPa(填“>”、 “=”或“<”)。
②进料组成中不含惰性气体 Ar的图是___________ 。(图3或图4)
③图3中, 当 时, 氮气的转化率a=
时, 氮气的转化率a=___________ 。 该温度时, 反应 的平衡常数Kp=
的平衡常数Kp=____________ 。
(1)下图为在某催化剂表面合成氨反应机理。

NH3的 VSEPR模型为
 的△H=
的△H=(2)近年来,电化学催化氮气还原合成氨的催化剂研究取得了较大发展。
①图 1所示过程中,总反应方程式为


②TiO2通过氮掺杂反应生成TiO2−aNb,如图所示,图中1 TiO2−aNb晶体中
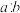 =
= (3)在不同压强下,以两种不同组成进料,反应达平衡时氨的物质的量分数与温度的计算结果如下图所示。进料组成Ⅰ:

 进料组成Ⅱ:
进料组成Ⅱ: (物质i的物质的量分数:
(物质i的物质的量分数: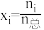 )
)
①P₁
②进料组成中不含惰性气体 Ar的图是
③图3中, 当
 时, 氮气的转化率a=
时, 氮气的转化率a= 的平衡常数Kp=
的平衡常数Kp=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
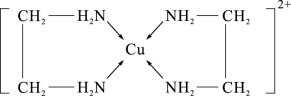
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
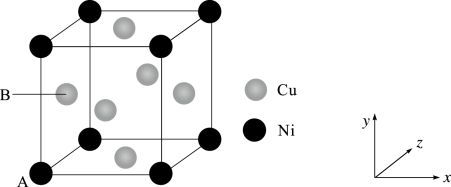
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次





