三轮冲刺2020届高三化学考题必刷——“化工流程”探究实验分析题
全国
高三
专题练习
2020-02-11
58次
整体难度:
适中
考查范围:
常见无机物及其应用、化学实验基础、化学反应原理、认识化学科学、化学与STSE
三轮冲刺2020届高三化学考题必刷——“化工流程”探究实验分析题
全国
高三
专题练习
2020-02-11
58次
整体难度:
适中
考查范围:
常见无机物及其应用、化学实验基础、化学反应原理、认识化学科学、化学与STSE
一、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
解题方法
1. 氧化钪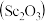 广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一:
广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一: 钪精矿主要成分是钪的氧化物,硅铁等氧化物
钪精矿主要成分是钪的氧化物,硅铁等氧化物

回答下列问题:
 滤渣I是
滤渣I是______  填化学式
填化学式 。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、
。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、______ 。
 调pH的目的是
调pH的目的是______ ,如何检验含钪粗液中不含 离子
离子______ 。
 写出制取草酸钪饼的化学方程式
写出制取草酸钪饼的化学方程式______ 。
 写出草酸钪饼在空气中灼烧的化学方程式
写出草酸钪饼在空气中灼烧的化学方程式______ ,每生成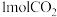 ,转移的电子数为
,转移的电子数为______ 。
 某工厂用
某工厂用 的钪精矿制备纯氧化钪,得到纯产品
的钪精矿制备纯氧化钪,得到纯产品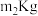 ,则钪精矿中钪的质量分数是
,则钪精矿中钪的质量分数是______  假设Sc的利用率为
假设Sc的利用率为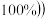 。
。
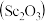 广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一:
广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一: 钪精矿主要成分是钪的氧化物,硅铁等氧化物
钪精矿主要成分是钪的氧化物,硅铁等氧化物

回答下列问题:
 滤渣I是
滤渣I是 填化学式
填化学式 。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、
。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、 调pH的目的是
调pH的目的是 离子
离子 写出制取草酸钪饼的化学方程式
写出制取草酸钪饼的化学方程式 写出草酸钪饼在空气中灼烧的化学方程式
写出草酸钪饼在空气中灼烧的化学方程式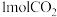 ,转移的电子数为
,转移的电子数为 某工厂用
某工厂用 的钪精矿制备纯氧化钪,得到纯产品
的钪精矿制备纯氧化钪,得到纯产品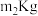 ,则钪精矿中钪的质量分数是
,则钪精矿中钪的质量分数是 假设Sc的利用率为
假设Sc的利用率为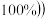 。
。
【知识点】 铁盐的检验解读 物质分离、提纯综合应用解读 物质含量的测定
您最近一年使用:0次
2020-01-07更新
|
198次组卷
|
2卷引用:2020届高三化学二轮每周大题必练— ——无机工业流程题
解答题-工业流程题
|
适中(0.65)
解题方法
2. 如图是工业上以制作印刷电路的废液 含
含 、
、 、
、 、
、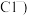 生产CuCl的流程:
生产CuCl的流程:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为______ 。
(2)滤液②需要加过量Z,检验Z过量的方法是______ 。
(3)写出生成CuCl的离子方程式:______ 。
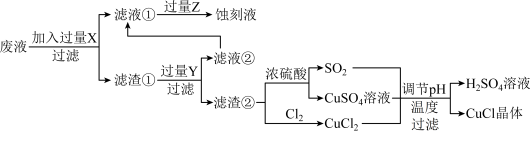
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置 图
图 中的
中的______  填选项字母
填选项字母 ,过滤后,洗涤CuCl的试剂宜选用
,过滤后,洗涤CuCl的试剂宜选用______  填“无水乙醇”或“稀硫酸”
填“无水乙醇”或“稀硫酸”
 加入饱和NaCl溶液中会部分溶解生成
加入饱和NaCl溶液中会部分溶解生成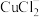 ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:
I.CuCl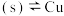
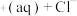
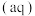
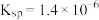
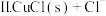
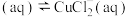
 。
。
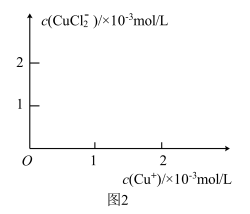
(5)分析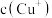 、
、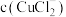 和
和 、K的数学关系,在图2中画出
、K的数学关系,在图2中画出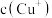 、
、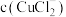 的关系曲线
的关系曲线________ (要求至少标出一个坐标点)
(6)氯化亚铜的定量分析:
①称取样品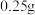 于250mL锥形瓶中,加入10mL过量的
于250mL锥形瓶中,加入10mL过量的 溶液,不断摇动:
溶液,不断摇动:
②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用 硫酸铈标准溶液滴定至绿色为终点;
硫酸铈标准溶液滴定至绿色为终点;
④重复三次,消耗硫酸铈溶液的平均体积为 。
。
上述相应化学反应为 、
、 ,则样品中CuCl的纯度为
,则样品中CuCl的纯度为______  保留三位有效数字
保留三位有效数字 。
。
 含
含 、
、 、
、 、
、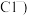 生产CuCl的流程:
生产CuCl的流程:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为
(2)滤液②需要加过量Z,检验Z过量的方法是
(3)写出生成CuCl的离子方程式:
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置
 图
图 中的
中的 填选项字母
填选项字母 ,过滤后,洗涤CuCl的试剂宜选用
,过滤后,洗涤CuCl的试剂宜选用 填“无水乙醇”或“稀硫酸”
填“无水乙醇”或“稀硫酸”

 加入饱和NaCl溶液中会部分溶解生成
加入饱和NaCl溶液中会部分溶解生成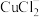 ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:I.CuCl
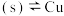
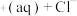
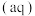
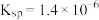
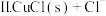
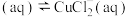
 。
。(5)分析
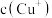 、
、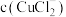 和
和 、K的数学关系,在图2中画出
、K的数学关系,在图2中画出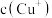 、
、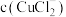 的关系曲线
的关系曲线
(6)氯化亚铜的定量分析:
①称取样品
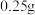 于250mL锥形瓶中,加入10mL过量的
于250mL锥形瓶中,加入10mL过量的 溶液,不断摇动:
溶液,不断摇动:②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用
 硫酸铈标准溶液滴定至绿色为终点;
硫酸铈标准溶液滴定至绿色为终点;④重复三次,消耗硫酸铈溶液的平均体积为
 。
。上述相应化学反应为
 、
、 ,则样品中CuCl的纯度为
,则样品中CuCl的纯度为 保留三位有效数字
保留三位有效数字 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
3. 合成氨是人类科学技术上的一项重大突破,其反应原理为: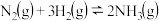 ,一种工业合成氨,进而合成尿素的简易流程图如下:
,一种工业合成氨,进而合成尿素的简易流程图如下:

(1)步骤II中制氢气原理如下:
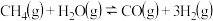
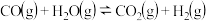
恒容容器中,对于以上反应,能加快反应速率的是______ .
 升高温度
升高温度  充入He
充入He  加入催化剂
加入催化剂 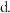 降低压强
降低压强
(2)天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为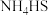 ,一定条件下向
,一定条件下向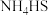 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______ .
(3) 和
和 在高温、高压、催化剂条件下可合成
在高温、高压、催化剂条件下可合成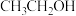 ,反应的化学方程式
,反应的化学方程式______  以
以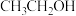 、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池中负极上的电极反应式是:
、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池中负极上的电极反应式是:______ .
(4)已知
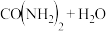 ,若合成尿素的流程中转化率为
,若合成尿素的流程中转化率为 时,100吨甲烷为原料能够合成
时,100吨甲烷为原料能够合成______ 吨尿素.
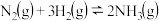 ,一种工业合成氨,进而合成尿素的简易流程图如下:
,一种工业合成氨,进而合成尿素的简易流程图如下:
(1)步骤II中制氢气原理如下:
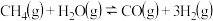
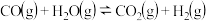
恒容容器中,对于以上反应,能加快反应速率的是
 升高温度
升高温度  充入He
充入He  加入催化剂
加入催化剂 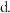 降低压强
降低压强(2)天然气中的
 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为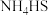 ,一定条件下向
,一定条件下向 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为(3)
 和
和 在高温、高压、催化剂条件下可合成
在高温、高压、催化剂条件下可合成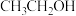 ,反应的化学方程式
,反应的化学方程式 以
以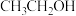 、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池中负极上的电极反应式是:
、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池中负极上的电极反应式是:(4)已知

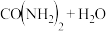 ,若合成尿素的流程中转化率为
,若合成尿素的流程中转化率为 时,100吨甲烷为原料能够合成
时,100吨甲烷为原料能够合成【知识点】 影响化学反应速率的外因 化学反应条件的控制及其应用解读
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
4. 粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为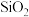 、
、 、CaO等. 一种利用粉煤灰制取氧化铝的工艺流程如下:
、CaO等. 一种利用粉煤灰制取氧化铝的工艺流程如下:

(1)粉煤灰研磨的目的是____________ .
(2)第1次过滤时滤渣的主要成分有____________  填化学式,下同
填化学式,下同 和
和____________ ,第3次过滤时滤渣的成分是____________
(3)在 用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为
用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________ h;铝的浸取率与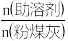 的关系如图2所示,从浸取率角度考虑,三种助溶剂
的关系如图2所示,从浸取率角度考虑,三种助溶剂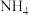 F、KF及
F、KF及 与KF的混合物,在
与KF的混合物,在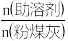 相同时,浸取率最高的是
相同时,浸取率最高的是____________  填化学式
填化学式 ;用含氟的化合物作这种助溶剂的缺点是
;用含氟的化合物作这种助溶剂的缺点是____________  举一例
举一例 .
.

(4)流程中循环使用的物质有____________ 和____________  填化学式
填化学式
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出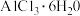 ,该过程能够发生的原因是
,该过程能够发生的原因是____________
(6)用粉煤灰制取含铝化合物的主要意义是____________ .
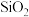 、
、 、CaO等. 一种利用粉煤灰制取氧化铝的工艺流程如下:
、CaO等. 一种利用粉煤灰制取氧化铝的工艺流程如下: 
(1)粉煤灰研磨的目的是
(2)第1次过滤时滤渣的主要成分有
 填化学式,下同
填化学式,下同 和
和(3)在
 用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为
用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为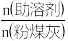 的关系如图2所示,从浸取率角度考虑,三种助溶剂
的关系如图2所示,从浸取率角度考虑,三种助溶剂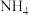 F、KF及
F、KF及 与KF的混合物,在
与KF的混合物,在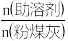 相同时,浸取率最高的是
相同时,浸取率最高的是 填化学式
填化学式 ;用含氟的化合物作这种助溶剂的缺点是
;用含氟的化合物作这种助溶剂的缺点是 举一例
举一例 .
.
(4)流程中循环使用的物质有
 填化学式
填化学式
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出
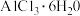 ,该过程能够发生的原因是
,该过程能够发生的原因是(6)用粉煤灰制取含铝化合物的主要意义是
您最近一年使用:0次
二、填空题 添加题型下试题
填空题
|
较难(0.4)
5. 2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________ ;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________ ;操作Ⅱ为洗涤,洗涤操作的具体方法为__________ ;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式:__________ ;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________ (填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________ 。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式:
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为
您最近一年使用:0次
2016-03-02更新
|
247次组卷
|
7卷引用:2016届贵州省遵义航天高级中学高三上第七次模拟理综化学试卷
2016届贵州省遵义航天高级中学高三上第七次模拟理综化学试卷山东省淄博市第七中学2019-2020学年高三上学期第一次月考化学试题2020届高考化学二轮复习大题精准训练——简答题中的酸碱中和滴定及拓展三轮冲刺2020届高三化学考题必刷——“化工流程”探究实验分析题(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精练)——2021年高考化学一轮复习讲练测(已下线)第三章 金属及其化合物 第14练 铁及其化合物的转化关系
填空题
|
困难(0.15)
6. 辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
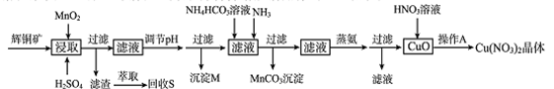
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式__________ 。
(2)调节pH的目的是___________ ,pH的调节范围为___________ 。
(3)生成MnCO3沉淀的离子方程式为___________ 。
(4)操作A为___________ 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___________ 。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备__________ mol无水Cu(NO3)2。(计算结果精确到小数点后1位)

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式
(2)调节pH的目的是
(3)生成MnCO3沉淀的离子方程式为
(4)操作A为
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备
您最近一年使用:0次
2016-03-18更新
|
594次组卷
|
3卷引用:2016届四川省眉山广安等四市高三上学期第一次诊断性联考理综化学试卷



