解题方法
1 . 钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、
Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:

部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有_______
(2)反应②碱浸后滤出的固体主要成分是_______ (写化学式)。
(3)反应④的离子方程式为_______
(4)250C、101 kPa时,
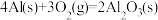
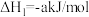


用V2O5发生铝热反应冶炼金属钒的热化学方程式是______ 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为______ ,电池充电时阳极的电极反应式是_____________ 。

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2 VO2++ H2C2O4+2 H+=2 VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(V02)2S04溶液中钒的含量为_________ g/L。
Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:

部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有
(2)反应②碱浸后滤出的固体主要成分是
(3)反应④的离子方程式为
(4)250C、101 kPa时,
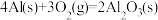
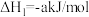


用V2O5发生铝热反应冶炼金属钒的热化学方程式是
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2 VO2++ H2C2O4+2 H+=2 VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(V02)2S04溶液中钒的含量为
您最近一年使用:0次
解题方法
2 . 四川省钙芒硝矿(主要成分CaSO4•Na2SO4)资源丰富。钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),其简要生产流程如下图所示。
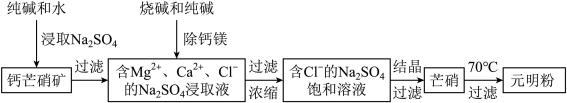
请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是_________________________ 。
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①________ 、②_________ (填化学式)被过滤除去。
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是___________________________________________________________________________ 。

(4)已知:25℃、101kPa时,
2C(s) + O2(g) ==2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) == 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) == 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是__________________________________________________ 。
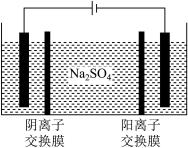
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:______________________________ 。
(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是________ kg。

请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是

(4)已知:25℃、101kPa时,
2C(s) + O2(g) ==2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) == 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) == 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:

(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是
您最近一年使用:0次
解题方法
3 . 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:

(1)Ⅱ相对于Ⅰ的优点是______________________________ 。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________ 。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________ 。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________ (可以写表达式)。
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH="+8." 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH="+90." 4 kJ·mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸 |

(1)Ⅱ相对于Ⅰ的优点是
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=
您最近一年使用:0次



