某工厂采用联合焙烧法以辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)为原料制备BiOCl和MnSO4,工艺流程如下:
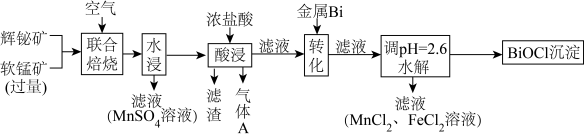
已知:①焙烧时过量的MnO2分解为Mn2O3,Bi2S3、FeS2转变为Bi2O3、Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③常温下,相关金属离子形成氢氧化物的pH范围如下:
回答下列问题:
(1)写出“联合焙烧”时MnO2和Bi2S3反应生成MnSO4的化学方程式:_______ 。
(2)Bi2S3在空气中单独焙烧生成Bi2O3,同时产生一种气体产物,若用过量的NaOH溶液吸收该气体,则所得溶液的溶质为_______ 。
(3)“酸浸”时Mn2O3转化为MnCl2,则生成的气体A为_______ (填化学式)。
(4)“转化”时加入金属Bi的目的是_______ (用离子方程式表示)。
(5)若沉淀完全时溶液中的金属离子浓度为10−5 mol⋅L−1,则由表中数据计算可得:Ksp[Fe(OH)3]=_______ 。
(6)水解生成BiOCl的离子方程式为_______ 。
(7)若取10 kg铋含量为79.42%的辉铋矿,经过上述流程(铋元素在整个流程中损失率为5%),某同学经计算可制得BiOCl固体的质量约为9.40 kg,该同学的计算结果_______ (填“正确”或“不正确”),理由是_______ 。

已知:①焙烧时过量的MnO2分解为Mn2O3,Bi2S3、FeS2转变为Bi2O3、Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③常温下,相关金属离子形成氢氧化物的pH范围如下:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe2+ | 6.3 | 8.3 |
| Fe³+ | 1.6 | 3.1 |
| Mn2+ | 8.1 | 10.1 |
回答下列问题:
(1)写出“联合焙烧”时MnO2和Bi2S3反应生成MnSO4的化学方程式:
(2)Bi2S3在空气中单独焙烧生成Bi2O3,同时产生一种气体产物,若用过量的NaOH溶液吸收该气体,则所得溶液的溶质为
(3)“酸浸”时Mn2O3转化为MnCl2,则生成的气体A为
(4)“转化”时加入金属Bi的目的是
(5)若沉淀完全时溶液中的金属离子浓度为10−5 mol⋅L−1,则由表中数据计算可得:Ksp[Fe(OH)3]=
(6)水解生成BiOCl的离子方程式为
(7)若取10 kg铋含量为79.42%的辉铋矿,经过上述流程(铋元素在整个流程中损失率为5%),某同学经计算可制得BiOCl固体的质量约为9.40 kg,该同学的计算结果
更新时间:2023-01-04 21:40:43
|
相似题推荐
解答题-实验探究题
|
困难
(0.15)
【推荐1】某化学探究小组拟用废铜屑制取Cu(NO3)2:,并探究其化学性质。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。

(1)写出铜与浓硝酸反应的离子方程式。
(2)①装置中NaOH溶液的作用是。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、、过滤。
③你认为此装置是否合理,并说明原因。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究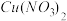 的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
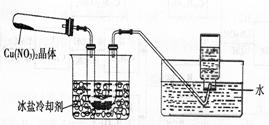
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2:晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U形管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是。
②根据现象判断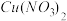 在加热条件下可以分解,其化学反应方程式为。
在加热条件下可以分解,其化学反应方程式为。
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
(4)滤液中可能含有 ,写出检验
,写出检验 的方法。
的方法。
(5)95℃时,样品颜色发暗的原因:____。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。

(1)写出铜与浓硝酸反应的离子方程式。
(2)①装置中NaOH溶液的作用是。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、、过滤。
③你认为此装置是否合理,并说明原因。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究
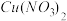 的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)【实验装置】

【实验操作及现象】往试管中放入研细的无水Cu(NO3)2:晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U形管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是。
②根据现象判断
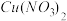 在加热条件下可以分解,其化学反应方程式为。
在加热条件下可以分解,其化学反应方程式为。Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜 的质量分数/% | 90.9 | 92.7 | x | 92.0 |
 ,写出检验
,写出检验 的方法。
的方法。(5)95℃时,样品颜色发暗的原因:____。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
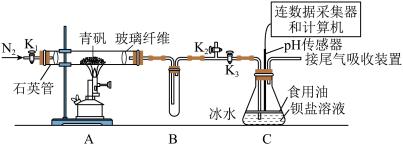
【推荐2】某实验小组利用如图装置模拟古法制硫酸并进行 性质探究。
性质探究。
已知:①“青矾”是指 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;
② 熔点
熔点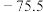 ℃,沸点
℃,沸点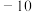 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。
请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。
(1)加热时A装置中发生反应的化学方程式为_____ 。
(2)B装置的作用是_____ 。
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:_____ 。
Ⅱ.探究 的性质
的性质
在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:
分别得到如下 图:
图:

(4)实验①中,曲线呈缓慢下降趋势,原因是_____ 。(用方程式表示)
(5)对比分析②③数据,可得出的结论是_____ 。
Ⅲ. 含量的测定
含量的测定
(6)为对排气法收集到的 气体进行含量测定,将
气体进行含量测定,将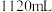 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀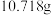 ,则
,则 体的体积分数为
体的体积分数为_____ 。若该实验数据较实际值偏大,则可能的原因是_____ 。
①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有 ④未用食用油覆盖液面
④未用食用油覆盖液面
Ⅳ、 的应用
的应用
 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是_____ (用离子方程式表示)。
(8)实验结束后,进行样品纯度的测定。称取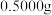 硫代硫酸钠晶体
硫代硫酸钠晶体 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用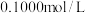 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为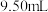 ,则该样品的纯度为
,则该样品的纯度为_____ (保留四位小数)。
已知: ,样品中杂质不参与反应。
,样品中杂质不参与反应。
(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度_____ (“偏高”、“偏低”或“无影响”)。
 性质探究。
性质探究。
已知:①“青矾”是指
 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;②
 熔点
熔点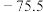 ℃,沸点
℃,沸点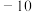 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞
 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。(1)加热时A装置中发生反应的化学方程式为
(2)B装置的作用是
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:
Ⅱ.探究
 的性质
的性质在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入
 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:| 实验 | ① | ② | ③ |
| 所加试剂 | 已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 | 已煮沸的 溶液 溶液 |
| 实验现象 | 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |
 图:
图:
(4)实验①中,曲线呈缓慢下降趋势,原因是
(5)对比分析②③数据,可得出的结论是
Ⅲ.
 含量的测定
含量的测定(6)为对排气法收集到的
 气体进行含量测定,将
气体进行含量测定,将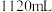 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀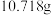 ,则
,则 体的体积分数为
体的体积分数为①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有
 ④未用食用油覆盖液面
④未用食用油覆盖液面Ⅳ、
 的应用
的应用 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是
(8)实验结束后,进行样品纯度的测定。称取
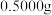 硫代硫酸钠晶体
硫代硫酸钠晶体 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用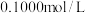 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为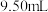 ,则该样品的纯度为
,则该样品的纯度为已知:
 ,样品中杂质不参与反应。
,样品中杂质不参与反应。(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
【推荐3】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4•2H2O工艺流程如下
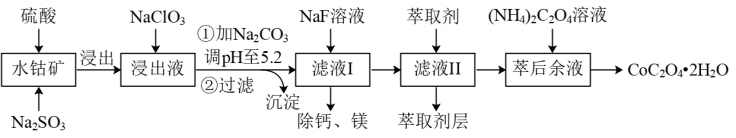
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________ ,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
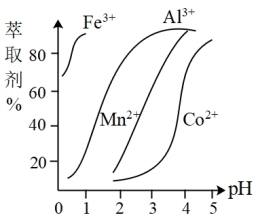
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________ ;其使用的适宜pH范围是_____ .
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______ .
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O4•2H2O,最终得到产品 m2 kg,产率为________________ 。(不要求得出计算结果,只需列出数字计算式)。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:
(3)浸出液中加入NaClO3的目的是
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O4•2H2O,最终得到产品 m2 kg,产率为
您最近一年使用:0次



