名校
解题方法
1 . 有机物样品在如图电炉中充分燃烧,通过测定生成的 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
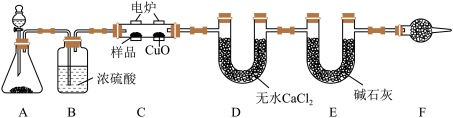
请回答下列问题:
(1)锥形瓶内的固体 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是___________ 。
(2)C装置中CuO的作用是___________ ,F装置内的试剂为___________ ,F装置的作用为___________ 。
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为___________ ,若该有机物的密度是相同条件下 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为___________ 。若该物质是一种能与Na反应的链状有机物,则它的结构简式为___________ 。
(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会___________ (填“偏大”、“偏小”或“不变”)。
 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
请回答下列问题:
(1)锥形瓶内的固体
 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是(2)C装置中CuO的作用是
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为
 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会
您最近半年使用:0次
名校
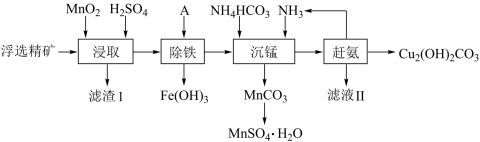
2 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿( ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示:
等杂质)为原料制备碱式碳酸铜的流程如图所示:
已知:①有关金属离子形成氢氧化物沉淀的 范围如下:
范围如下:
② 常温稳定,在热水中会分解生成
常温稳定,在热水中会分解生成 ;
;
③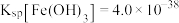 。
。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有_______ 、_______ (任写两种)。
(2)滤渣Ⅰ经 提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除
提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除 外还有
外还有_______ (填化学式)。
(3)常温下“除铁”时加入的试剂A可用 ,调节
,调节 的范围为
的范围为_______ ,若加A后将溶液的 调为5,则溶液中
调为5,则溶液中 的浓度为
的浓度为_______  。
。
(4)写出“沉锰”(除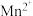 )过程中反应的离子方程式:
)过程中反应的离子方程式:_______ 。
(5)“赶氨”时,最适宜的操作方法是_______ 。
 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示:
等杂质)为原料制备碱式碳酸铜的流程如图所示:
已知:①有关金属离子形成氢氧化物沉淀的
 范围如下:
范围如下:②
 常温稳定,在热水中会分解生成
常温稳定,在热水中会分解生成 ;
;③
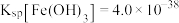 。
。| 金属离子 |  | 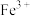 | 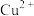 |  |
开始沉淀的 | 7.2 | 2.7 | 5.6 | 8.3 |
完全沉淀的 | 9.0 | 3.7 | 6.7 | 9.8 |
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣Ⅰ经
 提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除
提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除 外还有
外还有(3)常温下“除铁”时加入的试剂A可用
 ,调节
,调节 的范围为
的范围为 调为5,则溶液中
调为5,则溶液中 的浓度为
的浓度为 。
。(4)写出“沉锰”(除
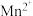 )过程中反应的离子方程式:
)过程中反应的离子方程式:(5)“赶氨”时,最适宜的操作方法是
您最近半年使用:0次
名校
解题方法
3 . 工业上两次转化法从天青石矿(主要成分 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。
(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品 。滤液中
。滤液中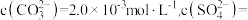
_________  。[已知:
。[已知: ]
]
②酸化:用稀盐酸浸泡粗品 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为_________ (催化剂氯化铵参与了 与盐酸生成
与盐酸生成 的反应)。
的反应)。
③除杂。
ⅰ)除铁、铝:向 粗溶液中加入少量的
粗溶液中加入少量的 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在_________ 范围内,充分搅拌,过滤。
已知:相关金属离子生成氢氧化物沉淀的 如下表所示,
如下表所示, 为7.8时
为7.8时 沉淀开始溶解。
沉淀开始溶解。
ⅱ)除钙:取ⅰ中滤液,逐滴加入适量稀 溶液。
溶液。
请补充完整去除 的后续实验操作:
的后续实验操作:_________ ,得到较纯净的 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,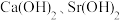 的溶解度分别为
的溶解度分别为 、
、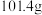 。
。
(2)二次转化。向 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。
①写出沉淀过程中发生反应的化学方程式:_________ 。
②锶转化率随温度的变化如图所示。当反应温度大于 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是_________ 。

 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品
 。滤液中
。滤液中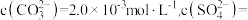
 。[已知:
。[已知: ]
]②酸化:用稀盐酸浸泡粗品
 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为 与盐酸生成
与盐酸生成 的反应)。
的反应)。③除杂。
ⅰ)除铁、铝:向
 粗溶液中加入少量的
粗溶液中加入少量的 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在已知:相关金属离子生成氢氧化物沉淀的
 如下表所示,
如下表所示, 为7.8时
为7.8时 沉淀开始溶解。
沉淀开始溶解。| 物质 |  |  |  |  | 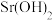 |
开始沉淀 | 1.9 | 7.0 | 3.4 | - | - |
完全沉淀 | 3.2 | 9.0 | 4.7 | 12 | - |
 溶液。
溶液。请补充完整去除
 的后续实验操作:
的后续实验操作: 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,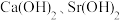 的溶解度分别为
的溶解度分别为 、
、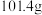 。
。(2)二次转化。向
 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。①写出沉淀过程中发生反应的化学方程式:
②锶转化率随温度的变化如图所示。当反应温度大于
 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是
您最近半年使用:0次
2022-11-12更新
|
584次组卷
|
4卷引用:江苏省盐城市2023届高三上学期期中考试化学试题
名校
解题方法
4 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮。
①人工固氮,将N2→NH3,N2发生___ 反应(填“氧化”或“还原”)
②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3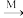 Ca(NO3)2。
Ca(NO3)2。
写出NO→NO2→HNO3的化学方程式___ 、___ 。
将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___ (写化学式)。
(2)科学合理地保存、施用氮肥。
①NH4HCO3需阴凉处保存,原因是___ (写化学方程式)。
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式___ 。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如图所示(转化所需试剂及条件已略去):
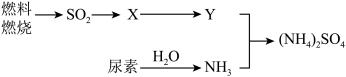
①Y与NH3反应生成(NH4)2SO4的化学方程式___ 。
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3。则尿素中C元素化合价为___ 。
(1)将N2转化为含氮化合物的过程称为固氮。
①人工固氮,将N2→NH3,N2发生
②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3
 Ca(NO3)2。
Ca(NO3)2。写出NO→NO2→HNO3的化学方程式
将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M
(2)科学合理地保存、施用氮肥。
①NH4HCO3需阴凉处保存,原因是
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如图所示(转化所需试剂及条件已略去):

①Y与NH3反应生成(NH4)2SO4的化学方程式
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3。则尿素中C元素化合价为
您最近半年使用:0次
名校
解题方法
5 . 纯碱工业始于 18 世纪末,至今已有两百多年。在纯碱工业史上,比利时人索尔维,中国人侯德榜等都作出了突出的贡献。据此完成下面小题。
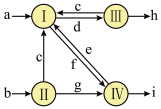
1.下图是1861年索尔维发明的制碱法中物质转化关系图,其中I~IV代表四个主要化学反应,a~i代表除H2O以外不同的物质。若不计其他损耗,,下列说法正确的是( )
2.从母液中析出的NaHCO3中含有NH4Cl,需洗涤后再进行灼烧。若省略洗涤操作,则最终对所得纯碱纯度影响叙述正确的是( )
3.化工专家侯德榜发明的"侯氏制碱法"大大推进了纯碱工业的发展,其最重要贡献是( )
1.下图是1861年索尔维发明的制碱法中物质转化关系图,其中I~IV代表四个主要化学反应,a~i代表除H2O以外不同的物质。若不计其他损耗,,下列说法正确的是( )

| A.水溶液呈碱性的物质只有e、g、h |
| B.水溶液呈酸性的物质只有c、f、i |
| C.每消耗1mol a,同时消耗0.5mol b |
| D.每消耗1mol h,同时消耗0.5mol i |
| A.无明显影响 | B.NH4Cl杂质含量上升 |
| C.NaCl杂质含量上升 | D.NaOH杂质含量上升 |
| A.找到了新型高效的催化剂 | B.充分利用了能量 |
| C.提高了纯碱产品的纯度 | D.提升了Na+的利用率 |
您最近半年使用:0次
17-18高三上·北京·期中
名校
解题方法
6 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
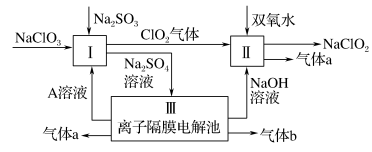
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____ 。
(3)Ⅲ中离子隔膜电解池的装置如下:
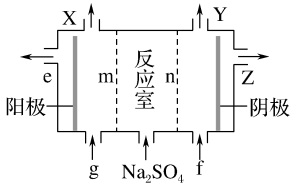
①A的化学式是________ ,A在____ 口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____ 。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。

(1)Ⅰ中发生反应的还原剂是
(2)Ⅱ中反应的离子方程式是
(3)Ⅲ中离子隔膜电解池的装置如下:

①A的化学式是
②m为
③结合化学用语和文字说明解释NaOH产生的原因:
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者
您最近半年使用:0次
13-14高一下·辽宁鞍山·期末
名校
解题方法
7 . 地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面根据海水资源综合利用,请回答下列问题:
(1)淡化海水的方法有________________ (写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________ (填化学式),之后________ (填操作名称),再加入适量________ (填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)由无水MgCl2制取金属镁的常用工业方法是__________________ 。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是__________ 。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,写出反应的离子方程式____________ 。再H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________ 。
(1)淡化海水的方法有
(2)由无水MgCl2制取金属镁的常用工业方法是
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,写出反应的离子方程式
您最近半年使用:0次
2018-07-03更新
|
145次组卷
|
5卷引用:2013-2014学年辽宁省鞍山市高一下学期期末考试化学(A卷)试卷
(已下线)2013-2014学年辽宁省鞍山市高一下学期期末考试化学(A卷)试卷2014-2015学年湖北省枣阳一中高一下学期第三次月检考试化学试卷【全国百强校】新疆生产建设兵团第二中学2017-2018学年高一下学期期末考试化学试题山东济南市历城第二中学2019-2020学年高一下学期开学考试化学试题河南省林州市第一中学2022-2023学年高二上学期开学考试化学试题
解题方法
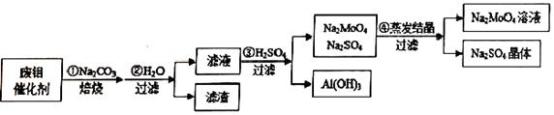
8 . 钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:
回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________ 。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________ 和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________ 。
(3)第③步操作H2SO4需要适量,通常是通过_________ 来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________ (填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________ 。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______ 。

回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:
(2)第②步操作所后的滤液中,溶质有Na2MoO4、
(3)第③步操作H2SO4需要适量,通常是通过
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为
您最近半年使用:0次
解题方法
9 . I.垃圾是放错地方的资源,工业废料也可以再利用,某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液,硝酸铜晶体和铁红(Fe2O3)。实验方案如下:
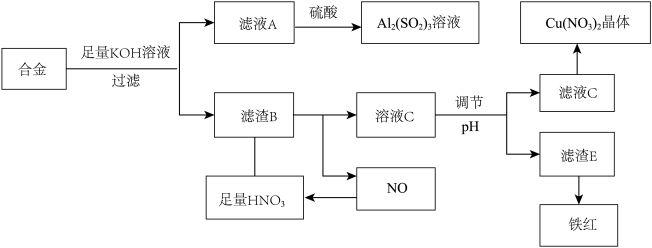
(1)已知Fe(OH)3沉淀的pH范围是3-4,溶液C通过调节pH可以使Fe3+沉淀完全,下列物质中可用作调整溶液C的pH的试剂是___________ (填序号)
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(2)常温下,若溶液C中金属离子均为1mol/L,Ksp[Fe(OH)3]=1.0×10-39,Ksp[Cu(OH)2]=2.2×10-20,控制pH=4,溶液中c(Fe3+)=___________ ,此时___________ (填“有” 或“无”)Cu(OH)2沉淀生成。
(3)将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为___________ 。
Ⅱ.工业上以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定晶体中,MgSO4的含量,具体过程如下:
将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH值,静置后过滤,除去滤渣将滤液结晶得硫酸镁晶体。
(4)加入H2O2的目的是___________ (用离子方程式解释)
(5)常采用下列方法测定硫酸镁晶体中MgSO4的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2+)原形成配合物。
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来:Zn2++MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.5g加入过量的EDTA配成100mLpH 在9~10之间溶液A
步骤2:准确移取25.00mL:溶液A于锥形瓶中,用0.1000mol/LZn2+标准溶液滴定,滴定到终点时,消耗Zn2+标准溶液的体积为20.00mL
步骤3:另外准确移取25.00mL溶液A于另一只锥形瓶中调节pH在5~6,用0.1000mol/LZn2+标准溶液滴定,滴定至终点时,消耗Zn2+标准溶液的体积为30.00mL。
计算该晶体中MgSO4的质量分数为___________ 。

(1)已知Fe(OH)3沉淀的pH范围是3-4,溶液C通过调节pH可以使Fe3+沉淀完全,下列物质中可用作调整溶液C的pH的试剂是
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(2)常温下,若溶液C中金属离子均为1mol/L,Ksp[Fe(OH)3]=1.0×10-39,Ksp[Cu(OH)2]=2.2×10-20,控制pH=4,溶液中c(Fe3+)=
(3)将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为
Ⅱ.工业上以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定晶体中,MgSO4的含量,具体过程如下:
将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH值,静置后过滤,除去滤渣将滤液结晶得硫酸镁晶体。
(4)加入H2O2的目的是
(5)常采用下列方法测定硫酸镁晶体中MgSO4的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2+)原形成配合物。
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来:Zn2++MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.5g加入过量的EDTA配成100mLpH 在9~10之间溶液A
步骤2:准确移取25.00mL:溶液A于锥形瓶中,用0.1000mol/LZn2+标准溶液滴定,滴定到终点时,消耗Zn2+标准溶液的体积为20.00mL
步骤3:另外准确移取25.00mL溶液A于另一只锥形瓶中调节pH在5~6,用0.1000mol/LZn2+标准溶液滴定,滴定至终点时,消耗Zn2+标准溶液的体积为30.00mL。
计算该晶体中MgSO4的质量分数为
您最近半年使用:0次
解题方法
10 . 金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S=6Cu+SO2
该反应的氧化剂是_________ ,当生成19.2gCu时,反应中转移的电子为_____ mol。铜在潮湿的空气中能发生吸氧腐蚀而生成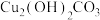 (碱式碳酸同)。该过程负极的电极反应式
(碱式碳酸同)。该过程负极的电极反应式_______________ 。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体 陶瓷(可传导
陶瓷(可传导 )为电解质,其原理如图所示:
)为电解质,其原理如图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在_______ 。
a.100 ℃以下 b.100 ℃~300 ℃ c.300 ℃~350 ℃ d.350 ℃~2050 ℃
②放电时,电极A为____ 极,S发生_______ 反应。
③放电时,内电路中的 的移动方向为
的移动方向为_______ (填“从A到B”或“从B到A”)。
④充电时,总反应为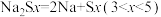 ,钠所在电极与直流电源
,钠所在电极与直流电源_______ 极相连,阳极的电极反应式为________ .
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S=6Cu+SO2
该反应的氧化剂是
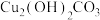 (碱式碳酸同)。该过程负极的电极反应式
(碱式碳酸同)。该过程负极的电极反应式(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠
 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体 陶瓷(可传导
陶瓷(可传导 )为电解质,其原理如图所示:
)为电解质,其原理如图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在
| 物质 |
|
|
|
| 熔点/ ℃ | 97.8 | 115 | 2050 |
| 沸点/ ℃ | 892 | 444.6 | 2980 |
②放电时,电极A为
③放电时,内电路中的
 的移动方向为
的移动方向为④充电时,总反应为
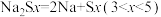 ,钠所在电极与直流电源
,钠所在电极与直流电源
您最近半年使用:0次
2016-12-09更新
|
385次组卷
|
3卷引用:2015届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷
2015届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷2015届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷(已下线)寒假作业09 电解池 金属的腐蚀与防护-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)





