名校
1 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿( ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示:
等杂质)为原料制备碱式碳酸铜的流程如图所示:
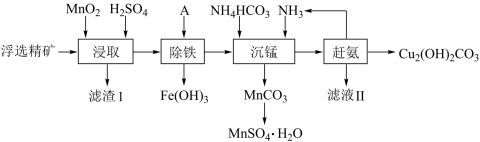
已知:①有关金属离子形成氢氧化物沉淀的 范围如下:
范围如下:
② 常温稳定,在热水中会分解生成
常温稳定,在热水中会分解生成 ;
;
③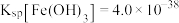 。
。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有_______ 、_______ (任写两种)。
(2)滤渣Ⅰ经 提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除
提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除 外还有
外还有_______ (填化学式)。
(3)常温下“除铁”时加入的试剂A可用 ,调节
,调节 的范围为
的范围为_______ ,若加A后将溶液的 调为5,则溶液中
调为5,则溶液中 的浓度为
的浓度为_______  。
。
(4)写出“沉锰”(除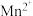 )过程中反应的离子方程式:
)过程中反应的离子方程式:_______ 。
(5)“赶氨”时,最适宜的操作方法是_______ 。
 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示:
等杂质)为原料制备碱式碳酸铜的流程如图所示:
已知:①有关金属离子形成氢氧化物沉淀的
 范围如下:
范围如下:②
 常温稳定,在热水中会分解生成
常温稳定,在热水中会分解生成 ;
;③
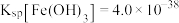 。
。| 金属离子 |  | 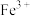 | 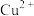 |  |
开始沉淀的 | 7.2 | 2.7 | 5.6 | 8.3 |
完全沉淀的 | 9.0 | 3.7 | 6.7 | 9.8 |
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣Ⅰ经
 提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除
提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除 外还有
外还有(3)常温下“除铁”时加入的试剂A可用
 ,调节
,调节 的范围为
的范围为 调为5,则溶液中
调为5,则溶液中 的浓度为
的浓度为 。
。(4)写出“沉锰”(除
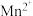 )过程中反应的离子方程式:
)过程中反应的离子方程式:(5)“赶氨”时,最适宜的操作方法是
您最近一年使用:0次
名校
解题方法
2 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮。
①人工固氮,将N2→NH3,N2发生___ 反应(填“氧化”或“还原”)
②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3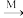 Ca(NO3)2。
Ca(NO3)2。
写出NO→NO2→HNO3的化学方程式___ 、___ 。
将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___ (写化学式)。
(2)科学合理地保存、施用氮肥。
①NH4HCO3需阴凉处保存,原因是___ (写化学方程式)。
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式___ 。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如图所示(转化所需试剂及条件已略去):
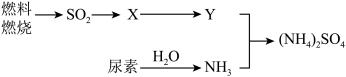
①Y与NH3反应生成(NH4)2SO4的化学方程式___ 。
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3。则尿素中C元素化合价为___ 。
(1)将N2转化为含氮化合物的过程称为固氮。
①人工固氮,将N2→NH3,N2发生
②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3
 Ca(NO3)2。
Ca(NO3)2。写出NO→NO2→HNO3的化学方程式
将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M
(2)科学合理地保存、施用氮肥。
①NH4HCO3需阴凉处保存,原因是
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如图所示(转化所需试剂及条件已略去):

①Y与NH3反应生成(NH4)2SO4的化学方程式
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3。则尿素中C元素化合价为
您最近一年使用:0次
17-18高三上·北京·期中
名校
解题方法
3 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
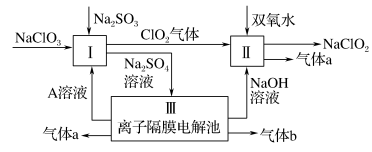
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____ 。
(3)Ⅲ中离子隔膜电解池的装置如下:
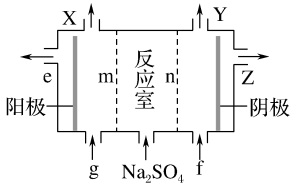
①A的化学式是________ ,A在____ 口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____ 。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。

(1)Ⅰ中发生反应的还原剂是
(2)Ⅱ中反应的离子方程式是
(3)Ⅲ中离子隔膜电解池的装置如下:

①A的化学式是
②m为
③结合化学用语和文字说明解释NaOH产生的原因:
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者
您最近一年使用:0次
13-14高一下·辽宁鞍山·期末
名校
解题方法
4 . 地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面根据海水资源综合利用,请回答下列问题:
(1)淡化海水的方法有________________ (写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________ (填化学式),之后________ (填操作名称),再加入适量________ (填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)由无水MgCl2制取金属镁的常用工业方法是__________________ 。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是__________ 。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,写出反应的离子方程式____________ 。再H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________ 。
(1)淡化海水的方法有
(2)由无水MgCl2制取金属镁的常用工业方法是
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,写出反应的离子方程式
您最近一年使用:0次
2018-07-03更新
|
146次组卷
|
5卷引用:2013-2014学年辽宁省鞍山市高一下学期期末考试化学(A卷)试卷
(已下线)2013-2014学年辽宁省鞍山市高一下学期期末考试化学(A卷)试卷2014-2015学年湖北省枣阳一中高一下学期第三次月检考试化学试卷【全国百强校】新疆生产建设兵团第二中学2017-2018学年高一下学期期末考试化学试题山东济南市历城第二中学2019-2020学年高一下学期开学考试化学试题河南省林州市第一中学2022-2023学年高二上学期开学考试化学试题
解题方法
5 . 金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S=6Cu+SO2
该反应的氧化剂是_________ ,当生成19.2gCu时,反应中转移的电子为_____ mol。铜在潮湿的空气中能发生吸氧腐蚀而生成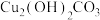 (碱式碳酸同)。该过程负极的电极反应式
(碱式碳酸同)。该过程负极的电极反应式_______________ 。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体 陶瓷(可传导
陶瓷(可传导 )为电解质,其原理如图所示:
)为电解质,其原理如图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在_______ 。
a.100 ℃以下 b.100 ℃~300 ℃ c.300 ℃~350 ℃ d.350 ℃~2050 ℃
②放电时,电极A为____ 极,S发生_______ 反应。
③放电时,内电路中的 的移动方向为
的移动方向为_______ (填“从A到B”或“从B到A”)。
④充电时,总反应为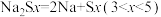 ,钠所在电极与直流电源
,钠所在电极与直流电源_______ 极相连,阳极的电极反应式为________ .
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S=6Cu+SO2
该反应的氧化剂是
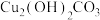 (碱式碳酸同)。该过程负极的电极反应式
(碱式碳酸同)。该过程负极的电极反应式(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠
 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体 陶瓷(可传导
陶瓷(可传导 )为电解质,其原理如图所示:
)为电解质,其原理如图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在
| 物质 |
|
|
|
| 熔点/ ℃ | 97.8 | 115 | 2050 |
| 沸点/ ℃ | 892 | 444.6 | 2980 |
②放电时,电极A为
③放电时,内电路中的
 的移动方向为
的移动方向为④充电时,总反应为
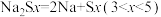 ,钠所在电极与直流电源
,钠所在电极与直流电源
您最近一年使用:0次
2016-12-09更新
|
385次组卷
|
3卷引用:2015届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷
2015届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷2015届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷(已下线)寒假作业09 电解池 金属的腐蚀与防护-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
解题方法
6 . 工业上用铝土矿(主要成分是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:
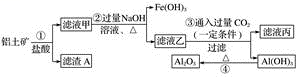
请回答下列问题:
(1)请写主要成分的化学式:滤渣A________ ,滤液丙中的溶质是NaCl和________ 。
(2)反应②中Al3+反应的离子方程式为_________________ ;反应③的离子方程式为____________ ;反应④的化学方程式为______________________________ 。

请回答下列问题:
(1)请写主要成分的化学式:滤渣A
(2)反应②中Al3+反应的离子方程式为
您最近一年使用:0次
2016-12-09更新
|
577次组卷
|
4卷引用:2014-2015湖南省娄底市高一上学期期末考试化学试卷
2014·湖南益阳·一模
解题方法
7 . 海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。
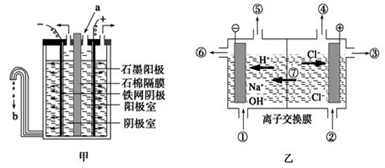
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式____________________________________ 。
(2)图甲中流出的b是______________________ 溶液。
(3)石棉隔膜的作用是______________________________________________ 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是_______ 、______________ 。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH________ g。
Ⅲ.下图是工业上生产镁的流程。

(1)写出下列反应的化学方程式:
①沉淀池:_____________________ ; ②电解:______________________________ ;
(2)整个生产流程中循环使用的物质是______________ 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项:__________________ 。

Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式
(2)图甲中流出的b是
(3)石棉隔膜的作用是
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH
Ⅲ.下图是工业上生产镁的流程。

(1)写出下列反应的化学方程式:
①沉淀池:
(2)整个生产流程中循环使用的物质是
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项:
您最近一年使用:0次
解题方法
8 . 某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是___ ;
(2)“酸溶”中反应的离子方程式是___ ;
(3)“过滤”后滤液中金属阳离子有___ ;
(4)“氧化”中使用的氧化剂最好是___ ;

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是
(2)“酸溶”中反应的离子方程式是
(3)“过滤”后滤液中金属阳离子有
(4)“氧化”中使用的氧化剂最好是
您最近一年使用:0次
2016-12-09更新
|
226次组卷
|
2卷引用:2014-2015湖南省娄底市高一上学期期末考试化学试卷
10-11高二下·浙江嘉兴·期中
解题方法
9 . 目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。
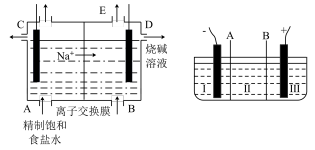
(1)下列说法不正确的是__________
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为_______ 离子交换膜、B为_______ 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在_______ 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为_______ ,在III区得到_______ 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:_______

(1)下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为
您最近一年使用:0次





