1 . 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
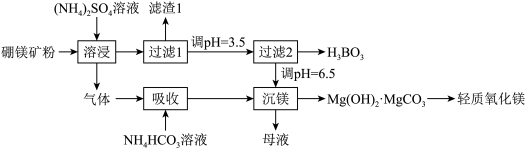
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________ 。
(2)“滤渣1”的主要成分有_________ 。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________ 。
(3)根据H3BO3的解离反应:H3BO3+H2O H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是
H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是_______ 酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________ 。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________ ,母液经加热后可返回___________ 工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________ 。

回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为
(2)“滤渣1”的主要成分有
(3)根据H3BO3的解离反应:H3BO3+H2O
 H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是
H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为
您最近半年使用:0次
2019-06-09更新
|
18050次组卷
|
27卷引用:2019年全国统一考试化学试题(新课标Ⅰ)
2019年全国统一考试化学试题(新课标Ⅰ)【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题2020届高考化学小题狂练(全国通用版)专练18 物质的检验、分离和提纯湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)山东省潍坊市实验中学2021-2022学年高三9月单元测试(入学考试)化学试题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题15-19海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题(已下线)题型65 草酸和草酸盐、硼及其化合物的性质和用途(已下线)专题18 工艺流程题(已下线)T26-工业流程题云南省宣威市第三中学2023-2024学年高三上学期收心考化学试题北京市陈经纶中学2023-2024学年高三上学期10月月考化学试卷 安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题
名校
解题方法
2 . 常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)石墨中化学键类型为______________ ,在电池中的作用为_________________
(2) 酸性锌锰干电池的负极反应为_________________________
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式_____________
(4)填充物用60℃温水溶解,目的是_____________________ 。
(5)操作A的名称为______________ 。
(6)铜帽溶解时加入H2O2的目的是_______________________ (用化学方程式表示)

(1)石墨中化学键类型为
(2) 酸性锌锰干电池的负极反应为
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式
(4)填充物用60℃温水溶解,目的是
(5)操作A的名称为
(6)铜帽溶解时加入H2O2的目的是
您最近半年使用:0次
2019-05-17更新
|
701次组卷
|
4卷引用:【全国百强校】江西省南昌市第二中学2018-2019学年高一下学期第二次月考化学试题
【全国百强校】江西省南昌市第二中学2018-2019学年高一下学期第二次月考化学试题(已下线)【南昌新东方】2019 南昌二中 高一下 第二次月考人教版2019必修第二册 第六章 第一节 第3课时 化学电池江苏省宿迁市泗阳县实验高级中学2021-2022学年高一下学期第二次质量调研化学试题
名校
解题方法
3 . 高铁酸钾是绿色、环保型水处理剂。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
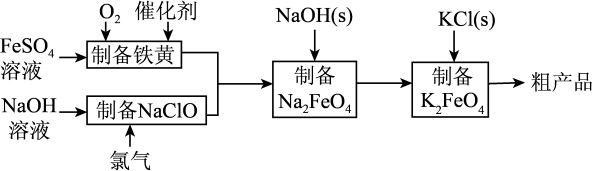
回答下列问题:
(1)已知:常温下,Ksp[Fe(OH)3]=4.0×10—38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=____ mol•L﹣1
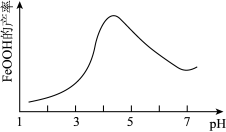
(2)制备铁黄的离子方程式为__________ 。实验测得反应溶液的pH对铁黄产率的影响如图所示。pH大于4.5时铁黄产率逐渐降低的主要原因可能是__________ 。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:
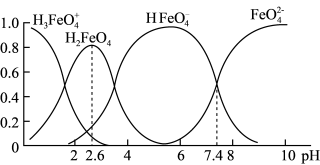
①pH=2.6时,溶液中主要含铁形体浓度的大小关系为________ 。
②已知H3FeO4+电离常数分别为:K1=2.51×10—2,K2=4.16×10—4,K3=5.01×10—8,当pH=4时,溶液中 =
=________ 。
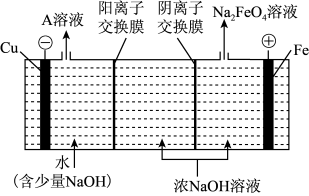
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应式为__________ ;其中可循环使用的物质____________ 。

回答下列问题:
(1)已知:常温下,Ksp[Fe(OH)3]=4.0×10—38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=
(2)制备铁黄的离子方程式为

(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:

①pH=2.6时,溶液中主要含铁形体浓度的大小关系为
②已知H3FeO4+电离常数分别为:K1=2.51×10—2,K2=4.16×10—4,K3=5.01×10—8,当pH=4时,溶液中
 =
=(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应式为

您最近半年使用:0次
解题方法
4 . 过硫酸(H2S2O8)为无色晶体,易溶于水,在热水中易水解。
(1)依据硫酸和过硫酸的结构式,下列说法正确的是______ (填序号)。
a.硫酸和过硫酸均为共价化合物
b. 过硫酸分子中含有与过氧化氢分子中相同的化学键
c. 过硫酸分子可看作2个硫酸分子脱去1个水分子
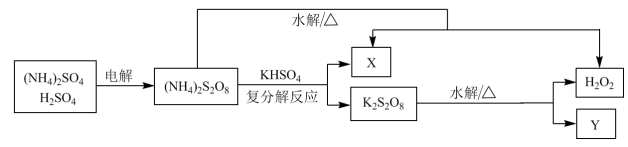
(2)工业上利用过硫酸铵制备过氧化氢的一种方法如下图。
①电解法制(NH4)2S2O8过程中,得到S2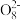 的电极反应式是
的电极反应式是______ 。
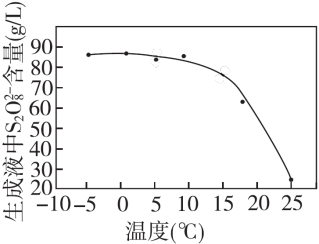
② 其他条件一定,电解相同时间后,测得生成液中S2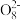 含量随温度变化如图。电解时通常控制15℃而不用更低温度的原因:
含量随温度变化如图。电解时通常控制15℃而不用更低温度的原因:______ 。
③X的化学式是______ 。
④过硫酸盐的水解反应______ (填“属于”或“不属于”)氧化还原反应。
⑤下图中a~e表示S2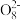 中的部分化学键,则S2
中的部分化学键,则S2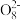 发生水解反应时断裂的化学键是
发生水解反应时断裂的化学键是______ (选填字母)。

(3)过硫酸钾氧化法可用于分析锰钢中Mn元素的含量:取样品a g,加入过量浓硝酸,在加热条件下将Mn溶出,再用b L 过硫酸钾溶液将溶出的Mn2+全部转化为 ,检测
,检测 浓度,计算得出样品中Mn元素的质量分数为c。
浓度,计算得出样品中Mn元素的质量分数为c。
①该实验条件下氧化性:S2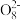
______  (填“>”或“<”)。
(填“>”或“<”)。
②该过程中过硫酸钾溶液的浓度至少是______ mol/L(用含a、b、c的代数式表示)。
| 物质 | 硫酸 | 过硫酸 |
| 结构式 | 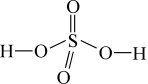 | 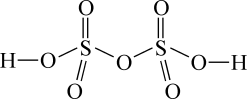 |
a.硫酸和过硫酸均为共价化合物
b. 过硫酸分子中含有与过氧化氢分子中相同的化学键
c. 过硫酸分子可看作2个硫酸分子脱去1个水分子
(2)工业上利用过硫酸铵制备过氧化氢的一种方法如下图。

①电解法制(NH4)2S2O8过程中,得到S2
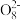 的电极反应式是
的电极反应式是② 其他条件一定,电解相同时间后,测得生成液中S2
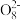 含量随温度变化如图。电解时通常控制15℃而不用更低温度的原因:
含量随温度变化如图。电解时通常控制15℃而不用更低温度的原因:
③X的化学式是
④过硫酸盐的水解反应
⑤下图中a~e表示S2
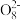 中的部分化学键,则S2
中的部分化学键,则S2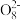 发生水解反应时断裂的化学键是
发生水解反应时断裂的化学键是
(3)过硫酸钾氧化法可用于分析锰钢中Mn元素的含量:取样品a g,加入过量浓硝酸,在加热条件下将Mn溶出,再用b L 过硫酸钾溶液将溶出的Mn2+全部转化为
 ,检测
,检测 浓度,计算得出样品中Mn元素的质量分数为c。
浓度,计算得出样品中Mn元素的质量分数为c。①该实验条件下氧化性:S2
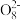
 (填“>”或“<”)。
(填“>”或“<”)。②该过程中过硫酸钾溶液的浓度至少是
您最近半年使用:0次
解题方法
5 . 磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的三种方法。回答下列问题:
I.直接法
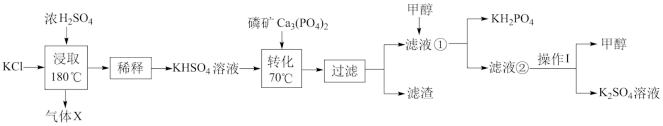
(1)气体X为___________ (填化学式);
(2)“浸取”步骤,浓硫酸能与KCl能发生化学反应的原因是___________________ ;
(3)“转化”步骤发生反应的离子反应方程式_______________ (已知:Ca3(PO4)2难溶于水);
(4)滤液①中加入甲醇的作用是__________________________ ;
(5)“操作I”是___________________________________ ;
II.中和反应法
(6)氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾。写出此反应的离子反应方程式_______________________________ ;由下图判断制备磷酸二氢钾(达80%)的最佳pH范围______________________ ;
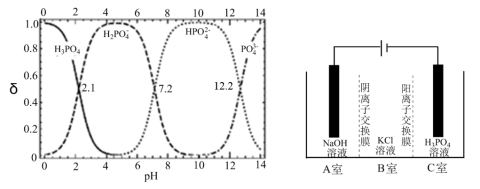
Ⅲ.电解法制取KH2PO4的原理如上图所示。一定条件下,还可得到NaClO3。
(7)在_____ 室(填标号)可得到KH2PO4;写出产生ClO3-的电极反应式______________ 。
I.直接法

(1)气体X为
(2)“浸取”步骤,浓硫酸能与KCl能发生化学反应的原因是
(3)“转化”步骤发生反应的离子反应方程式
(4)滤液①中加入甲醇的作用是
(5)“操作I”是
II.中和反应法
(6)氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾。写出此反应的离子反应方程式

Ⅲ.电解法制取KH2PO4的原理如上图所示。一定条件下,还可得到NaClO3。
(7)在
您最近半年使用:0次
名校
解题方法
6 . 氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如下图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3) 42+、Cd(NH3)42+、AsCl52-的形式存在。

请回答下列问题:
(1)当NH4Cl、NH3·.H2O的混合溶液中存在c(NH4+)=c(Cl-)时,溶液呈___ (填“酸”、“碱”或“中”)性。
(2)Zn(NH3)42+中Zn的化合价为____ ,“溶浸”中ZnO发生反应的离子方程式为____ 。
(3)一定时间内,锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为_____ 。

(4)实验室实现操作II”所用的玻璃仪器有___ ,玻璃棒和烧杯等 “滤渣3”的主要成分为__ 。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_____ 。电解后的电解液经补充__ (写一种物质的化学式)后可返回“溶浸”工序继续使用。

请回答下列问题:
(1)当NH4Cl、NH3·.H2O的混合溶液中存在c(NH4+)=c(Cl-)时,溶液呈
(2)Zn(NH3)42+中Zn的化合价为
(3)一定时间内,锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为

(4)实验室实现操作II”所用的玻璃仪器有
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为
您最近半年使用:0次
解题方法
7 . Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:
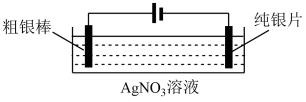
(1)阴极反应式为___________ 。
(2)精炼过程中,AgNO3溶液的浓度将___________ (填“增大”、“减小”或“不变”);原因是___________ 。
Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO3、Pd(NO3)2、Cu(NO3)2、Fe(NO3)3、Ni(NO3)2、HNO3等]为原料生产“钯金”,流程如下:

(3)定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)=___________ ,(Ksp[Ni(OH)2]=2.0×10-15、Ksp[Fe(OH)3]=4.0×10-38)。
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为___________ 。
(5)为保证产品的纯净,“沉淀”过程中所得滤渣需要洗涤,简述检验滤渣是否洗净的实验方法___________ 。
(6)写出“还原”步骤中发生反应的离子方程式:___________ 。

(1)阴极反应式为
(2)精炼过程中,AgNO3溶液的浓度将
Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO3、Pd(NO3)2、Cu(NO3)2、Fe(NO3)3、Ni(NO3)2、HNO3等]为原料生产“钯金”,流程如下:

(3)定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)=
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为
(5)为保证产品的纯净,“沉淀”过程中所得滤渣需要洗涤,简述检验滤渣是否洗净的实验方法
(6)写出“还原”步骤中发生反应的离子方程式:
您最近半年使用:0次
名校
解题方法
8 . 二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:
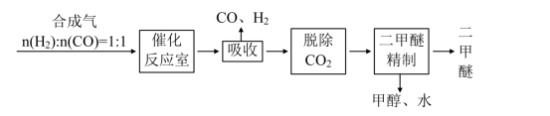
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________ 反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH= _____________ 。该反应的平衡常数表达式为:_______ ;在830℃时K=1.0,则在催化反应室中该反应的K______ 1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________ 。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。

a电极是________ 极,其电极反应方程式为_________________ 。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③(1)甲烷氧化可制得合成气,反应如下:CH4(g)+
 O2(g)
O2(g) CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是(2)催化反应室中总反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH= (3)上述反应中,可以循环使用的物质有
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。

a电极是
您最近半年使用:0次
2019-04-19更新
|
268次组卷
|
2卷引用:【全国百强校】贵州省南白中学、遵义县一中2018-2019学年高二下学期第一次联考化学试题
解题方法
9 . 镍是制取各种高强度合金、耐热材料的重要金属之一。以粗氧化镍(主要含NiO、CoO、Fe2O3等)为原料制备纯镍的流程示意图如下:
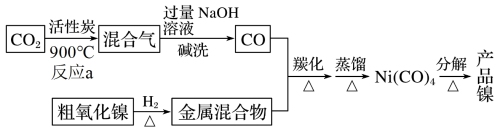
回答下列问题:
(1)已知:C(s)+O2(g)=CO2(g) △H1=+393.5kJ·mol-1
CO(g)+)+ O2(g)=CO2(g) △H2=-283.0kJ·mol-1
O2(g)=CO2(g) △H2=-283.0kJ·mol-1
反应a的化学方程式为___________ ,既有利于提高反应a的速率,又有利于提高原料CO2平衡转化率的措施是___________ 。
(2)用离子方程式表示碱洗过程发生的反应___________ 。
(3)镍的羰化反应为:Ni(s)+4CO(g) Ni(CO)4(g) △H。
Ni(CO)4(g) △H。
①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,3s后测得Ni(CO)4的物质的量为0.6mol,则0~3s内平均反应速率v(CO)=___________ mol·L-1·s-1。
②镍的羰化反应平衡常数表达式为K=___________ ,当温度升高时,K减小,则该反应的△H___________ 0(填“>”或“<”或“=”)
(4)羰化后的产物为Fe(CO)5、Co2(CO)8、Ni(CO)4,有关性质如下:
蒸馏提取Ni(CO)4应选择的适宜温度范围是___________ 。
(5)采用230℃分解Ni(CO)4(g)制取金属镍,所获金属镍中常常含有碳,原因是___________ (运用化学平衡移动原理解释)。

回答下列问题:
(1)已知:C(s)+O2(g)=CO2(g) △H1=+393.5kJ·mol-1
CO(g)+)+
 O2(g)=CO2(g) △H2=-283.0kJ·mol-1
O2(g)=CO2(g) △H2=-283.0kJ·mol-1反应a的化学方程式为
(2)用离子方程式表示碱洗过程发生的反应
(3)镍的羰化反应为:Ni(s)+4CO(g)
 Ni(CO)4(g) △H。
Ni(CO)4(g) △H。①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,3s后测得Ni(CO)4的物质的量为0.6mol,则0~3s内平均反应速率v(CO)=
②镍的羰化反应平衡常数表达式为K=
(4)羰化后的产物为Fe(CO)5、Co2(CO)8、Ni(CO)4,有关性质如下:
| 物质 | 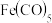 | 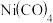 | 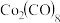 |
| 沸点/℃ | 106 | 43.2 | 52 |
| 熔点/℃ | -20 | -19.3 | 31 |
| 分解温度/℃ | >160 | 135 | —— |
蒸馏提取Ni(CO)4应选择的适宜温度范围是
(5)采用230℃分解Ni(CO)4(g)制取金属镍,所获金属镍中常常含有碳,原因是
您最近半年使用:0次
名校
解题方法
10 . I.海水开发利用的部分过程如图所示。
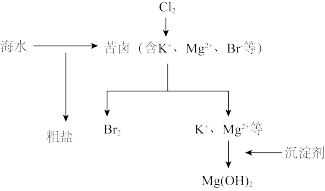
(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为_______________________ 。
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为_________________________________ 。也可用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1 mol Br2时,转移的电子为_____ mol。
(3)下列有关海水综合利用的说法错误的是_______________ 。
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用Ca(OH)2作为沉淀剂
D.海水提镁涉及到复分解反应
II. C、N、O、Na、Al、S、Cl是常见的元素。
(1)C元素位于元素周期表的位置___________________ ;C元素的一种同位素可以测定文物年代,这种同位素的符号为_______________ 。
(2)用“>”、“<”或“=”填空
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3+3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______________ ,其电子式为__________________ 。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为____________________ ,能证明其递变规律的事实是_______________ (填字母)
A.氧化物对应水化物的酸性
B.气态氢化物的沸点
C.单质与氢气反应的难易程度
D.气态氢化物的稳定性

(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为
(3)下列有关海水综合利用的说法错误的是
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用Ca(OH)2作为沉淀剂
D.海水提镁涉及到复分解反应
II. C、N、O、Na、Al、S、Cl是常见的元素。
(1)C元素位于元素周期表的位置
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为
A.氧化物对应水化物的酸性
B.气态氢化物的沸点
C.单质与氢气反应的难易程度
D.气态氢化物的稳定性
您最近半年使用:0次



